学習目標
このセクションの終わりまでに、次のことができます。
- 熱伝達を調べます。
- 熱伝達から最終温度を計算します。
これまで、熱伝達による温度変化について議論してきました。 氷が溶けて液体の水になった場合(すなわち、相変化中)、熱伝達から温度変化は起こらない。 例えば、太陽によって暖められた屋根の上で溶けるつららから滴る水を考えてみましょう。 逆に、水は低温の環境によって冷却された氷の皿の中で凍ります。

図1. 空気からの熱は、それが溶融する原因となる氷に移動します。 (クレジット:マイクブランド)
固体中の分子間の凝集結合は、液体中で分子が同等の運動エネルギーで動き回ることができるように分解されなけ; したがって、温度の上昇はない。 同様に、液体中の分子が引力を介して互いに相互作用するため、液体を蒸発させるためにエネルギーが必要である。 相変化が完了するまで温度変化はありません。 最初は0℃のソーダのカップの温度は、すべての氷が溶けるまで0℃のままです。 逆に、エネルギーは、通常、熱エネルギーの形で、凍結および凝縮の間に放出される。 仕事は分子が一緒に持って来られるとき凝集力によって行われます。 対応するエネルギーは、それらが一緒にとどまることを可能にするために放出されなければならない(消散される)図2.
相変化に関与するエネルギーは、結合または力対の数と強さの二つの主要な要因に依存します。
相変化に関与するエネルギーは、結合または力対の数 結合の数は、分子の数に比例し、したがって試料の質量に比例する。 力の強さは分子の種類によって異なります。 質量mの試料の相を変化させるために必要な熱Qは、
Q=mLf(融解/凍結,
Q=mLv(気化/凝縮),
ここで、融解潜熱Lf、気化潜熱Lvは、実験的に決定される材料定数である。 (表1)を参照してください。

図2とラベル付けされています。 (a)エネルギーは、液体を形成するために固体中の分子間の引力を部分的に克服するために必要とされる。 その同じエネルギーは起こるために凍結のために取除かれなければならない。 (b)分子は、液体から蒸気に移動するときに大きな距離によって分離され、分子の引力を克服するために重要なエネルギーを必要とする。 凝縮が起こるためには、同じエネルギーを除去する必要があります。 相変化が完了するまで温度変化はありません。潜熱はJ/kgの単位で測定されます。
潜熱はJ/kgの単位で測定されます。 LfとLvの両方は、物質、特に先に述べたようにその分子力の強さに依存する。 LfおよびLvは総称して潜熱係数と呼ばれます。 相変化では、エネルギーがシステム内の温度変化を引き起こさずにシステムに出入りするため、それらは潜在的または隠されています。 LfとLvの代表的な値を、融点と沸点とともに表1に示します。
表は、かなりの量のエネルギーが相変化に関与していることを示しています。 たとえば、0℃で1キログラムの氷を溶かして0℃で1キログラムの水を生成するために必要なエネルギーの量を見てみましょう。温度の変化の式と表1の水の値を使用すると、Q=mLf=(1.0kg)(334kJ/kg)=334kJは1kgの氷を溶かすエネルギーである。 これは0º cからの79.8º cに液体水の1つのkgの温度を上げるのに必要とされる同じ量のエネルギーを表すので多くのエネルギーである。 水を蒸発させるにはさらに多くのエネルギーが必要であり、通常の沸点(大気圧で100℃)で1kgの液体水を蒸気(水蒸気)に変えるには2256kJが必要です。 この例では、相変化のエネルギーは、相変化のない温度変化に関連するエネルギーと比較して巨大であることを示しています。
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. 例えば、ほとんどの熱伝達が空気中に水を蒸発させることになるため、湿度の高い気候の気温が35.0℃を超えることはめったにないという事実を取 同様に、水蒸気が凝縮すると巨大な熱が放出されるため、湿気の多い天候の温度は露点を下回ることはめったにありません。
−20℃の氷のサンプルに熱を加えることを考慮することにより、相変化の影響をより正確に調べます(図3)。 氷の温度は直線的に上昇し、0º Cに達するまで0.50cal/g º Cの一定速度で熱を吸収する。 この温度になると、氷はすべての氷が溶けるまで溶け始め、79.8cal/gの熱を吸収します。 この相変化の間、温度は0º Cで一定のままです。 すべての氷が溶けると、液体の水の温度が上昇し、1.00cal/g º Cの新しい一定速度で熱を吸収します。 100º Cで、水は沸騰し始め、水がこの相変化の間に熱の539cal/gを吸収する間、温度は再度一定している残る。 すべての液体が蒸気蒸気になると、温度は再び上昇し、0.482cal/g º Cの速度で熱を吸収する。
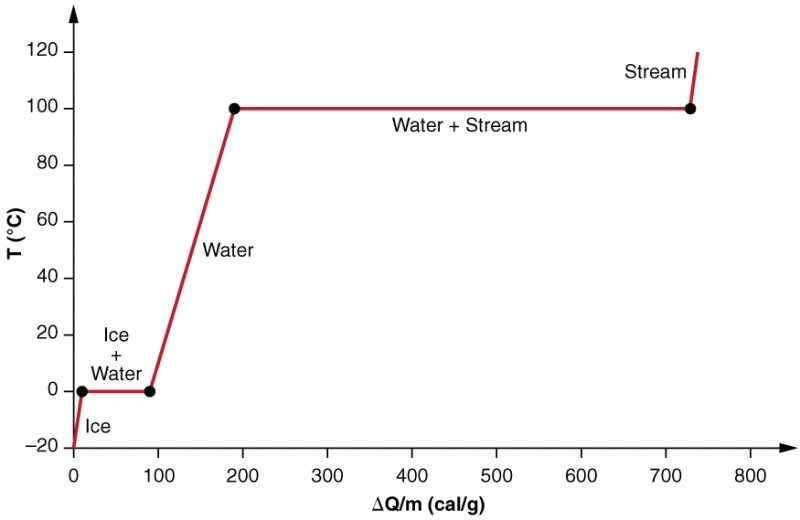
図3。 温度とエネルギーのグラフが追加されました。 このシステムは、氷が温めて液体の水になる間に蒸気が蒸発しないように構成されており、気化が起こると蒸気がシステムの中に残るように構成さ 0º cおよび100º Cの一定した温度の価値の長い伸張は溶けることおよび蒸発の大きい潜熱を、それぞれ反映する。水は沸点以下の温度で蒸発する可能性があります。
水は沸点以下の温度で蒸発する可能性があります。 100℃以下の温度での水分子の運動エネルギーは100℃のそれよりも小さいので、沸点よりも多くのエネルギーが必要であり、したがって、ランダムな熱運動から得られるエネルギーはより少ない。 例えば、体温では、皮膚からの汗は2428kJ/kgの入熱を必要とし、これは100℃での蒸発潜熱よりも約10%高いという事実を取る。 この熱は皮膚から来ているため、暑い季節に効果的な冷却機構を提供します。 体温が上昇する可能性があるように、高湿度は、蒸発を阻害し、あなたの眉にunevaporated汗を残します。
例1. 相変化から最終温度を計算する:氷でソーダを冷却する
三つの氷は、質量msoda=0.25kgで20℃でソーダを冷却するために使用されます。 氷は0º Cにあり、各角氷に6.0g.の固まりがある。 ソーダは水と同じ熱容量を持っていると仮定します。 すべての氷が溶けたときの最終温度を見つけます。
戦略
氷は0℃の融解温度にあります。 熱は融解のためにソーダから氷に伝達される。 氷の融解は2つのステップで起こります:最初に相変化が起こり、固体(氷)が融解温度で液体の水に変換され、次にこの水の温度が上昇します。 融解すると0℃で水が得られるため、水とソーダシステムが熱平衡に達するまで、より多くの熱がソーダからこの水に伝達されます。Qice=−Qsoda。
氷に伝達される熱は
Qice=mice Lf+micecW(Tf−0º C)です。ソーダによって放出される熱はQsoda=msodacW(Tf−20º C)です。
ソーダによって放出される熱はQsoda=msodacW(Tf-20º C)です。 熱が失われないので、Qice=−Qsoda、そのように
マウスLf+micecW(Tf−0º C)=–msodacW(Tf−20º C)。左辺にTfを含むすべての項を、右辺に他のすべての項を表示します。
左辺にTfを含むすべての項を表示します。
左辺にTfを含むすべての項を表示 未知の量Tfを解く:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
溶液
- 既知の量を識別します。 氷の質量はマウス=3×6.0g=0.018kg、ソーダの質量はmsoda=0.25kgである。分子内の項を計算する:m sodacW(20º C)=(0.25kg)(4186J/kg º C)(20º C)=20,930Jおよびmicelf=(0.018kg)(334,000J/kg)=6012J。
- 分母を計算する:(MSODA+マウス)CW=(0.25kg+0。018kg)(4186K/(kg θ C)=1122J/Θ C.
- 最終温度を計算する:\displaystyle{T}_{\text{f}}=\frac{20,930\text{J}-6012\text{J}}{1122\text{J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
議論
この例は、相変化の間に関与する巨大なエネルギーを示しています。 氷の質量は水の質量の約7%ですが、ソーダの温度に顕著な変化をもたらします。 私たちは氷が凍結温度にあったと仮定しましたが、これは間違っています:典型的な温度は−6º Cです。 しかし、この補正は、我々が見つけた結果と本質的に同一の最終温度を与える。 理由を説明できますか?

図4. アイスティーのガラスに結露。 私たちは、気化が周囲から液体への熱伝達を必要とし、エネルギーが周囲から放出されることを見てきました。 凝縮は逆のプロセスであり、周囲の温度を上昇させる。 この増加は、凝縮を冷たい物体、例えば図のガラスに関連付けるので、驚くべきことに見えるかもしれません。 しかし、蒸気を凝縮させるためには、凝縮分子からエネルギーを除去する必要があります。 エネルギーは、液体から蒸気への他の方向への相変化を行うために必要なものとまったく同じであるため、Q=mLvから計算することができます。
近くの空気の温度が露点以下に低下するため、図4では凝縮が形成されます。 空気は室温で行ったように多くの水を保持することができないので、水が凝縮します。 水が凝縮するとエネルギーが放出され、ガラス内の氷の融解が促進されます。
現実世界のアプリケーション
液体が凍結するとエネルギーも放出されます。 この現象は、温度が凝固点(0℃)に近いときにオレンジを保護するためにフロリダ州の果物栽培者によって使用されます。 栽培者は果樹園の植物に水を吹きかけ、水が凍り、熱が木の成長しているオレンジに解放されるようにします。 これにより、オレンジの内部の温度が氷点下に下がるのを防ぎ、果実を損傷します。

図14.11. これらの木の氷は、凍ったときに大量のエネルギーを放出し、木の温度が0℃以下に低下するのを防ぐのに役立ちます。 水は果樹園で堅い霜を防ぐのを助けるように意図的に吹きかかる。 昇華は固体から気相への遷移である。
昇華は固体から気相への遷移である。 あなたは雪が液体の水の痕跡、または冷凍庫内の氷の消失なしに薄い空気の中に消えることができることに気づいたかもしれません。 逆もまた真実です:霜は液体の段階を通過することなく非常に冷たい窓に形成することができます。 一般的な効果は、固体の二酸化炭素であるドライアイスからの”煙”の製造である。 昇華は、固体の平衡蒸気圧がゼロではないために起こる。 ある特定の芳香剤は部屋に香水を注入するのに固体の昇華を使用します。 蛾の球は昇華するフェノール(有機化合物)のわずかに有毒な例ですが、四酸化オスミウムのようないくつかの固体は非常に有毒であり、昇華生成された蒸気への人間の暴露を防ぐために密封された容器に保管しなければなりません。

図5. 固体と蒸気の間の直接遷移は一般的であり、時には有用であり、さらには美しいものでさえある。 (a)ドライアイスは二酸化炭素のガスに直接昇華します。 目に見える蒸気は水滴でできています。 (credit:Windell Oskay)(b)霜は非常に冷たい窓の上にパターンを形成し、蒸気から直接形成された固体の例である。 (クレジット:Liz West)
すべての相転移は熱を伴います。 直接固体-蒸気遷移の場合、必要なエネルギーは式Q=mLsで与えられ、ここでLsは昇華熱であり、これは1を変化させるのに必要なエネルギーである。固相から気相への物質の00kg。 LsはLfおよびLvに類似しており、その値は物質に依存する。 昇華はエネルギー入力を必要とするので、ドライアイスは効果的な冷却剤であり、逆のプロセス(すなわちフロスティング)はエネルギーを放出する。 昇華に必要なエネルギー量は、他の相転移のエネルギー量と同じ大きさである。
このセクションと前のセクションで提示された材料は、温度と相変化に関連する任意の数の効果を計算することができます。 いずれの場合も、どの温度変化と相変化が起こっているかを特定し、適切な式を適用する必要があります。 熱伝達と作業は温度と相変化の両方を引き起こす可能性があることに注意してください。
熱伝達の影響の問題解決戦略
- 状況を調べて、温度または位相に変化があることを判断します。 システムへの熱伝達またはシステムからの熱伝達はありますか? 相変化の有無が明らかでない場合は、まず相変化がないかのように問題を解決し、得られた温度変化を調べることができます。 沸騰または融点を過ぎてあなたを取るのに十分である場合は、戻って、ステップで問題を行う必要があります—温度変化、相変化、その後の温度変化など。
- 温度と位相を変化させるすべてのオブジェクトを識別して一覧表示します。
- 問題で何を決定する必要があるかを正確に特定します(未知数を識別します)。 書かれたリストは便利です。
- 与えられたもの、または問題から推論できるもののリストを作成します(knownsを特定します)。
- 決定される量(未知)のための適切な方程式を解きます。 温度変化がある場合、伝達される熱は比熱に依存する(温度変化と熱容量の表1を参照)が、相変化の場合、伝達される熱は潜熱に依存する。 表1を参照してください。
- knownsをその単位と一緒に適切な方程式に代入し、単位で完全な数値解を得ます。 プロセスに複数の段階がある場合(温度変化の後に相変化が続くなど)、これを段階的に行う必要があります。
- 答えを確認して、それが合理的かどうかを確認してください:それは理にかなっていますか? 例として、温度変化が考慮していない相変化を引き起こさないことを確認してください。
あなたの理解を確認してください
日中の気温が氷点下の気温よりも高い場合でも、山の斜面に雪が残るのはなぜですか?
溶液
雪は氷の結晶から形成され、したがって水の固相である。 相変化には膨大な熱が必要であるため、空気が0℃を超えていても、この熱が空気から蓄積されるのに一定の時間がかかります。 空気が暖かくなればなるほど、この熱交換が速くなり、雪が溶けやすくなります。
セクションの概要
- ほとんどの物質は、”相”と呼ばれる固体、液体、および気体のいずれかの形態で存在することができます。”
- 相変化は、与えられた圧力で与えられた物質の固定温度で起こり、これらの温度は沸騰点および凍結点(または融解点)と呼ばれます。相変化の間、吸収または放出される熱は、Q=mLここで、Lは潜熱係数である。
- 相変化の間、吸収または放出される熱は、q=mLによって与えられる。
- 相変化
概念的な質問
- 熱伝達は温度と相変化を引き起こす可能性があります。 他に何がこれらの変更を引き起こす可能性がありますか?
- 水の潜熱は、大量の水の近くで気温の低下を遅らせ、おそらく温度がΘ Cを大幅に下回るのを防ぐのにどのように役立ちますか?
- 水を凍結することによって形成された直後の氷の温度は何ですか?
- 断熱容器の中のº C水にº C氷を入れた場合、どうなりますか? いくつかの氷は溶けますか、より多くの水は凍結しますか、どちらも行われませんか?
- 氷の水のガラス上の凝縮は、氷が溶ける速度にどのような影響を与えますか? 凝縮は溶けるプロセスのスピードをあげるか、または減速しますか。
- フロリダ州のように水の多数の体がある非常に湿気の多い気候では、温度が約35º C(95º F)を超えることは珍しいです。 しかし、砂漠では、温度はこれをはるかに上回る可能性があります。 湿気の多い気候では、水の蒸発が高温を制限するのにどのように役立つかを説明します。
- 冬には、サンフランシスコでは150km内陸の近くのサクラメントよりも暖かいことがよくあります。 夏には、サクラメントではほぼ常に暑いです。 サンフランシスコ周辺の水域がどのように極端な気温を緩和するかを説明します。
- 沸騰した鍋に蓋をすると、沸騰させ続けるのに必要な熱伝達が大幅に減少します。 理由を説明してください。
- 凍結乾燥食品は真空中で脱水されています。 プロセスの間に、食糧は凍り、脱水を促進するために熱されなければなりません。 真空が脱水をどのようにスピードアップするか、そしてその結果として食物が凍る理由の両方を説明してください。
- まだ空気が夜間に放射することによって冷却されると、温度が露点を下回ることは珍しいことです。 理由を説明してください。
- 物理教室のデモンストレーションでは、インストラクターが口で風船を膨らませ、液体窒素で冷却します。 寒いとき、収縮したバルーンには少量の水色の液体と雪のような結晶が含まれています。 それが温まると、液体が沸騰し、結晶の一部が昇華し、しばらくの間いくつかの結晶が残って液体を生成する。 冷たい気球の青い液体そして2つの固体を識別しなさい。 表1のデータを使用して識別を正当化します。
問題&演習
- 冷凍野菜の0.450kgのパッケージを0º Cで解凍するために必要な熱伝達(キロカロリー単位)は、水の熱と同じ
- 0℃の氷を含む袋は、同じ量の0℃の水を含む袋よりもエネルギーを吸収するのにはるかに効果的です。 (a)0.800kgの水の温度を0º Cから30.0º Cに上げるためには、どのくらいの熱伝達が必要ですか? (b)最初に溶融するために必要な熱伝達の量0.0º C氷の800のkgは次に温度を上げ、か。 (c)あなたの答えがiceがより効果的であるという主張をどのように支持しているかを説明してください。
- (a)2.50kgの水を含む0.750kgのアルミニウム鍋の温度を30.0℃から沸点まで上昇させ、0.750kgの水を沸騰させるには、どれくらいの熱伝達が必要ですか? (b)熱伝達率が500W1ワット=1ジュール/秒(1W=1J/s)の場合、これにはどれくらいの時間がかかりますか?
- 氷の水のガラス上に凝縮の形成は、それがそうでない場合よりも速く氷を溶融させます。 8の場合。00gの凝縮は、水と200gの氷の両方を含むガラス上に形成され、その結果、氷の何グラムが溶けますか? 他の熱伝達が起こらないと仮定します。
- 旅行では、3.50kgの氷の袋があなたのクーラーの中で平均して一日続くことに気付きます。 それが0º Cで始まり、正確に1日1ワット=1ジュール/秒(1W=1J/s)で0º Cの水に完全に溶ける場合、氷に入るワットの平均電力はいくらですか?
- ある乾燥した晴れた日に、スイミングプールの温度は蒸発のためではない場合は1.50℃上昇します。 温度を一定に保つのに十分なエネルギーを正確に運ぶために、水のどの部分が蒸発しなければなりませんか?
- (a)相変化に必要なエネルギーを含め、0.200kgの氷の温度を-20.0℃から130℃に上げるためには、どのくらいの熱伝達が必要ですか? (b)一定の20.0kJ/sの熱伝達速度を仮定して、各段階にどのくらいの時間が必要ですか? (c)このプロセスの温度対時間のグラフを作成します。
- 1986年、南極のロス棚氷から巨大な氷山が壊れました。 全長約160km、40kmの長方形であった。幅0km、厚さ250m。 (a)氷の密度が917kg/m3であることを考えると、この氷山の質量はいくらですか? (b)それを溶かすためにどれくらいの熱伝達(ジュール単位)が必要ですか? (c)氷が100W/m2、12.00h/日の平均を吸収する場合、この厚さの氷を溶かすのに太陽光だけで何年かかるでしょうか?
- コーヒーのどのように多くのグラムは、95.0º Cから45.0º Cにコーヒーを冷却するために100グラムのガラスカップでコーヒーの350グラムから蒸発する必要があ コーヒーは水と同じ熱特性を持ち、蒸発の平均熱は2340kJ/kg(560cal/g)であると仮定することができます。 (あなたはそれが冷却するようにコーヒーの質量の変化を無視することができ、それはあなたに正しいよりもわずかに大きい答えを与えるでしょう。)
- (a)原油タンカーの火災を消火することは困難であり、原油の各リットルは燃焼時に2.80×107Jのエネルギーを放出するためである。 この難しさを説明するために、1.00Lの原油を燃焼させることによって放出されるエネルギーを吸収するために消費されなければならない水のリットルの数を計算し、水の温度が20.0º Cから100º Cに上昇した場合、沸騰し、得られた蒸気は300º Cに上昇する。 (b)原油が水よりも小さい密度を有するという事実によって引き起こされる追加の合併症を議論する。
- 雷雨の凝縮から放出されるエネルギーは非常に大きくなる可能性があります。 半径1kmの小さな嵐のために大気中に放出されるエネルギーを計算し、1.0cmの雨がこの地域で均一に沈殿していると仮定します。
- 霜の損傷を防ぐために、4.00kgの0℃の水を果樹に噴霧します。 (a)水が凍結するとどのくらいの熱伝達が起こりますか? (b)この量の熱が木から伝達された場合、200kgの木の温度はどれくらい低下するでしょうか? 比熱を3.35kJ/kg・Θ Cとし、相変化が起こらないと仮定します。
- 0.250kgのアルミニウムボウルに0.800kgのスープを25.0º Cで保持し、冷凍庫に入れます。 スープの熱特性が水の熱特性と同じであると仮定して、377kJのエネルギーがボウルとスープから伝達された場合の最終温度はいくらですか?
- -30.0º cの0.0500kgの角氷を0.400kgの35.0º Cの水に非常によく絶縁された容器に入れます。 最終的な温度は何ですか?
- 0.0100kgの20.0℃の水を1.20kgの氷のブロック(最初は-15.0℃)に注ぐと、最終的な温度は何ですか? あなたは、水が非常に急速に冷却され、周囲の影響はごくわずかであると仮定することができます。
- 先住民は時々沸騰にそれを持って来るために水に熱い岩を置くことによって水密バスケットで調理します。 0.0250kgの水が最初のシズルから蒸気として逃げるならば、500º cの岩のどの質量を4.00kgの15.0º cの水に入れなければなりませんか? 周囲の影響を無視し、花崗岩の平均比熱を取ることがあります。
- 熱が二つの体の間で転送されたときの最終温度を計算する際の鍋と水の最終温度は何でしょうか:0.260kgの水が鍋に置かれ、0.0100kgの水がすぐに蒸発し、残りは鍋と共通の温度になるようにした場合、熱い鍋に冷たい水を注ぎますか?
- 一部の国では、液体窒素は機械式冷蔵庫の代わりに乳製品トラックに使用されています。 A3.00時間の配達旅行は808kg/m3の密度がある液体窒素の200のLを要求する。 (a)液体窒素のこの量を蒸発させ、3.00º Cに温度を上げるのに必要な熱伝達を計算して下さい。 (Cpを使用し、それが温度範囲にわたって一定であると仮定します。)この値は、液体窒素の供給を冷却する量である。 (b)キロワット時のこの熱伝達率は何ですか? (c)同一の質量の0℃の氷を融解することから得られる冷却量と、液体窒素を蒸発させることから得られる冷却量を比較する。
- いくつかの銃の愛好家は、鉛のナメクジを溶かして鋳造することを含む、独自の弾丸を作ります。 温度を上げて0.500kgの鉛を25.0℃から溶かすには、どのくらいの熱伝達が必要ですか?
用語集
昇華熱:固相から気相に物質を変更するために必要なエネルギー
潜熱係数:物質の相の変化中に物質のすべての1キロのために移: 固相から気相への移行
問題への選択された解決策&演習
1。 35.9kcal
3. (a)591kcal;(b)4.94×103s
5. 13.5W
7. (a)148kcal;(b)0.418s,3.34s,4.19s,22.6s,0.456s
9. 33.0g
10. (a)9.67L;(b)原油は水より密度が低いので、水の上に浮かび、それによって空気中の酸素に曝され、燃焼に使用されます。 また、水が油の下にある場合、油によって生成される熱を吸収する効率が低下する。
12. 319キロカロリー; (b)2.00º C
14. 20.6º C
16. 4.38kg
18. (a)1.57×104kcal;(b)18.3kW≤h;(c)1.29×104kcal
- 標準大気圧(1気圧)での通常の融解および沸騰温度で引用された値。 37.0℃(体温)では、水の気化熱Lvは2430kJ/kgまたは580kcal/kgです。
- 37.0℃(体温)では、水の気化熱Lvは2430kJ/kgまたは580kcal/kgです。