しかし、多くの分子のルイス図は、分子の観察された特性と一致していません。例1
例1
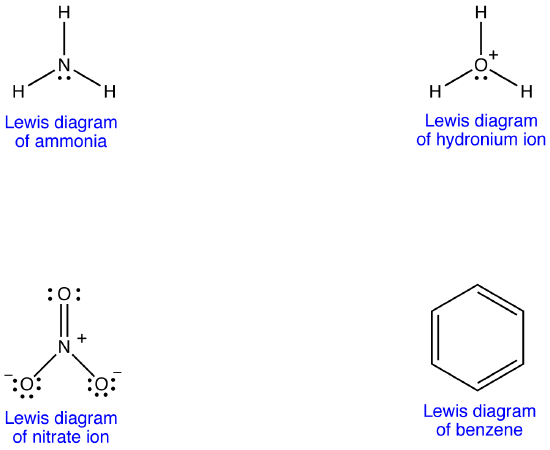
例2: 硝酸イオン
硝酸イオンは、そのルイス図によれば、窒素-酸素結合の二つのタイプ、一つの二重結合と二つの単結合を有し、硝酸イオン中の一つの窒素-酸素結合が他の二つのそれぞれよりも短く、強いことを示唆している。 また、ルイス構造は、形式電荷に関して、硝酸イオンには二つのタイプの酸素原子があり、一つは形式的に中性であり、他の二つのそれぞれは-1の形式的電荷を有することを意味する。 しかし,実験的には,硝酸イオン中の三つの窒素-酸素結合は同じ結合長と同じ結合エネルギーを持ち,三つの酸素原子は区別できない。 Lewis図は硝酸イオンの構造と結合を十分に説明できなかった。
硝酸イオンに対して二つの追加のルイス図を描くことができる。
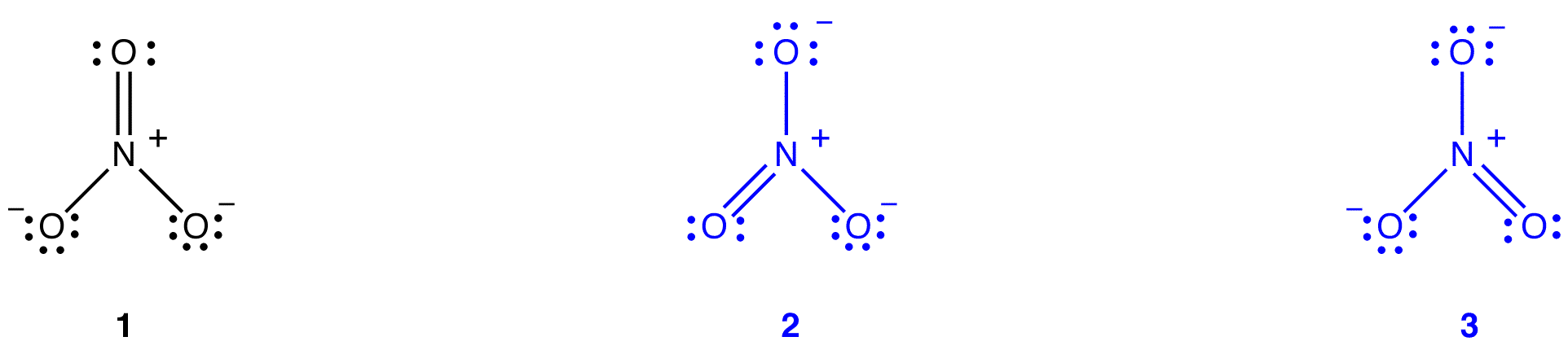
しかし、それらのどれも硝酸イオンの観察された特性と一致していないため、硝酸イオンを正しく描写していません。
例2: ベンゼン
ベンゼンは、そのルイス図によれば、二つのタイプの炭素-炭素結合、三つの二重結合と三つの単結合を有し、ベンゼン中の三つの炭素-炭素結合のそれぞれが他の三つのそれぞれよりも短く、強いことを示唆している。 しかし、実験的には、ベンゼン中の6つの炭素-炭素結合は、同じ結合長と同じ結合エネルギーを有する。 Lewis図はベンゼンの構造と結合を十分に説明できなかった。
古典的なルイス図が観測された特性と一致しない分子の属性は、それらのために他の有効なルイス図を生成できるということです。 ベンゼンに対してルイス図を追加で描くことができる。

しかし、それらのどれもベンゼンの観察された特性と一致していないため、ベンゼンを正しく描写していません。
共鳴理論は、硝酸イオンやベンゼンのような種の構造を説明しようとする試みであり、ルイス図は種の観察された特性と一致していません。 共鳴理論の主な利点は、厳密な数学的分析に基づいているが、共鳴理論はほとんど、あるいはまったく数学を呼び出すことに成功して適用することができ、ということです。 硝酸イオンを例にして共鳴理論を以下に説明する。
共鳴理論によれば、硝酸イオンの構造は1でも2でも3でもなく、安定性によって重み付けされた3つすべての平均です。 ルイス図1、2、および3は、硝酸イオンの共鳴形態、共鳴構造、または共鳴寄与者と呼ばれる。 硝酸イオンの構造は、共鳴ハイブリッドまたは、単に、共鳴形態1、2、および3のハイブリッドであると言われている。 硝酸イオンの構造を示す必要があるときはいつでも、共鳴形態1、2、および3が描かれ、双頭の矢印で接続されています。
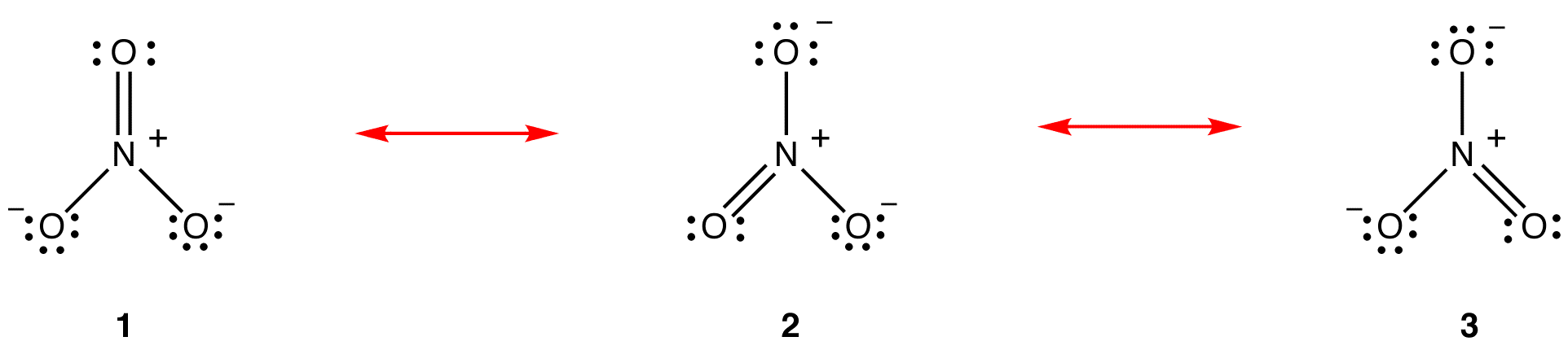
硝酸イオンの三つの共鳴形態、1、2、および3は同一であるため、それらは同じ安定性を有し、したがって、ハイブリッ 硝酸イオンの各共鳴形態がハイブリッドに寄与する正確な程度が知られているので、各窒素-酸素結合の結合順序とハイブリッド中の各酸素原子:
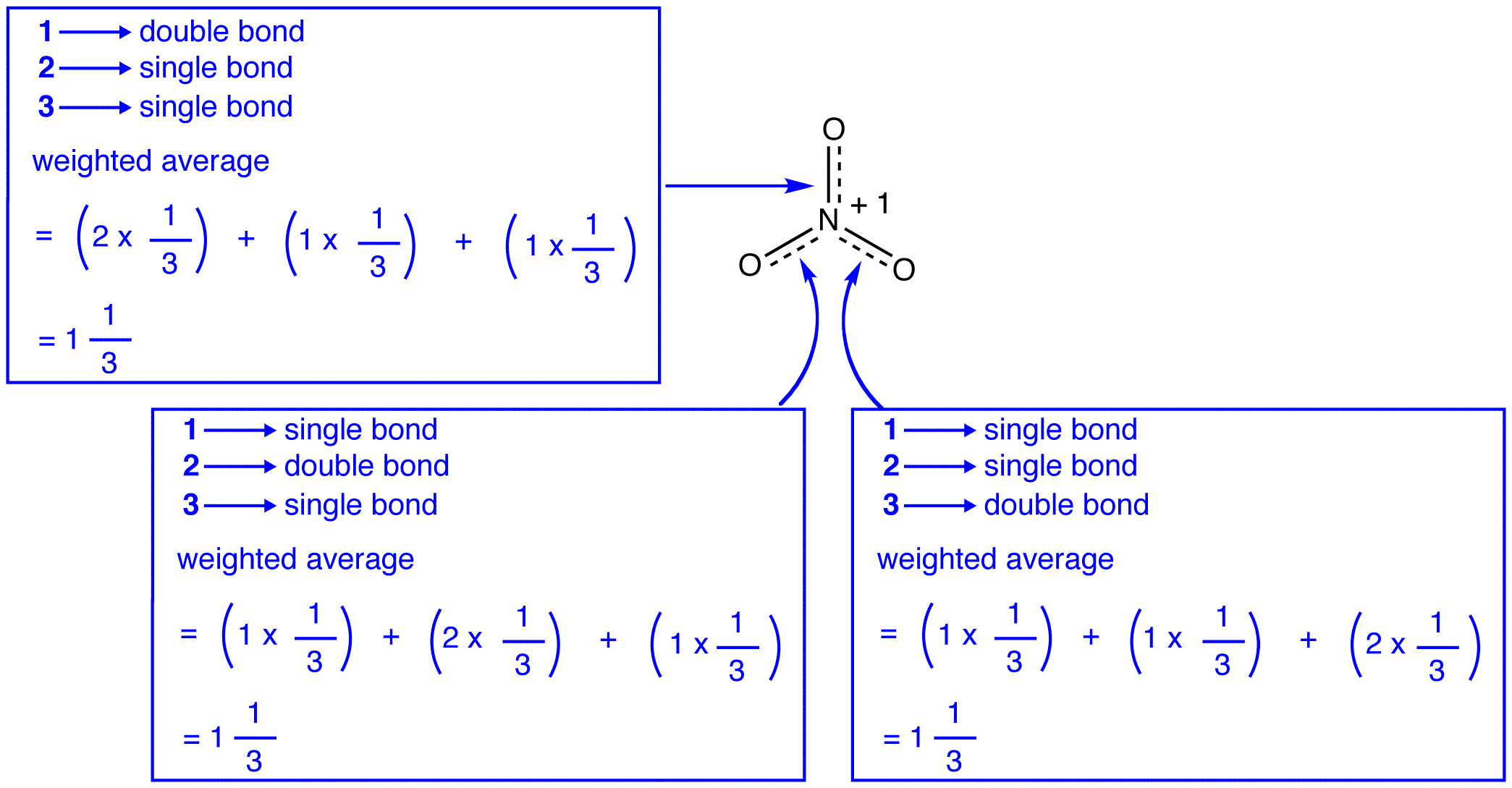
共鳴理論によると、硝酸イオンの各結合は結合の三分の一であり、これは硝酸イオンの三つの結合が同じ結合長と同じ結合エネル
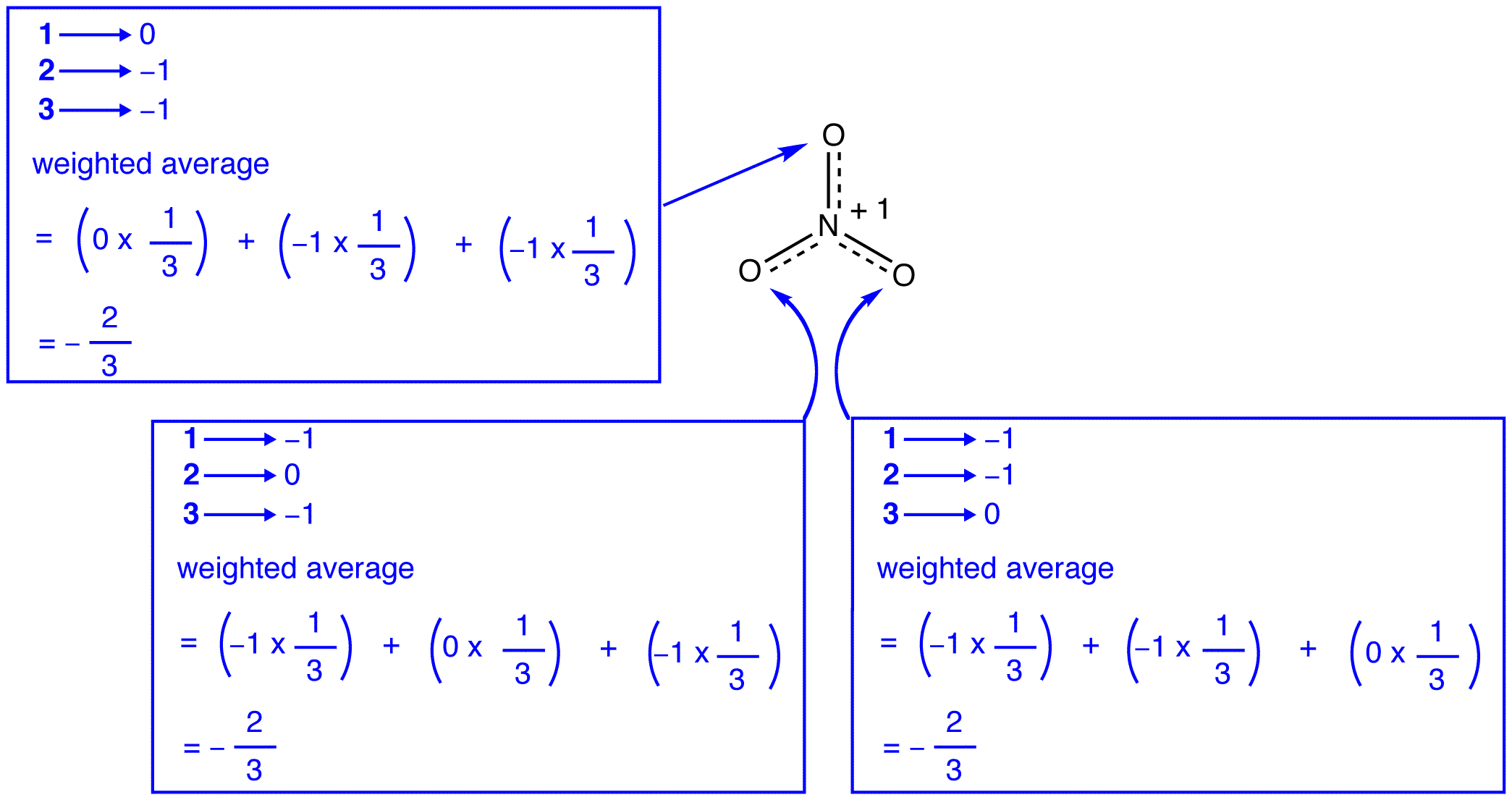
共鳴理論によると、硝酸イオンの各酸素原子は-2/3の正式な電荷を持ち、三つの窒素-酸素結合が同一であるという事実と関連して、硝酸イオンの三つの酸素原子は区別できないという観察と一致している。硝酸イオンの各共鳴形態では、2つのπ電子があり、それらは2つの原子によってのみ共有されます。
二つの原子によってのみ共有される電子は局在化していると言われています。 したがって、硝酸イオンの各共鳴形態の二つのπ電子は局在化する。 硝酸イオンは、ハイブリッドで表されるように、二つのπ電子を持っています:
#一つのπ結合の電子=2
#pi結合の三分の一の電子=2/3
#それらの三つの電子=3x(2/3)=2
硝酸イオン中の二つのπ電子は、四つの原子、一つの窒素原子と三つの酸素原子の合計によって共有されています。 二つ以上の原子によって共有される電子は非局在化されていると言われています。 したがって、硝酸イオン中の二つのπ電子は非局在化される。 硝酸イオン中のπ電子の非局在化は、四つの原子が同じ平面上にあることを必要とし、それらの上のp軌道の横方向の重複を可能にする。

硝酸イオンのエネルギーは、硝酸イオンの構造は、その三つの共鳴形態の構造の加重平均であるのと同様に、その三つの共鳴形態のエネルギーの加重平均であった場合、それは三つの同一の共鳴形態のいずれかのエネルギーに等しくなければならない。:

ハイブリッドのエネルギーが共鳴形式のエネルギーと等しい場合、すべての化学物質(素粒子、原子、分子など)が共鳴形式のエネルギー)当然のことながら、可能な限り低いエネルギー状態にある傾向があり、硝酸塩イオンがハイブリッドとして存在する利点はなく、単に共鳴形態として存在する可能性がある。 硝酸イオンは共鳴形態としてではなくハイブリッドとして存在するので、ハイブリッドのエネルギーは共鳴形態のいずれよりも低いと推論することができる。共鳴理論によれば、分子のエネルギーは最も低いエネルギー共鳴形態のエネルギーよりも低い。

硝酸イオンはエネルギーが低く、したがって、その共鳴形態のいずれよりも安定であるため、硝酸イオンは共鳴安定化されていると言われている。
共鳴という言葉の文字通りの解釈のために、最初の学生の間で共鳴理論について二つの誤解があります。
共鳴という言葉の文字通りの解釈のために。
硝酸イオンを例として以下に説明する。
誤解1: 硝酸イオンはしばらく共鳴形態1として存在し、その後共鳴形態2または共鳴形態3のいずれかに変化し、相互変換または1に戻る。
硝酸イオンの構造は1でも2でも3でもなく、ハイブリッドであり、反応を受けない限り時間とともに変化しません。誤解2:硝酸イオンのサンプルでは、与えられた瞬間に、イオンの三分の一は共鳴形態1として存在し、別の三分の一は共鳴形態2として存在し、残りの三分の一は共鳴形態3として存在する。
硝酸イオンのサンプルでは、与えられた瞬間に、すべてのイオンは同じ構造を持ち、これはハイブリッドです。これら二つの誤解を明確にするために使用される古典的なアナロジーは、ラバである(Morrison,R.T.;Boyd,R.N.Organic Chemistry,fifth edition;Allyn and Bacon:Boston,1987,pg. 373). 生物学的には、ラバは馬とロバのハイブリッドです。 これは、ラバが一瞬馬に似ていて、ロバに似ていることを意味するものではありません。 ラバの外観は、馬の外観とロバの外観の組み合わせであり、時間とともに変化しません。 また、群れでは、いくつかのラバは馬に似ており、他のラバはロバに似ているということも意味しません。 群れでは、すべてのラバは馬とロバの組み合わせである同じ外観を持っています。 この類推の弱点は、馬とロバが存在するのに対し、共鳴形式は厳密に仮説的であるということです。 MorrisonとBoydで引用されているより良い類推は、サイです。 サイを見ると、龍とユニコーンのハイブリッド、存在しない二つの生き物としてそれを記述することができます。
共鳴フォームを描画するためのルール
1。 共鳴形式は、原子価結合理論に基づいているルイス図である。したがって、それらは価電子結合理論の基本的な規則に従わなければならない。 したがって、水素は2つ以上の価電子を持つことができず、周期-2つの元素は8つ以上の価電子を持つことができず、周期3以下の元素は8つ以上の価電子を持つことができる。 例:硝酸イオンの各共鳴形態には、周期2つの元素である窒素と酸素の2つの元素があります。 硝酸イオンの共鳴形態のいずれにおいても、原子のいずれかに八つ以上の価電子が存在しない。
2. すべての共鳴形態は、π電子と非結合価電子の位置のみが異なる、同じシグマ結合骨格を持たなければならない。 例:硝酸イオンの3つの共鳴形態はすべて同じシグマ結合骨格を持っています:
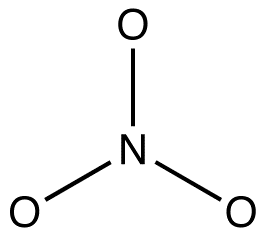
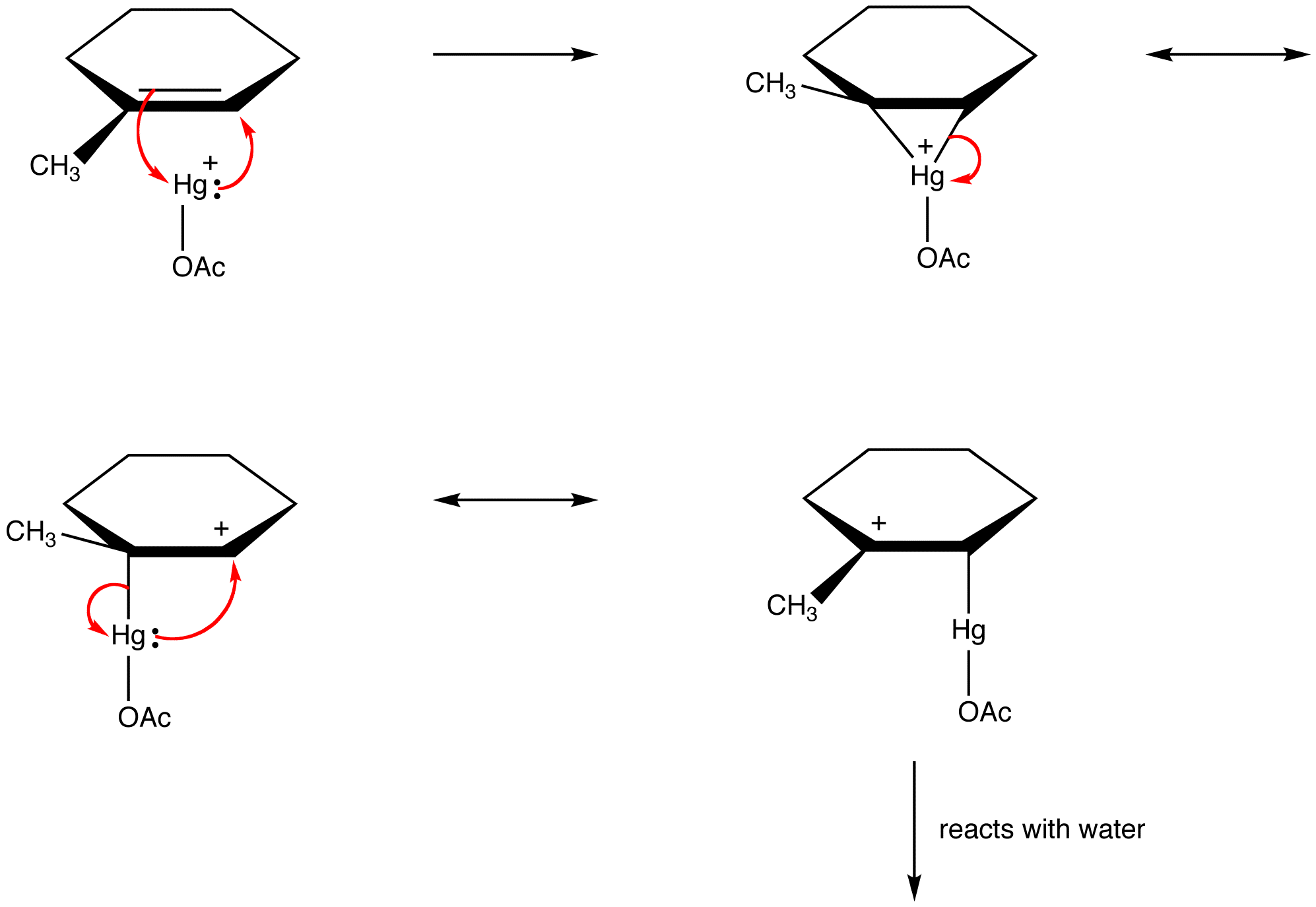
それらはpi電子と孤立有機化学者は、反応性中間体の構造を共鳴安定化種として説明するために、この規則にますます違反しています。
有機化学者は、反応性中間体の構造 例:オキシマーキュレーション
ハイブリッドへの共鳴形態の相対的な寄与の決定
硝酸イオンの三つの形態は同一であり、したがって、同じ安定性を有する。 その結果、それらは雑種に均等に貢献する。 ほとんどの共鳴安定化分子の共鳴形態は互いに異なっているので、それらはハイブリッドに等しく寄与しない。 より安定した共鳴形態、より多くのそれはハイブリッドに貢献しています。 したがって、ハイブリッドに対する相対的な寄与または共鳴形態の決定は、それらの相対的安定性の決定を必要とする。 共鳴形式の相対的な安定性を決定するには、次の規則を使用します。 ルール1:すべての原子が価電子のオクテットを有する共鳴形態は、少なくとも1つの原子が持たないものよりも安定である。
eg:
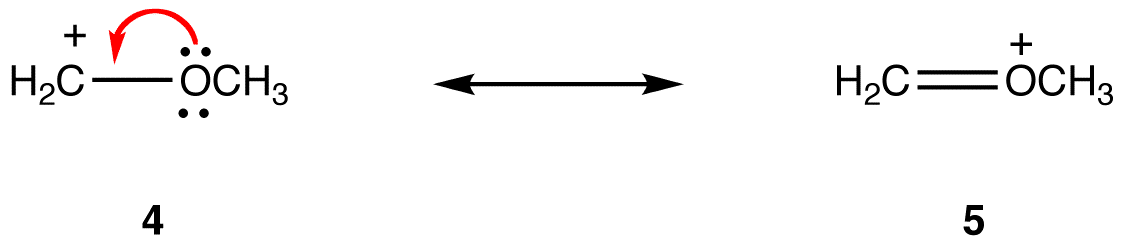
共鳴形式5では、すべての原子は価電子のオクテットを持ち、4では、一つの原子、+1の正式な電荷を持つ炭素原子は、そうではありません。 したがって、共鳴形態5は、共鳴形態4よりも安定である。ルール2:他のすべてが等しい、より電気陰性原子に正式な負電荷を持つ共鳴形式は、より電気陰性原子に正式な負電荷を持つものよりも安定です。 eg:
共鳴形式6では、正式な負電荷は酸素原子上にあり、7では炭素原子上にあります。 酸素は炭素よりも電気陰性である。 したがって、共鳴形態6は、共鳴形態7よりも安定である。
この傾向は正式な正の電荷に関しては反対です。
この傾向は正の電荷に関しては反対です。 他のすべてが等しい、より少ない電気陰性原子上の正式な正の電荷を有する共鳴形式は、より電気陰性原子上の正式な正の電荷を有するものよりも安定である。 eg:
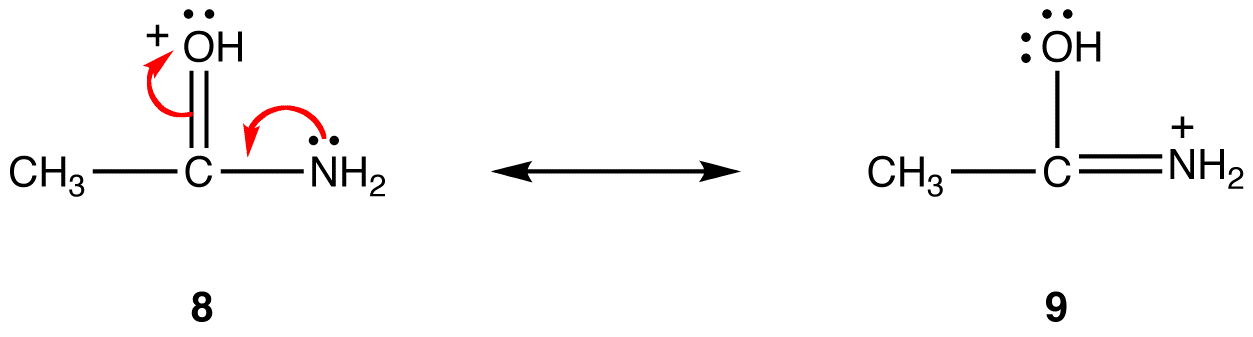
共鳴形式8では、正式な正の電荷は酸素原子上にあり、9では窒素原子上にあります。 窒素は酸素よりも電気陰性度が低いため、共鳴形態9は共鳴形態8よりも安定である。ルール3:他のすべてが等しい、双極子共鳴形式と呼ばれる電荷分離を持たない共鳴形式は、そうであるものよりも安定である。
ルール3:
他のすべてが等しい、双極子共鳴形式と呼ばれる電荷分離を持たない共鳴形式は、そうであるものよりも安定である。 例えば:
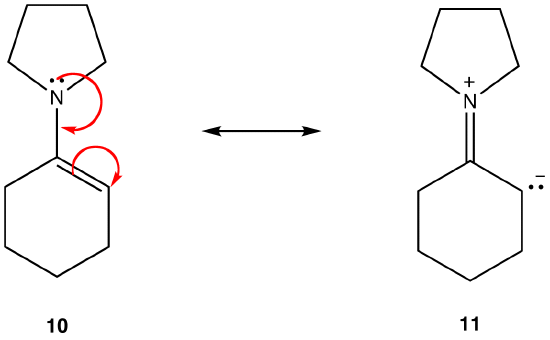
共鳴形式11は双極子共鳴形式であり、10はそうではありません。 したがって、10は11よりも安定である。 この規則は、反対の電荷が引き付けるColoumbの法則のベクトル形式の結果である。 結果は、反対の電荷を分離しておくためには、エネルギーが必要であり、11は10よりも高いエネルギーを有するので、10は11よりも安定であることを意味す
ルール4:
双極子共鳴形態では、他のすべてが等しい、分離された電荷間の距離が大きいほど、共鳴形態がより安定する。 例えば:
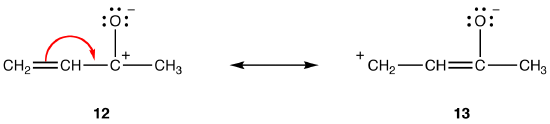
共鳴形式12と13の両方が双極子共鳴形式です。 分離された電荷間の距離は、13(3つの結合)では12(1つの結合)よりも大きいので、13は12よりも安定である。 この規則は、反対の電荷間の引力がそれらの間の距離の二乗に反比例することを示すColoumbの法則のスカラー形式の結果である。 したがって、12で分離された反対の電荷を維持するために必要なエネルギーは13のそれよりも高く、12は13よりも高いエネルギーを有するので、13は12よりも安定であることを意味する。
上記の規則は、価電子殻に八つ以上の電子を収容する能力のために、周期三以下の要素を含む共鳴には適用されない場合があります。 例:
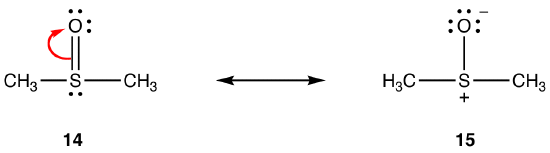
14の二重結合は、シグマ結合と、酸素原子に二つの電子を持つ2p軌道と硫黄原子に空の3d軌道の重複によって形成された結合 これら二つの軌道は非常に異なるエネルギー、大きさ、形状を持っているので、pn–dn相互作用として知られているそれらの間の重なりは弱いです。 その結果、ハイブリッド中の硫黄-酸素結合には二重結合の性質がほとんどなく、すなわち15が主要な共鳴形態である。
投稿者と属性
- OChemPalサイト(ユタバレー大学)からのGamini Gunawardena(ユタバレー大学)
投稿者と属性