一般名:フルオシノニド剤形:軟膏
医学的にレビュー Drugs.com最終更新日は2020年12月22日です。
- 概要
- 副作用
- 投与量
- プロフェッショナル
- 相互作用
- More
Rx Only
Lidexブランド名は、米国で廃止されました。
Lidex説明
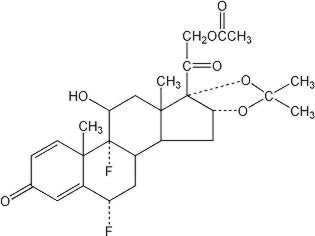
Lidex®(フルオシノニド)軟膏0.05%は、局所投与を意図しています。 活性成分は、フルオシノロンアセトニドの21-アセテートエステルであり、化学名pregna-1,4-ジエン-3,20-ジオン、21-(アセチルオキシ)-6,9-ジフルオロ-11-ヒドロキシ-16,17-、(6α、11β、16α)-を有するコルチコステロイドフルオシノニドである。 それは次の化学構造を持っています:
リデックス軟膏はフルオシノニド0を含んでいます。グリセリルのmonostearate、白いワセリン、プロピレンの炭酸塩、プロピレングリコールおよび白いワックスから成っている特に作り出された軟膏の基盤の5mg/g。 それは軟膏で望ましいocclusiveおよびemollient効果を提供します。この製剤では、活性成分は完全に溶液中にある。
Lidex-臨床薬理学
局所コルチコステロイドは、抗炎症、抗掻痒および血管収縮作用を共有する。
局所コルチコステロイドの抗炎症活性のメカニズムは不明である。 血管収縮アッセイを含む様々な実験室法は、局所コルチコステロイドの効力および/または臨床的有効性を比較し、予測するために使用される。 血管収縮剤の効力とヒトにおける治療効果との間に認識可能な相関関係が存在することを示唆するいくつかの証拠がある。
薬物動態
局所コルチコステロイドの経皮吸収の程度は、ビヒクル、表皮バリアの完全性、および閉塞性包帯の使用を含む多くの要因によっ
局所コルチコステロイドは、正常な無傷の皮膚から吸収することができます。 皮膚における炎症および/または他の疾患プロセスは、経皮吸収を増加させる。 閉塞性包帯は、局所コルチコステロイドの経皮吸収を実質的に増加させる。 したがって、閉塞性包帯は、耐性皮膚病の治療のための貴重な治療補助剤であり得る(投与量および投与を参照)。
皮膚を通して吸収されると、局所コルチコステロイドは、全身投与されたコルチコステロイドと同様の薬物動態学的経路を介して処理される。 副腎皮質ホルモンはさまざまな程度の血しょう蛋白質に区切られます。 副腎皮質ホルモンはレバーで主に新陳代謝し、次に腎臓によって排泄されます。 項目副腎皮質ホルモンおよび代謝物質のいくつかはまた胆汁に排泄されます。
Lidexの適応症および使用法
lidex軟膏は、コルチコステロイド応答性皮膚病の炎症性および掻痒性症状の軽減のために示される。
禁忌
局所コルチコステロイドは、製剤のいずれかの成分に対する過敏症の病歴を有する患者には禁忌である。
注意事項
一般
局所コルチコステロイドの全身吸収は、可逆的な視床下部-下垂体-副腎(HPA)軸抑制、クッシング症候群、高血糖、および一部の患者
全身の吸収を増加させる条件はより有効なステロイドの適用、大きい表面積上の使用、延長された使用およびocclusiveドレッシングの付加を含んでいます。
したがって、大きな表面積または閉塞性ドレッシング下に適用される強力な局所ステロイドの大量投与を受けている患者は、尿中遊離コルチ HPAの軸線の抑制が注意されれば薬剤を撤回するか、適用の頻度を減らすか、またはより少なく有効なステロイドを代わりにするように、試みはなさ
HPA軸機能の回復は、一般に、薬物の中止時に迅速かつ完全である。 まれに、ステロイドの回収の印そして徴候は補足の全身の副腎皮質ホルモンを要求する発生するかもしれません。
子供は項目副腎皮質ホルモンの比例して多量を吸収し、こうして全身の毒性により敏感であるかもしれません(注意–小児科の使用を見て下さい)。 刺激が発症した場合は、局所コルチコステロイドを中止し、適切な治療を行うべきである。
任意の局所コルチコステロイド製品と同様に、長期間の使用は、皮膚および皮下組織の萎縮を引き起こす可能性がある。 Intertriginousまたは屈筋区域で、または表面で使用されたとき、これは短期使用と起こるかもしれません。
皮膚科感染症の存在下では、適切な抗真菌剤または抗菌剤の使用を開始する必要があります。 好ましい応答がすみやかに起こらなければ、副腎皮質ホルモンは伝染が十分に制御されたまで中断されるべきです。
患者のための情報
局所コルチコステロイドを使用している患者は、以下の情報および指示を受けるべきである:
- この薬は、医師の指示 それは外的な使用だけのためです。 目との接触を避ける。
- 患者は、それが処方されたもの以外の障害にこの薬を使用しないように助言されるべきである。
- 治療された皮膚領域は、医師の指示がない限り、包帯またはその他の方法で覆われたり、閉塞性であるように包まれるべきではありません。
- 患者は、特に閉塞性ドレッシングの下で、局所的な副作用の兆候を報告する必要があります。
- 小児患者の両親は、これらの衣服が閉塞性包帯を構成する可能性があるため、おむつ領域で治療されている子供にぴったりのおむつやプラスチック
実験室試験
以下の試験は、HPA軸抑制を評価するのに役立つ可能性があります:
尿中遊離コルチゾール試験
ACTH刺激試験
発癌、変異誘発、および不妊治療の障害
局所コルチコステロイドの発癌性の可能性または不妊治療への影響を評価するための長期動物研究は行われていない。
プレドニゾロンおよびヒドロコルチゾンによる変異原性を決定するための研究は、否定的な結果を明らかにした。
妊娠カテゴリー C
コルチコステロイドは、比較的低い用量レベルで全身投与された場合、実験動物において一般的に催奇形性である。 より有効な副腎皮質ホルモンは実験動物の皮膚適用の後で催奇形性であるために示されていました。 局所的に適用されたコルチコステロイドからの催奇形性の効果の妊婦に十分な、よく制御された調査がありません。 したがって、局所コルチコステロイドは、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用されるべきである。 このクラスの薬剤は妊娠した患者で、多量で、または長い一定期間の間広く使用されるべきではないです。
授乳中の母親
コルチコステロイドの局所投与が母乳中で検出可能な量を生成するのに十分な全身吸収をもたらすことができるかどうか 全身的に管理された副腎皮質ホルモンは量の母乳に幼児に対する有害な効果をもたらすために本当らしくない分泌します。 それにもかかわらず、注意は項目副腎皮質ホルモンが看護の女性に管理されるとき運動されるべきです。
小児使用
小児患者は、皮膚表面積対体重比が大きいため、成熟した患者よりもコルチコステロイド誘発性視床-下垂体-副腎(HPA)軸抑制およびクッシング症候群に対する感受性が高いことを示す可能性がある。
hpa軸抑制、クッシング症候群、および頭蓋内圧亢進症は、局所コルチコステロイドを受けている小児で報告されている。 小児における副腎抑制の症状には、線形成長遅延、体重増加の遅延、血漿コルチゾールレベルの低下、およびACTH刺激に対する応答の欠如が含まれる。 頭蓋内圧亢進症の症状には、膨隆した泉門、頭痛、および両側乳頭浮腫が含まれる。
小児への局所コルチコステロイドの投与は、効果的な治療レジメンと互換性のある最小量に限定されるべきである。 慢性コルチコステロイド療法は、子供の成長と発達を妨げる可能性があります。
有害反応
以下の局所有害反応は、局所コルチコステロイドではまれに報告されるが、閉塞性包帯の使用でより頻繁に発生する可能性がある。 これらの反応は、発生のおおよその減少順に記載されています:
| Burning | Perioral dermatitis |
| Itching | Allergic contact dermatitis |
| Irritation | Maceration of the skin |
| Dryness | Secondary infection |
| Folliculitis | Skin atrophy |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Overdosage
Topically applied corticosteroids can be absorbed in sufficient amounts to produce systemic effects (see PRECAUTIONS).
Lidexの適量および管理
Lidexの軟膏は条件の重大度によって1日2から4回からの薄膜として影響を受けた区域に一般に適用されます。
閉塞性包帯は、乾癬または難治性の状態の管理に使用することができる。
感染が発症した場合は、閉塞性包帯の使用を中止し、適切な抗菌療法を開始する必要があります。
Lidexはどのように供給されていますか
Lidex®(フルオシノニド)軟膏0.05%はで供給されます
15g管–NDC99207–514–13
30g管–NDC99207-514-14
60g管-NDC99207-514-17
120g管-ndc99207-514-22
室温で保管してください。 30°C(86°F)上の温度を避けて下さい。
米国特許第4,017,615号
MEDICIS,The Dermatology Company®
Scottsdale,AZ85258
by:Patheon,Inc.
Mississauga, Ontario
Canada L5N 7K9
IN-5070/S
| Lidex fluocinonide ointment |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – MEDICIS
Frequently asked questions
- Is it used for hair loss?
- What is a substitute for fluocinonide cream?
- Is fluocinonide an antifungal cream?
- How long should you use fluocinonide for?
- What is fluocinonide cream good for?
- fluocinonideがツタウルシの発疹を扱うのに使用することができますか。それはステロイドですか?
- これは抗生物質ですか?
Lidex(フルオシノニド局所)についての詳細
- 副作用
- 妊娠中または母乳育児中
- 投与量情報
- 薬物相互作用
- 8レビュー
- ジェネリックの可用性
- 薬物クラス: 項目ステロイド
消費者資源
- 高度な読書
- Lidexマイルド(高度な読書)
- Lidexレギュラー(高度な読書)
プロフェッショナルリソース
- 処方情報
- Lidex局所溶液(FDA)
- Lidexゲル(FDA)
その他のブランド