イオン結合とは何ですか?結合した原子の総エネルギーが別々の原子の総エネルギーよりも低いとき、化学結合が形成される。
結合した原子の総エネルギーが別々の原子の総エ結合がとる形態は、エネルギーを最小化する電子配置によって決定される。いくつかの例では、電子は原子間で共有されています-これは共有結合と呼ばれます。
電子は共有結合と呼ばれます。
他の例では、ある原子から別の原子への1つまたは複数の電子の完全な移動がある。
他の例では、ある原子から別の原子への1つまたは複数の電子電子を失う原子は正に帯電したイオンになる。電子を受け取る原子は負に荷電したイオンになります。
これはイオン結合につながります-正と負の相互静電引力charges.In その最も純粋な形態、イオンの結合は方向ではないです。 これは点電荷間の単純なクーロン引力とみなすことができる。これは、電子の共有が方向結合をもたらす共有結合とは異なる。
電子移動
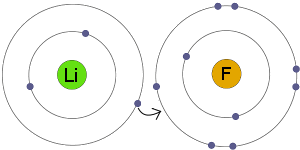
LiはFに電子を転送します。電子殻。
静電吸引
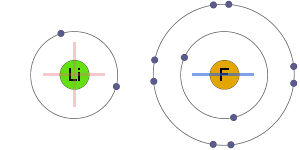
正と負のイオンは静電的に別のものは、イオン結合をもたらす。
クーロン力は好ましい方向を持たず、イオン化合物はイオンが詰まった巨大な結晶格子構造として存在する傾向がある。
フッ化リチウムの結晶格子のサンプル

電気陰性度とイオン結合
二つの元素は、電気陰性度が大きく異なるとイオン結合する傾向がある。
電気陰性度の周期表
緑の色合いが軽いほど、電気陰性度が高くなります。 グレーは、値が知られていないことを意味します。 (画像をクリックすると拡大表示されます。)

共有結合特性
正に帯電したイオンが負イオンの電子雲を分極するため、絶対に純粋なイオン結合化合物は本当に存在しない。偏光効果は、すべてのイオン性化合物にある程度存在するが、これは、Al3+のような小さく、高度に荷電した金属イオンを扱うときに特に顕著である。分極は効果的に方向性のある電子共有効果であるため、イオン性化合物に少量の共有性が導入されます。結合中のイオン/共有結合挙動の割合は、電気陰性度のポーリングスケールを使用して非常に大まかに評価することができます。
結合中のイオン/共有結合挙動の割合は、電気陰性度のポーリングスケールを使用して評価することができます。ライナス-ポーリングは、元素間の電気陰性度の差が1.7であると推定し、50パーセントのイオン性である結合につながると推定した。
1以下の値は共有結合が支配的であり、2以上の値はイオン結合が支配的であることに対応します。
1以下の値は共有結合が支配的であ
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
0.35の差を持つC-H結合は共有結合になり、2.23でのNaCl結合はイオン性になります。0.96でのHCl結合は極性共有結合であり、1.68でのLiI結合は50/50イオン/共有結合である。最大の電気陰性度の差は3.19であり、セシウム(0.79)とフッ素(3.98)の間である。 得られた結合は、特性において約95パーセントのイオン性である。

