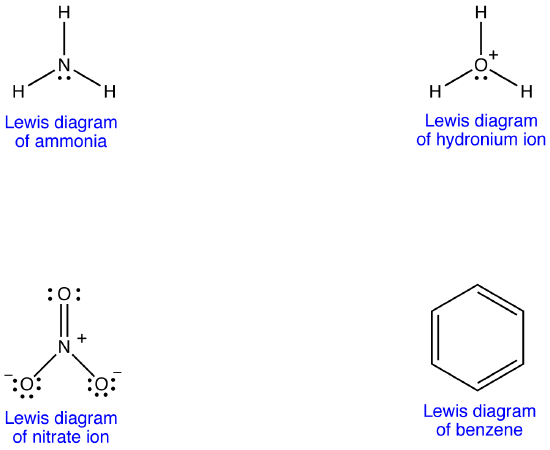
sok molekula Lewis diagramja azonban nem felel meg a molekula megfigyelt tulajdonságainak.
1. példa: Nitrátion
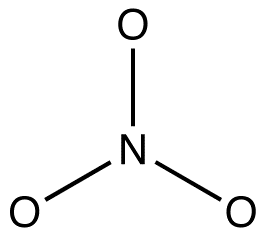
A nitrátion Lewis-diagramja szerint kétféle nitrogén-oxigén kötéssel rendelkezik, egy kettős kötéssel és két egyetlen kötéssel, ami arra utal, hogy a nitrátionban egy nitrogén-oxigén kötés rövidebb és erősebb, mint a másik kettő. A Lewis-szerkezet a formális töltés tekintetében azt is jelenti, hogy a nitrátionban kétféle oxigénatom van, az egyik formálisan semleges, a másik kettő pedig -1 formális töltéssel rendelkezik. Kísérletileg azonban a nitrátionban lévő három nitrogén-oxigén kötés azonos kötési hosszúságú és azonos kötési energiával rendelkezik, és a három oxigénatom megkülönböztethetetlen. A Lewis-diagram nem magyarázza meg kielégítően a nitrátion szerkezetét és kötését.
A nitrátionhoz két további Lewis-diagramot lehet rajzolni.
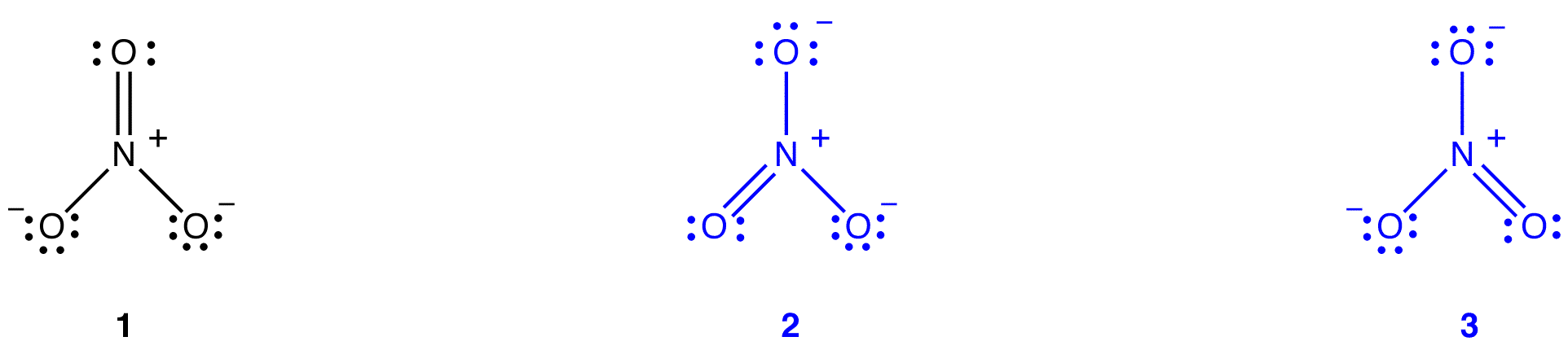
azonban egyikük sem felel meg a nitrátion megfigyelt tulajdonságainak, ezért nem megfelelően ábrázolja a nitrátionot.
2. példa: Benzol
Benzol szerint a Lewis diagram, két típusú szén-szén kötések, három kettős kötések három egységes kötvények, ami arra utal, hogy minden három szén-szén kötések a benzol rövidebb, de erősebb, mint a többi három. Kísérletileg azonban a benzolban lévő hat szén-szén kötés azonos kötési hosszúsággal és azonos kötési energiával rendelkezik. A Lewis-diagram nem magyarázza meg kielégítően a benzol szerkezetét és kötését.
azoknak a molekuláknak az attribútuma, amelyeknek a klasszikus Lewis-diagram nem felel meg a megfigyelt tulajdonságoknak, az, hogy más érvényes Lewis-diagramok is előállíthatók számukra. Egy további Lewis diagramot lehet levonni a benzolhoz.

azonban egyikük sem felel meg a benzol megfigyelt tulajdonságainak, ezért nem megfelelően ábrázolja a benzolt.
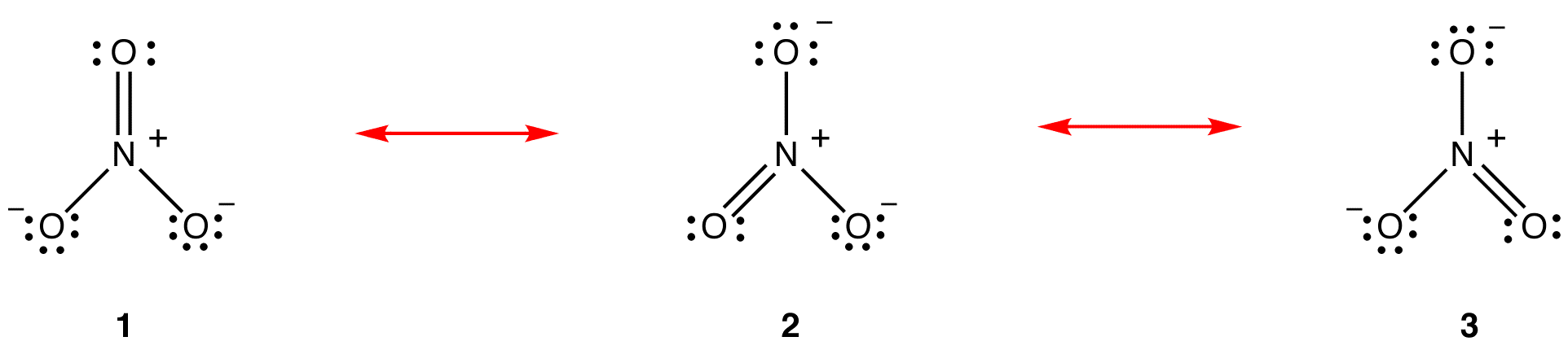
a rezonancia-elmélet egy faj, például a nitrátion vagy a benzol szerkezetének magyarázatára tett kísérlet, amelynek Lewis-diagramja nem felel meg a faj megfigyelt tulajdonságainak. A rezonancia elmélet fő előnye, hogy bár szigorú matematikai elemzésen alapul, a rezonancia elmélet sikeresen alkalmazható, kevés vagy egyáltalán nem matematikai hivatkozással. A rezonancia elméletet az alábbiakban ismertetjük a nitrátion példájaként.
a rezonancia elmélet szerint a nitrátion szerkezete nem 1, sem 2, sem 3, hanem mindhárom átlaga, stabilitással súlyozva. Az 1., 2. és 3. Lewis-diagramokat a nitrát-ion rezonancia formáinak, rezonancia struktúráinak vagy rezonancia-hozzájárulóinak nevezzük. A nitrátion szerkezete állítólag rezonancia hibrid, vagy egyszerűen az 1, 2 és 3 rezonancia-formák hibridje. Amikor a nitrátion szerkezetét meg kell mutatni, az 1, 2 és 3 rezonancia formákat rajzolják, kétfejű nyilakkal összekötve.
a nitrátion három rezonanciaformája (1, 2 és 3) azonos, tehát ugyanolyan stabilitással rendelkeznek, és ezért egyformán hozzájárulnak a hibridhez. Mivel ismert, hogy a nitrátion minden egyes rezonancia formája milyen mértékben járul hozzá a hibridhez, könnyen meghatározható az egyes nitrogén-oxigén kötések kötési sorrendje, valamint a hibrid minden oxigénatomjának formális töltése: 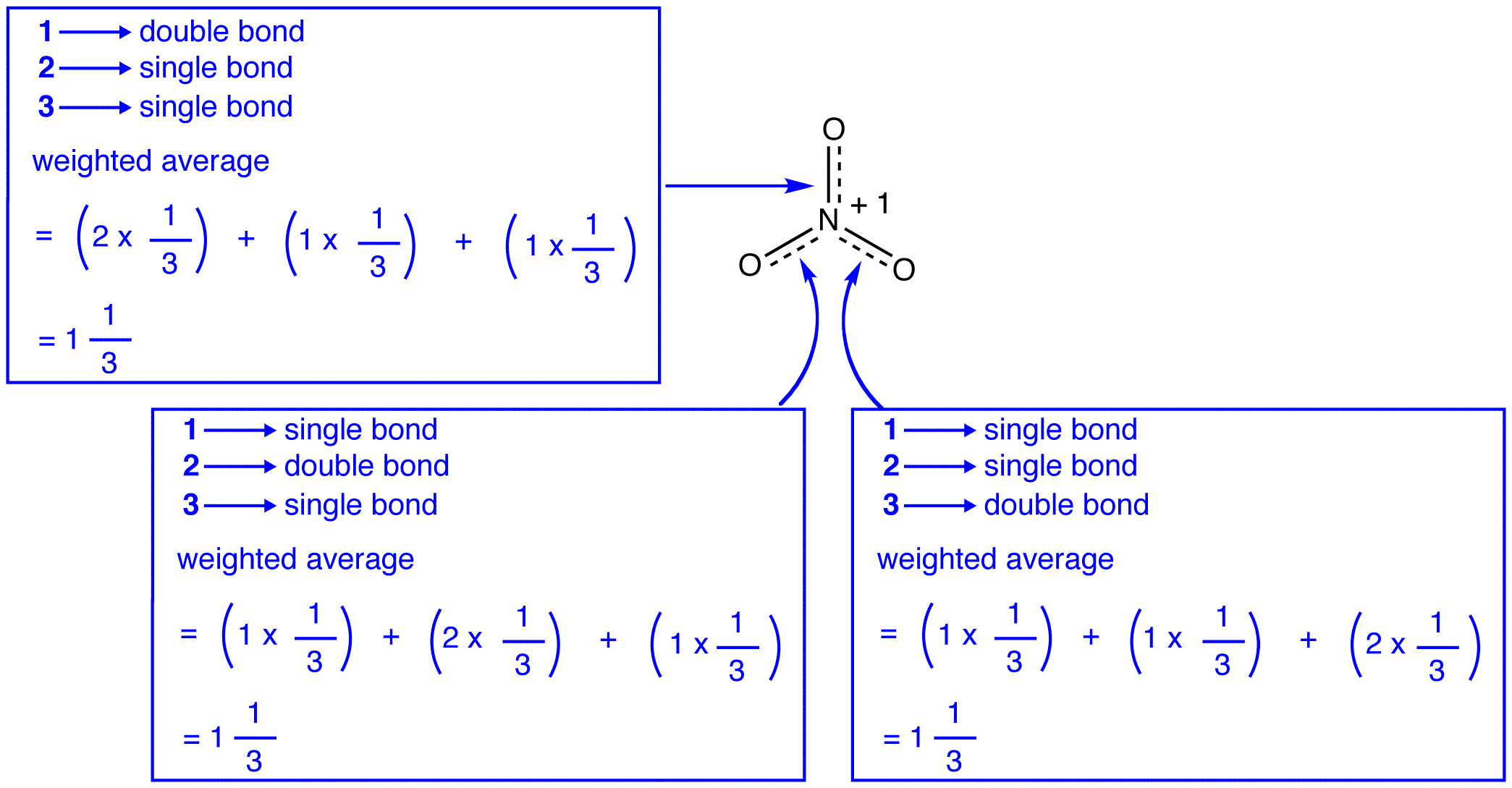
Szerint rezonancia elmélet, minden kötelék, a nitrát ion egy, majd egy harmadik, egy kötelék, ami összhangban van a megfigyelés, hogy a három kötvények a nitrát-ion ugyanaz a bond-hossz, valamint az azonos bond energia.
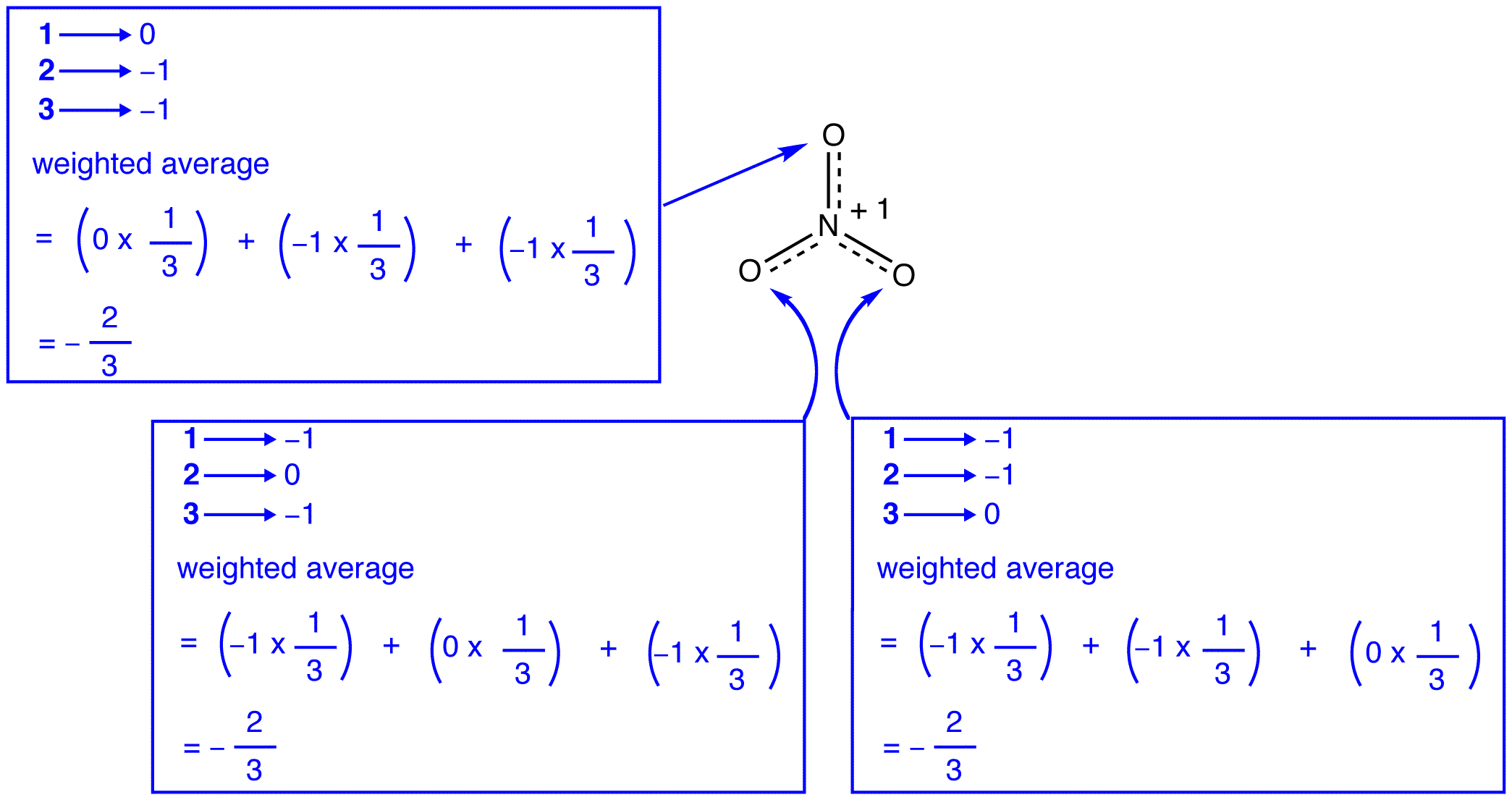
Szerint rezonancia elmélet, minden oxigén atom a nitrát ion hivatalos felelős -2/3, amely összefüggésben azzal a ténnyel, hogy a három nitrogén-oxigén kötvények azonos, megegyezik a megfigyelés, hogy a három oxigén atomok a nitrát-ion vagy megkülönböztethetetlen.
a nitrátion minden egyes rezonanciaformájában két pi elektron van, és csak két atom osztja meg őket. Azt mondják, hogy egy elektron, amelyet csak két atom oszt meg, lokalizálódik. Így a két pi elektron a nitrát-ion minden rezonancia formájában lokalizálódik. A nitrát-ion által képviselt hibrid, két pi elektronok:
# elektronok egy pi bond = 2
# elektronok egy külső pi bond = 2/3
# elektronok a hárman = 3 x (2/3) = 2
A két pi elektronok a nitrát-ion által megosztott összesen négy atomok, egy nitrogén atom három oxigén atomok. Azt mondják, hogy egy elektron, amelyet több mint két atom oszt meg, delokalizálódik. Így a nitrátionban lévő két pi elektron delokalizálódik. A PI elektronok delokalizációja a nitrátionban megköveteli, hogy a négy atom ugyanazon a síkon legyen, lehetővé téve a P pályák oldalirányú átfedését.

Ha a nitrátion energiája a három rezonanciaformájának energiáinak súlyozott átlaga volt, ugyanúgy, mint a nitrátion szerkezete a három rezonanciaforma szerkezetének súlyozott átlaga, akkor meg kell egyeznie a három azonos rezonanciaforma egyikének energiájával:

Ha a hibrid energiája megegyezik a rezonancia formájával, tekintettel arra, hogy minden kémiai entitás (elemi részecskék, atomok, molekulák stb.) természetesen általában a lehető legalacsonyabb energiaállapotban vannak, nem lenne előnye, hogy a nitrátion hibridként létezzen; egyszerűen rezonancia formában létezhet. Mivel a nitrátion hibridként létezik, nem rezonancia formaként, arra lehet következtetni, hogy a hibrid energiája alacsonyabb, mint bármelyik rezonancia formáé.

a rezonancia elmélet szerint a molekula energiája alacsonyabb, mint a legalacsonyabb energiájú rezonancia formáé. Mivel a nitrátion alacsonyabb energiával rendelkezik, ezért stabilabb, mint bármely rezonancia formája, a nitrátionról azt mondják, hogy rezonancia stabilizált.
két tévhit van a rezonancia elméletről a kezdő hallgatók körében, valószínűleg a rezonancia szó szó szerinti értelmezése miatt. Az alábbiakban ismertetjük őket, példaként a nitrátionot használva.
1.: A nitrátion egy pillanatra rezonancia formaként létezik 1, majd 2 rezonancia formává vagy 3 rezonancia formává változik, amely interkonvertálódik, vagy visszatér 1-re.

a nitrátion szerkezete nem 1, sem 2, sem 3, hanem a hibrid, és nem változik idővel, csak reakció közben.
2. tévhit: a nitrátionok mintájában egy adott pillanatban az ionok egyharmada rezonancia formában létezik 1, egy másik egyharmada rezonancia formában 2, a fennmaradó egyharmada pedig rezonancia formában 3.

nitrátionok mintájában egy adott pillanatban minden ionnak azonos szerkezete van, amely a hibrid.
a két tévhit tisztázására használt klasszikus analógia az öszvér (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biológiailag az öszvér egy ló és egy szamár hibridje. Ez nem jelenti azt, hogy egy öszvér egy pillanatra hasonlít egy lóra, majd megváltozik, hogy hasonlítson egy szamárra. Az öszvér megjelenése a ló és a szamár megjelenésének kombinációja,és az idővel nem változik. Az sem jelenti azt, hogy egy csordában néhány öszvér hasonlít egy lóra, a másik pedig egy szamárra. Egy csordában minden öszvérnek ugyanaz a megjelenése, ami egy ló és egy szamár kombinációja. Ennek az analógiának a gyengesége, hogy léteznek lovak és szamarak, míg a rezonancia formák szigorúan hipotetikusak. Egy jobb analógia, idézett Morrison és Boyd, az orrszarvú. Egy orrszarvú láttán úgy lehetne leírni, mint egy sárkány és egy egyszarvú hibridjét, két nem létező lényt.
A rezonancia formák rajzolásának szabályai
1. A rezonancia formák Lewis diagramok, amelyek valence bond elméleten alapulnak.Ezért be kell tartaniuk a valence bond elmélet alapvető szabályait. Így a hidrogénnek nem lehet több, mint két valence elektronja; periódus-két elem nem lehet több, mint nyolc valence elektron; a három és az alatti elemek több mint nyolc valence elektronokkal rendelkezhetnek. pl: minden rezonancia formájában a nitrát ion, van két elem, nitrogén, oxigén, amelyek időszak-két elem. A nitrátion egyik rezonanciaformájában sem több, mint nyolc valence elektron van az atomok bármelyikén.
2. Minden rezonancia formának azonos szigma-kötési kerettel kell rendelkeznie, amely csak a PI elektronok és a nem kötött valenciaelektronok helyén különbözik. pl: a nitrátion mindhárom rezonanciaformája azonos szigma-kötési kerettel rendelkezik:
csak a PI elektronok és a magányos Párok helyén különböznek egymástól.
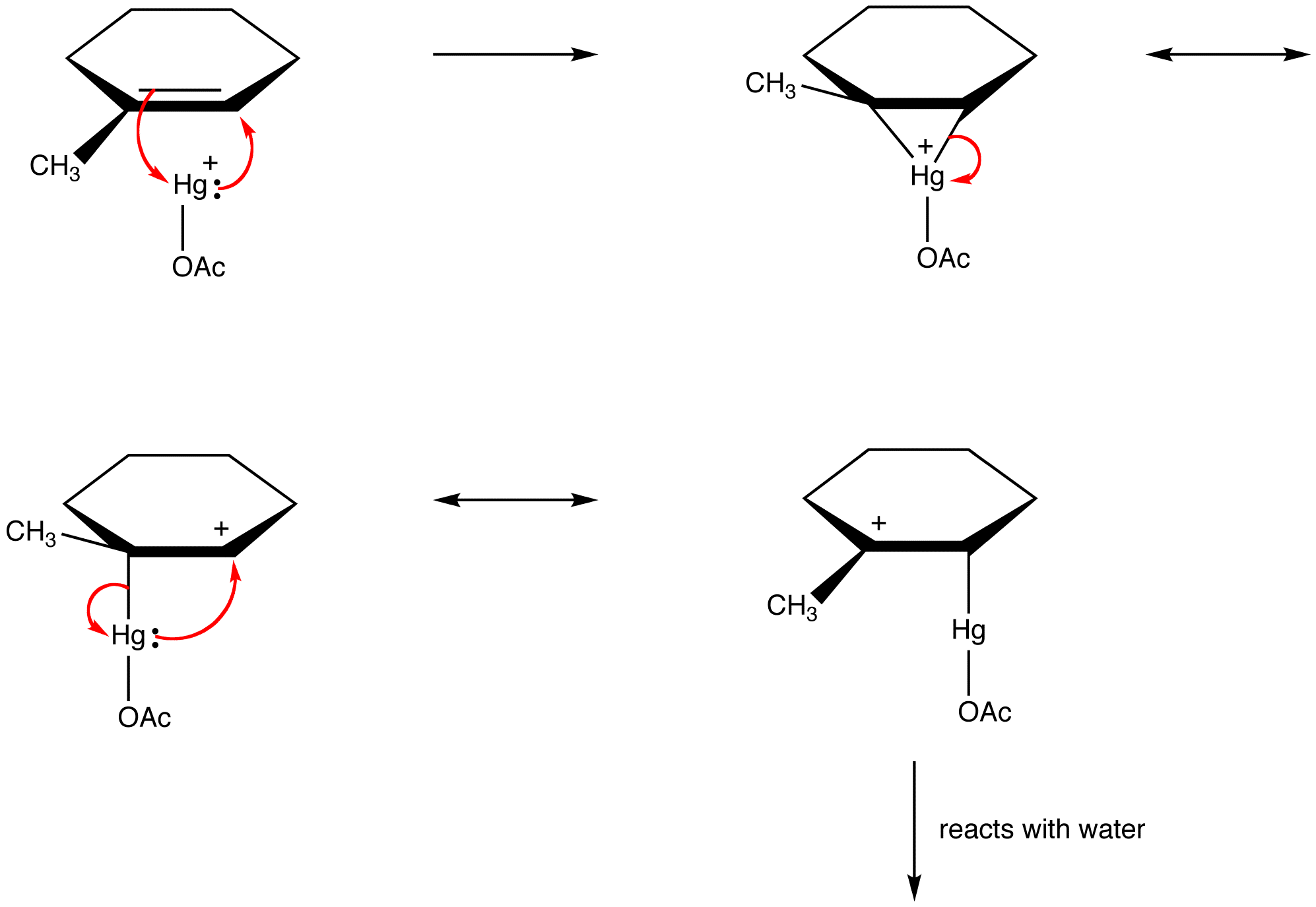
a szerves vegyészek egyre inkább megsértik ezt a szabályt annak érdekében, hogy megmagyarázzák a reaktív intermedierek mint rezonancia-stabilizált Fajok szerkezetét. eg: oxymercuration
A rezonancia formák relatív hozzájárulásának meghatározása a hibridhez
a nitrátion három formája azonos, ezért ugyanolyan stabilitással rendelkeznek. Következésképpen ugyanúgy hozzájárulnak a hibridhez. A legtöbb rezonancia-stabilizált molekula rezonancia formái különböznek egymástól, így nem járulnak hozzá egyformán a hibridhez. Minél stabilabb a rezonancia forma, annál inkább hozzájárul a hibridhez. Így a hibridhez való relatív hozzájárulás vagy rezonancia formák meghatározása megköveteli relatív stabilitásuk meghatározását. Használja a következő szabályokat a rezonancia formák relatív stabilitásának meghatározásához.
1. szabály:
a rezonancia forma, amelyben minden atomnak van egy oktettje valence elektronok stabilabb, mint az egyik, amelyben legalább egy atom nem. eg:
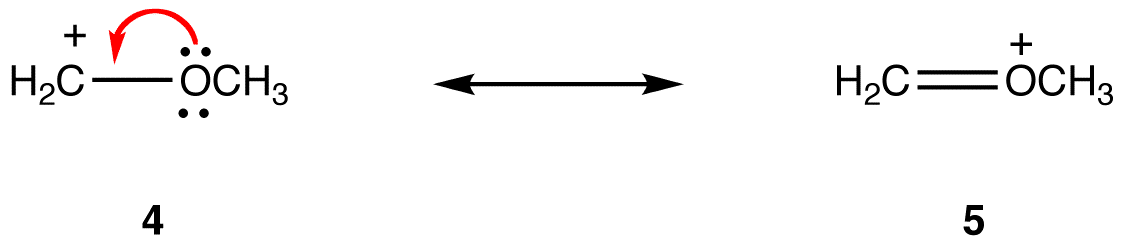
5 rezonancia formában minden atomnak van egy nyolcszögű elektronja; 4, egy atomban a +1 formális töltésű szénatom nem. Így az 5 rezonancia forma stabilabb, mint a 4 rezonancia forma.
2. szabály:
minden más egyenlő, egy rezonancia forma, amelynek formális negatív töltése van egy elektronegatív atomon, stabilabb, mint egy, amelynek formális negatív töltése van egy kevésbé elektronegatív atomon. eg:
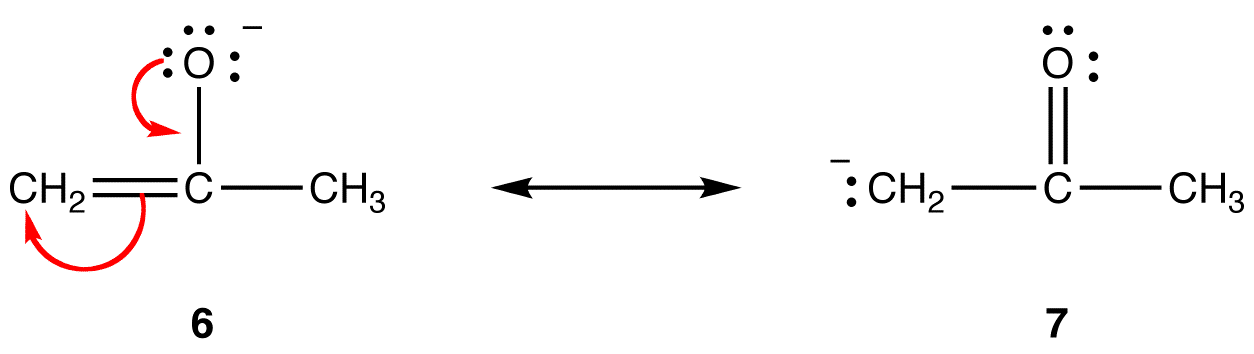
rezonancia formában 6, a formális negatív töltés oxigénatomon van; 7-ben szénatomon van. Az oxigén elektronegatívabb, mint a szén. Így a 6 rezonancia forma stabilabb, mint a 7 rezonancia forma.
a tendencia ellentétes a formális pozitív díjakkal. Minden más egyenlő, egy rezonancia forma, amelynek formális pozitív töltése van egy kevésbé elektronegatív atomon, stabilabb, mint az, amelynek formális pozitív töltése van egy elektronegatívabb atomon. eg:
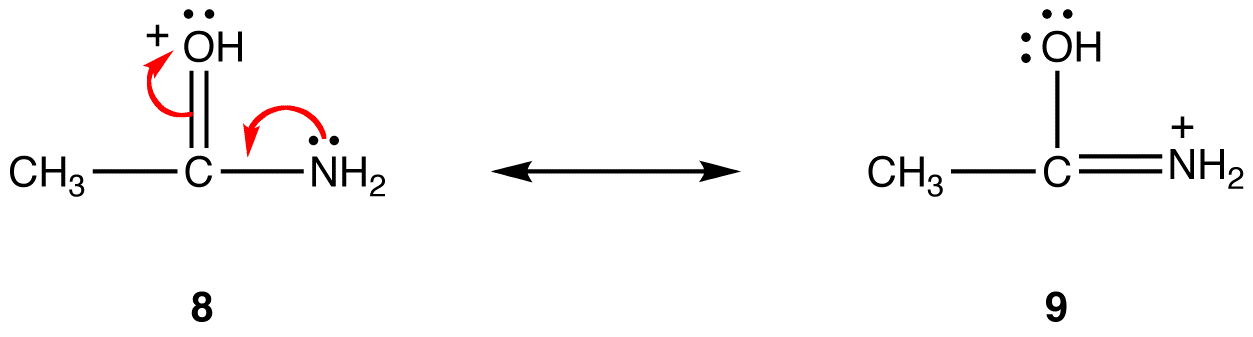
rezonancia formában 8, a formális pozitív töltés oxigénatomon van; 9-ben nitrogénatomon van. A nitrogén kevésbé elektronegatív, mint az oxigén, így a 9 rezonancia forma stabilabb, mint a 8 rezonancia forma.
3. szabály:
minden más egyenlő, egy rezonancia forma, amely nem rendelkezik töltéselválasztással, dipoláris rezonancia formának nevezik, stabilabb, mint az, amely. pl:
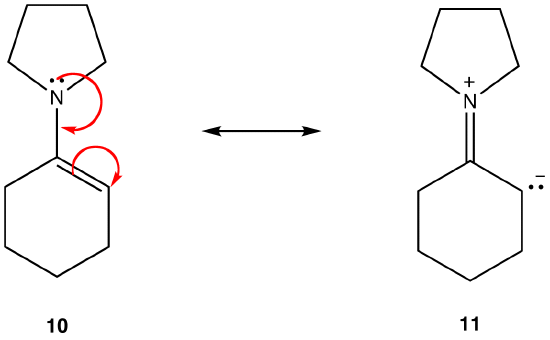
a 11 rezonancia forma dipoláris rezonancia forma; 10 nem. Így 10 stabilabb, mint 11. Ez a szabály a Koloumb törvényének vektorformájának következménye,amely szerint ellentétes díjak vonzódnak. A következmény az, hogy az ellentétes töltések elválasztásához energiára van szükség, ami azt jelenti, hogy a 11-nek nagyobb energiája van, mint a 10, tehát az 10 stabilabb, mint az 11.
4. szabály:
a dipoláris rezonancia formákban minden más egyenlő, minél nagyobb a távolság az elválasztott töltések között, annál stabilabb a rezonancia forma. pl:
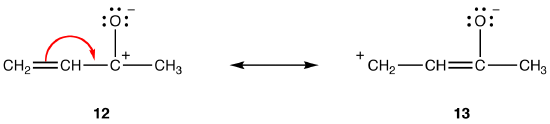
mindkét rezonancia forma 12 és 13 dipoláris rezonancia formák. Az elválasztott töltések közötti távolság nagyobb 13-ban (három kötésben), mint 12-ben (egy kötésben), így a 13 stabilabb, mint 12. Ez a szabály a coloumb törvényének skaláris formájának következménye, amely kimondja, hogy az ellentétes töltések közötti vonzó erő fordítottan arányos a köztük lévő távolság négyzetével. Így az ellenkező töltések 12-ben történő elválasztásához szükséges energia magasabb, mint a 13-ban, ami azt jelenti, hogy a 12-nek nagyobb energiája van, mint a 13-nak, tehát a 13 stabilabb, mint a 12.
A fenti szabályok nem alkalmazhatók rezonancia érintő elemei Időszak három alatt, mivel képesek befogadni több mint nyolc elektronok a valence shell. pl:
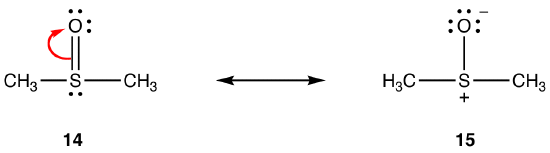
A kettős kötés 14 áll egy sigma bond kötelék alakult az átfedés a 2p orbitális, csapágy két elektront, az oxigén atom, meg egy üres 3d-s pálya a kén atom. Ez a két pálya nagyon különböző energiákkal, méretekkel és formákkal rendelkezik, így a köztük lévő átfedés, amelyet PN–dn kölcsönhatásnak neveznek, gyenge. Következésképpen a hibridben a kén-oxigén kötésben kevés kettős kötés van, azaz a 15 a fő rezonancia forma.
közreműködők és hozzárendelések
- Gamini Gunawardena az OChemPal telepről (Utah Valley Egyetem)