felülvizsgálati cikk
leukémia-a háziorvos számára
leukémia a háziorvos számára
Rafael Hurtado Monroya, Braulio Solano Estradab, Pablo Vargas Viverosc
a hematológiai osztály vezetője. Kórház Ángeles del Pedregal. Mexikó, DF. E-mail cím: [email protected]
B Belgyógyászat. Kórház Ángeles del Pedregal. Mexikó. DF.
C Belgyógyászat. Kórház Ángeles del Pedregal. Mexikó. DF.
beérkezett: 2011. október 17.
elfogadott: 07 január 2012
BEVEZETŐ
annak Ellenére, hogy a nagy molekuláris, illetve terápiás eredményeket a tanulmány a leukémia, az alapvető szempontok, ez a feltétel még nem egyértelműen ismert, a nem-hematológus, így a cél ennek a munkát biztosítani kell az alapvető információkat orvosi diákok, orvosok, általános, amely lehetővé teszi, mindenekelőtt megszerezni általános ismeretek a leukémia, az időben történő diagnózis, kérjen korai referencia a hematológus.

meghatározás
A leukémia a rosszindulatú vérbetegségek egy csoportjának meghatározására használt kifejezés. A korai diagnózis elengedhetetlen, mivel lehetővé teszi a beteg számára, hogy korán menjen a hematológiai szakemberhez, aki vezeti a diagnosztikai folyamatot, és felajánlja a speciális kezelést. Jellemzője, hogy a sejtek klonális, autonóm, abnormális proliferációja, amely a vér többi normál sejtjét eredményezi (általában a tumor viselkedése).
Ez azt jelenti, hogy egy korai sejt genetikai változáson megy keresztül, ami egy rendellenes klónt (kolóniát) okoz. Ez a rendellenes termelés rendezetlen, mert a kóros sejtek szaporodnak kép és hasonlóság magukat, így fokozatosan elfoglalják a tér a normális csontvelő, ami progresszív vérszegénység, rendellenes vérzés és hajlam a fertőzésekre. Másrészt, amikor a kóros sejtek behatolnak más szövetekbe, az érintett szerv működésének meghibásodása következik be, például az akut limfoblasztikus leukémiában (lal) előforduló infiltráció a központi idegrendszerbe fejfájás, rohamok, fókuszált motoros változások, megnövekedett koponyaűri nyomás, valamint a korai diagnózis elmulasztása és megfelelő kezelés biztosítása esetén a funkció elvesztése és visszafordíthatatlan következmények.
klinikai tünetek
a klinikai kép változatos, és a leukémia típusától függ: akut vagy krónikus, azonban a 2 – nél vannak nem specifikus klinikai megnyilvánulások (amelyek bármely betegségben előfordulnak):
1. Fáradtság.
2. Könnyű fáradtság.
3. Általános gyengeség.
4. Arra vágyik, hogy pihenjen vagy ágyban maradjon.
5. Szüksége van valaki segítségére, hogy megfeleljen az Ön személyes igényeinek.
a Krónikus leukémia vagy lusta, akár 50% – ában találtak egy rutin klinikai vagy laboratóriumi felülvizsgálat önkéntesek, akik úgy egészséges, gyere vért, azonban, mint a betegség előrehaladtával, nem specifikus tünetek jelennek de most már adott (1.Táblázat).

akut formában a specifikus megnyilvánulások az egyik sejtvonal hiányából származnak:
1. Vörösvértestek: anémiás szindróma, amelynek intenzitása a hipoxémia mértékétől függ, függetlenül a vérszegénység mértékétől. A közepes terhelés nehézlégzése orthoprea-ig.
2. Vérlemezkék: petechiák, ecchymosis a végtagokban, súlyosabb általánosított esetekben, száraz, nedves vérzés epistaxis, gingivorrhagia, hematuria, sörény vagy hematochesia. Nagyon súlyos a központi idegrendszerben (CNS).
3. Leukociták: láz, diaphoresis, lokalizált fertőzések frank szeptikémiáig (baktériumok vagy gombák). Ezek neutropenia esetén kevesebb, mint 250 teljes neutrofil / mm3.
infiltratív szindróma: bármely szövetben abnormális implantációra utal, bár gyakori:
1. Hepatomegalia vagy splenomegalia (5.ábra).
2. Adenomegália (helyi vagy általános).
3. Leukémiás arcszín.
4. Csontfájdalom a csontvelő tágulásából.
5. Lágy szövetek (granulocitikus szarkóma).
6. Here.
7. SNC.
8. Gumik és bármely hely (1. ábra).

: ezek a rosszindulatú sejtek rendellenes hiperprodukciójából és a megnövekedett apoptózisból származnak.
1. Acidózis.
2. Fokozott tejsav-dehidrogenáz (LLD).
3. Hiperkalémia.
4. Hiperurikémia.
5. Megnövekedett β2 mikroglobulin.
A klinikai bizonyíték érvényesül, mint a sarokköve a feltételezett diagnózis akut leukémia, illetve minden olyan feltétel, de ami ezután következik, az, hogy kiegészítse a diagnózis a támogatást a klinikai laboratóriumi az cytometry teljes vérkép, vagy különleges, ami azt jelenti, az alapos megfigyelés, a perifériás vér kenet által a technikai személyzet, aki a készítmény azonosítása kóros sejtek, különösen a leukémia.

speciális felülvizsgálatot igénylő laboratóriumi változtatások a következők:
1. Vérszegénység (bármilyen fokozat).
2. Leukopenia vagy leukocitózis (egy sejtvonal túlsúlya).
3. Thrombocytopenia.
4. Kombinációk: bicitopenia vagy pancytopenia.
különös figyelmet kell fordítani arra az esetre, ha a laboratórium leukociták vagy atípusos limfociták jelenlétéről számol be (lehet leukémiás blaszt). Célszerű szakértői felülvizsgálatot kérni (2.ábra).
csontvelő aspiráció elengedhetetlen a diagnózis (3. Ábra), valamint 20% – a blast szükséges kritériumokat, akut leukémia a fajták.

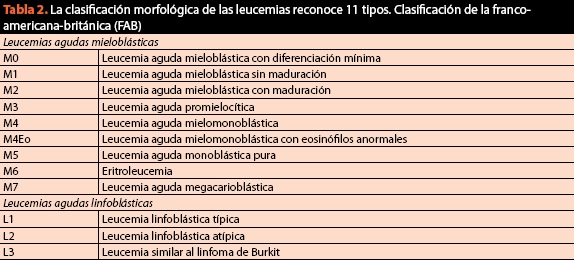
ugyanebben az eljárásban mintákat kell beszerezni az állapot végleges osztályozásához, kariotípus és immunofenotípus igényléséhez, mivel jelenleg a citomorfológiai kritérium létfontosságú, de már nem elegendő. A rosszindulatú vérbetegségek jelenlegi és jelenlegi besorolását a 2. táblázat tartalmazza.
a kezelés 2 fontos szempontra irányul: ezek közül az első a specifikus antileukémiás, és a kemoterápiaként ismert kémiai eredetű gyógyszerek használatán alapul, amelyek fő célja az összes leukémiás sejt felszámolása a szervezetből. A kezelés második aspektusa olyan szövődmények támogatása, amelyek általában a befogadott betegeknél fordulnak elő.
a kezelés 2 fontos szempontra irányul: ezek közül az első a specifikus antileukémiás, amely a kemoterápiaként ismert kémiai eredetű gyógyszerek használatán alapul, amelynek fő célja az összes leukémiás sejt felszámolása a szervezetből.
a kezelés második aspektusa azoknak a szövődményeknek a támogatása, amelyeket a betegek általában a befogadáskor mutatnak be, például:
1. Vérszegénység.
2. Rendellenes vérzés.
3. Többek között tüdő-és generalizált fertőzések (4.ábra).
4. Más szomszédos szövődmények, hogy a beteg lehet (komorbiditás), mint a már meglévő feltételek, pl. cukorbetegség, magas vérnyomás, szívbetegség, illetve egyéb betegségek körében gyakori szenvedő betegek leukémia.


ezért nagyon fontos figyelembe venni, hogy a leukémia elleni kezelés multidiszciplináris, más szakemberek részvételével, például a hematológus támogatásával.
az Antileukémiás kezelés különböző típusú leukémia és akut formák esetén is eltérő lesz. 3 fázisra oszlik:
1. Remisszió indukciója. A cél a teljes remisszió (CR) elérése, vagyis a beteg vérértékeinek normalizálása, a leukémia infiltrációval járó tüneteinek vagy jeleinek hiánya. A folyamat során a páciensnek “leukémia-mentes állapotban” kell lennie a csontvelőben, és a jövőben a normális hematopoiesis helyreállításának kell lennie, sajnos más esetekben a betegséggel gyógyulnak, ami rezisztens leukémiáról szól, amelynek prognózisa szörnyű. Ez az első folyamat 6-8 hétig tarthat a CR eléréséhez.
2. Konszolidáció. Ez magában foglalja ugyanazokat a gyógyszereket, amelyeket más kemoterápiás szerek indukciójában vagy kombinációjában alkalmaztak, szintén a maradék rosszindulatú sejtek felszámolása céljából, amelyek rezisztenciát alakíthatnak ki az első felhasználású sejtekkel szemben.
3. Karbantartás. A kezdeti leukémiás aktivitás lehetősége előtt előnyös a kemoterápia hatása alatt tartani a beteget, és a kezeléssel fenntartja a hatást, amíg a betegség eltűnik.

eddig az akut formák esetében a CR-nek tekintendő legszigorúbb kritériumok összetettebbé válnak, mivel a legjobb a molekuláris remissziót keresni, amely magában foglalja a promyelocytic leukémia (m3-FAB) esetében a kezdeti kromoszóma-változás keresését a T-vel (15;17) kezdetben specifikus molekuláris és citogenetikai vizsgálatokat kell keresni annak ellenére, hogy CR-ben vannak, mivel ha a transzlokáció továbbra is fennáll, akkor az agresszív kezelést a klón teljes eliminációjáig kell folytatni. Ez a fajta leukémia kell tekinteni, mint potenciálisan gyógyítható, és az egyik leggyakoribb a Latin lakosság.
a betegség gyógyulása ezután a beteg összes meglévő rosszindulatú sejtjének eltávolításától függ. Általában néhány leukémia-érzékenyek lehetnek, hogy a gyógyszer kemoterápia egyedül, de ma nagy jelentőséget kell tulajdonítani az úgynevezett prognosztikai tényezők, amelyek alapján matematikai modell, amely lehetővé teszi, hogy a betegek helyezni a mértéke prognózis ezek pedig a következők:
1. A leukémia típusa.
2. A kezdeti molekuláris elváltozás és annak perzisztenciája a kezelés vagy a felszámolás ellenére.
3. kor. A 60 évnél idősebb betegek rossz prognózissal rendelkeznek a fiatalabb betegekhez képest.
4. Kemoterápia. A feltüntetett gyógyszereket, és mindenekelőtt az ajánlott adagokat kell alkalmazni. Például a felnőtt LAL-ban a HyperCyVAD rendszer alkalmazása (a ciklofoszfamid, a vinkrisztin, az adriamicin, a dexametazon megnövekedett dózisai citozin-arabinoziddal és metotrexáttal kombinálva) az esetek 50% – ában 90% CR-t ér el, és az esetek 50% – ában gyógyul, az egyéb rendszerekkel korábban nem látott adatok. Ez a kezelés mérgező, és csak olyan intézményekben alkalmazható, amelyek elegendő támogatási forrással rendelkeznek. Sajnos a mi környezetünkben nem minden Központ rendelkezik az ajánlott gyógyszerekkel, az eredmények nem reprodukálhatók, mivel nem rendelkeznek elegendő Támogatással a beteg számára a maximális myelosuppressio fázisában.
5. Támogató terápia. Az eredményeket a kemoterápia és új drogok, új kombinációk, valamint több sajátossága kényszeríteni a végrehajtás a multidiszciplináris csapatok a címet a hematológus; telepítés használata a központi vénás katéter; támogatja a vér bank támogatása vérátömlesztés, a vérlemezkék pedig vörösvértestek (még akkor is, termékek astrocytoma); a beavatkozást a infectologist kimutatására fertőzések, majd a megfelelő használni, az antibiotikumok, vagy gombaellenes szerek, vagy megelőző vagy terápiás, ha szükséges; a rendelkezés az elkülönítő szoba, karbantartás, illetve a szállásmester szolgáltatások, amelyek lehetővé teszik, hogy elérjük a baktérium-mentes környezet, beleértve a steril etetés; egy laboratórium beteg minta kezelési protokoll a specifikus kezelési protokollok, valamint a menedzsment különleges minták (készítmény leukocita-koncentrátumok véralvadék hematic cytometry elérni az optimális olvasás); terület előkészítése magasan specializált gyógyszerek, másrészt, a legfontosabb az ápolási, kisegítő, adminisztratív személyzet, akik az egész csoport várhatóan az eredményeket, hogy más országokban.
6. Csontvelő-transzplantáció (MO). Ez egy komplex, magas költségű kezelés, amely kompatibilis MO donort és inaktív állapotot igényel, nagy valószínűséggel korai vagy késői visszaeséssel, vagy rossz prognózisú tényezőkkel. Ez egy gyógyítóbb hajlamú eljárás, mivel a kemoterápia megadózisait használja a leukémiás sejtek felszámolására, de a kísérlet során felszámolja a normál prekurzorokat is, és új kompatibilis normál csontvelő helyettesítésére van szükség. A típus allogén (testvér kompatibilis azonos) a legjobb választás, mivel a vevő elfogadja, csak a személyazonosság részleges (csak a teljes elfogadás azonos ikrek), ezért az eredmények elutasítása a graft-versus-host betegség, ami viszont ahhoz vezet, hogy graft versus leukémia, valamint növeli a felszámolása a klónok leukémiás, azonban súlyos esetekben a szindróma (3-4 fokozat) morbiditás, mortalitás nőtt, annak ellenére, hogy a specifikus kezelése.
krónikus leukémiák
1. Krónikus limfocitikus leukémia. Idősebb embereknél gyakrabban fordul elő, és a kritérium a 10 x 109/l-nél nagyobb lymphocytosis perzisztenciája, valamint a CD5+fenotípussal rendelkező limfociták több mint 50% – ának infiltrációja. A kritérium a kezelés a párhuzamos figyelembe limfociták egy év, vagy progresszió adenomegalia vagy splenomegalia, bár néhány esetben túl ez a szabvány a jelenléte hemolitikus anaemia vagy thrombocytopenia, autoimmun, majd jelezte, hogy a kezelés alapján a kombináció fludarabine, ciklofoszfamid, prednizolon, a stádium i-II. csak somenter, valamint megfigyelhető várható alakulását kezelés nélkül.
2. Krónikus myeloid leukémia (CML). Ebben a betegségben nagy előrelépést jelent a Philadelphia kromoszóma jelenlétének ismerete, amelyet 1950-ben írtak le az amerikai Unió városában, és hogy annak kezdete volt az első marker kromoszóma a rosszindulatú daganattal összefüggésben, azonban a kutatás évei során sikerült megismerni a t(9;22) a funkcionális kifejezés a kromoszóma a termelés egy oncoprotein nagy thyrokinokinase tevékenység, amely növeli a sejtosztódás meg, ami viszont megmagyarázza a nagy leukocytosis, valamint thrombocytosis, amellyel ezek a betegek jelen, valamint a nagy splenomegalia (5.Ábra).
ebben az időben 10-12 év telt el egy kis molekula felfedezése óta, amely kifejezetten a foszfát-donor molekuláris szubsztrát ellen irányul a leukémiás sejt és szubsztrátumainak belső szabályozására. A kezdetben STI (jelátvitel gátló) előállított kompetitív gátlás a foszforiláció, led-sejt apoptózis, valamint a betegek elért klinikai eredmények, soha nem látott a molekuláris remisszió akár 80-90% – os, 10 év, amely jelentősen megváltoztatta a természetes történelem, a betegség, a kezelés előtti volt, nem több, mint 3 éve. Ez az információ megváltoztatja a betegség természetes történetét és prognózisát, amely rövid távon korábban végzetes volt. 
Ezek a példák egy alap a fejlődés olyan intenzív, hogy történt az elmúlt pár évben, hogy kívánatos, hogy lehetővé teszik, provokálni a kamat orvosi diákok, a tanárok, de különösen az oktatási hatóságok, a leukémia, a tábornok, ami elfoglalja az első 5 helyen a frekvencia a rosszindulatú betegség, a felnőtt, az első helyen a gyermekek, szóval a hematológiai kell tüntetni belül a mag tantárgyak a tanterv, a karrier, az Orvostudomány, de még részeként a tanfolyamok posztgraduális specializáció.
bár az egyszerűség kedvéért hasznos, a brit francia-amerikai osztályozás (FAB) az esetek legfeljebb 20% ában diagnosztikai tehát terápiás-hibákhoz vezethet. Ezért az immunhisztokémia és molekuláris biológiai módszerek szerinti osztályozás a betegek helyes osztályozásának és későbbi kezelésének szinusz qua nem követelményévé vált (6.ábra). 
ellentétben a besorolás FAB, a KI (2. táblázat) tükrözi a változás a paradigma, amelyen keresztül értjük meg, hogy a betegségek a vér, mert az első alkalommal kombinált genetikai információt, a morfológiai, cytochemical, valamint immunophenotypic a klinikai eredmények belül a diagnosztikai algoritmusok a daganatok a hemopoetikus szöveti; az egyes kritériumok relatív fontossága különbözik a neoplazmák között, és nincs” arany standard ” az összes hematológiai malignitás osztályozására. A cél az volt, hogy meghatározzuk azokat az entitásokat, amelyeket a patológusok felismerhetnek, és amelyek klinikai jelentőséggel bírnak. 2001-es megjelenése óta különböző módosításokat hajtottak végre annak tartalmának frissítésére a legfrissebb felfedezésekhez képest. Az utolsó felülvizsgálat 2008-ból származik, és a hematológiai malignitásokat a következőképpen osztályozza:
1. Myeloid daganatok.
2. Lymphoid daganatok.
3. Hízósejt vagy zsírsejt betegségek.
4. Hisztiocitikus és dendritikus sejtbetegségek.

NEOPLASIS MYELOID
myeloid daganatok származó őssejtek a csontvelőben, differenciálódnak vörösvértestek, granulociták (neutrofil granulociták, basophil, valamint eosinophil), monociták, valamint megakaryocytes. A FAB besorolás 3 fő kategóriát ismer fel:
1. Akut mieloid leukémia.
2. Myelodysplasiás szindrómák.
3. Myeloproliferatív daganatok.
a morfológiai, hisztokémiai és immunofenotípusosan elismert kategóriák legfontosabb meghatározói, valamint a blasztsejtek százalékos aránya, a sejtvonal és a neoplasztikus sejtek differenciálódásának mértéke (7.ábra). Az elmúlt években a genetikai jellemzők (citogenetikai, valamint molekuláris), valamint a kezelés előtti, valamint az evolúció myelodysplasia mutatott szignifikáns hatással a klinikai viselkedését ezek a szenvedések, amelyek nem mindig korrelál a kategóriák a FAB, hogy a közép-vita az átsorolás az volt, hogy különbséget a jogalanyok, illetve patológiai prognosztikai faktorok, hogy elérjék a besorolás a klinikai jelentősége, jelentősége a patológus. Néhány genetikai rendellenesség úgy tűnik, hogy meghatározza a különböző betegségeket, míg mások egy adott betegség prognosztikai tényezőit képviselik.

jelenleg a WHO 4 fő csoportba sorolja a myeloid állapotokat:
1. Myeloproliferatív betegségek
2. Myelodysplasiás szindrómák
3. Myelodysplasiás / myeloproliferatív betegségek
4. Akut myeloid leukémiák

myeloproliferatív betegségek egy vagy több myeloid vonal proliferációjával összefüggő klonális rendellenességek csoportja. Egyre világosabbá válik, hogy ezek a betegségek gyakran olyan mutációkhoz kapcsolódnak, amelyek a tirozin-kináz aktivitás abnormális növekedését és a növekedési faktortól független progenitor sejtek proliferációját okozzák a csontvelőben. A csontvelőben a blasztok aránya normális vagy kissé magas, de mindig kevesebb, mint 20%. A Hematopoiesis általában hatékony, ami egy vagy több érett sejt számának növekedését eredményezi a perifériás vérben. A myeloproliferatív neoplazmák prototípusa Philadelphia kromoszóma pozitív (Ph1) krónikus myeloid leukémia (BCR/ABL). A többi entitás a következő:
1. Polycythemia vera.
2. Idiopátiás myelofibrosis.
3. Elsődleges alapvető trombocitémia.
4. Krónikus eozinofil leukémia.
5. Krónikus neutrofil leukémia.
6. Mastocytosis.
7. Nem osztályozható myeloproliferatív daganatok.

Mielodiszpláziás szindrómában lásd zavarok jellemzi hatástalan termelődését, valamint dysplasia, változó kockázata átalakulás akut leukémia. A cellularitás a csontvelőben gyakran növekszik, de nagyon változó. Van érés, de egy vagy több myeloid vonal dysplasia is. A Hematopoiesis nem hatékony, ezért citopeniák léteznek. Ez a tétel tartalmazza:
1. Refrakter cytopenia egysoros dysplasia*.
• refrakter anaemia.
• refrakter neutropenia.
• refrakter thrombocytopenia.
2. Refrakter anaemia gyűrű alakú sideroblasztokkal.
3. Refrakter cytopenia több vonal dysplasia esetén.
4. Tűzálló vérszegénység felesleges robbantásokkal.
5. Myelodysplasiás szindróma d-vel (5q).
6. Nem osztályozható mielodiszpasztikus szindróma.
7. Juvenilis myelodysplasiás szindróma, magában foglal egy ideiglenes entitás néven juvenilis refrakter cytopenia.
myelodysplasiás / myeloproliferatív szindrómák közé tartoznak azok a rendellenességek, amelyekben a dysplasiás és proliferatív jellemzők együtt léteznek. Ez a csoport magában foglalja a myelomonocytic juvenilis leukémiát, amely mindkét szindróma (myelodysplasiás és myeloproliferatív) képviselője. A normális vagy alacsony neutrofilszámmal rendelkező betegek közel fele, több sejtvonal dysplasia organomegalia és csontvelő nélkül, morfológiával, refrakter anémiával, túlzott blasztokkal, de monocitózissal. Más betegeknél súlyos neutrophilia, monocytosis és splenomegalia áll fenn. Még nem ismert, hogy 2 különböző betegség, myelodysplasiás és myeloproliferatív; eddig azonban nincs különbség a citogenetikai rendellenességekben vagy az in vitro kolóniák növekedési mintáiban vagy klinikai fejlődésükben, tehát vita van a klinikusok és a patológusok között a besoroláson belüli helyük szerint. Az utolsó felülvizsgálat szerint ebben a kategóriában található:
1. Krónikus myelomonocytás leukémia.
2. Atipikus krónikus myeloid leukémia (BCR / ABL negatív).
3. Fiatalkori myelomonocytás leukémia.
4. Myelodysplasiás / myeloproliferatív szindróma Nem osztályozható.
a kategória akut leukémia mieloblásticas (LAM) (amely által meghatározott százalékot meghaladja a 20% corekeszmyeloblasts a csontvelő vagy vérhígító perifériás, vagy a jelenléte egy citogenetikai rendellenesség különösen, annak ellenére, hogy a számla blast) felismeri a következő csoportok:
1. Lam ismétlődő citogenetikai transzlokációkkal.
2. LAM myelodysplasiás jellemzőkkel.
3. Lam és MDS a daganatellenes kezelésekkel kapcsolatban.
4. Nem vagyok besorolható.
5. Myeloid szarkóma.
6. A Down-szindrómával kapcsolatos Myeloid proliferációk.
7. A dendritikus sejtek plazmacitoid blasztikus daganata.
LYMPHOID DAGANATOK
azok, amelyek a sejtek normálisan fejleszteni a T-limfociták (citotoxikus LT, kollaboránsok, vagy szabályozók) vagy a B-limfociták (limfociták vagy plazma sejtek). Általában lymphoid daganatok vannak osztva azokat származó lymphoid prekurzorok, illetve érett limfociták, a plazma sejtek követően csoportosított szerint a leszármazás (B-vagy T).
történelmileg a csontvelőben és a csontvelőben előforduló limfoid neoplazmákat elkülönítették azoktól, amelyek tumorként (lymphoma) vannak jelen. Azonban ma már ismert, hogy bármilyen lymphoma jelen lehet a klinikai jellemzői A leukémia, és hogy bármilyen leukémia esetenként jelen, mint egy tumor (granulocita szarkóma). A WHO osztályozásában több limfoid daganat diagnosztizálása nemcsak a tumorsejtek anatómiai helyétől, hanem a tumorsejt morfológiailag meghatározott eredetétől is függ. Ezek a megfontolások érvénytelenítették a FAB osztályozás L1 és L2 kifejezéseinek relevanciáját, mivel nem korrelálnak immunofenotípusukkal, genetikai rendellenességeikkel vagy klinikai lefolyásukkal (8.ábra). L3 egyenértékű Burkitt lymphoma a leukémiás fázisban, és meg kell diagnosztizálni, mint olyan.

1. Prekurzor daganatok. Egyetértés van abban, hogy a szilárd daganatként jelen lévő prekurzor neoplazmák, valamint a csontvelőt és a vért érintő daganatok biológiailag ugyanazok a betegségek, különböző klinikai bemutatókkal. A legtöbb prekurzor limfoid neoplazmát leukémiaként mutatják be, ezért egyetértettek abban, hogy a besorolásnak meg kell őriznie a B típusú leukémiás fázisú LAL kifejezést prekurzor neoplazmák. 2 fő kategória van:
• prekurzor B leukémiák / limfómák.
• prekurzor leukémiák / lymphomák T.
2. Érett B-sejtes daganatok. A javasolt osztályozás a lymphomákat és a leukémiákat ugyanazon sejttípusba sorolja, mint ugyanazt a betegséget, különböző klinikai bemutatókkal vagy szakaszokkal. Az érett B-sejtekből származó specifikus betegségek a következők:
1. Krónikus limfocitikus leukémia / kis limfocita limfóma.
2. Limfoplazmatikus limfóma.
3. Köpeny sejt limfóma.
4. Prolymphocytás B-sejtes leukémia.
5. Follikuláris limfóma.
6. Diffúz nagysejtes lymphoma B.
* intravaszkuláris nagysejtes lymphoma B.
• elsődleges mediastinalis nagysejtes lymphoma B.
• nagysejtes lymphoma B (Epstein Barr vírussal-EBV-vel kapcsolatos).
•• Histiocyta-és T-sejtekben gazdag nagy B-sejtes lymphoma.
* diffúz központi idegrendszer nagy B-sejtes limfóma.
• * diffúz elsődleges bőr nagy B-sejtes limfóma.
• diffúz nagy B-sejtes lymphoma az idősek pozitív EBV.
• Pasmablasztikus limfóma.
• elsődleges pleurális limfóma.
• * Alkoma-pozitív (ALK) nagysejtes limfóma.
• Burkitt.
7. Marginális zóna B-sejtes limfóma.
8. Extranodális marginális zóna B-sejtes limfóma.
9. Lép marginális zóna B – sejtes lymphoma
10. Szőrös sejt leukémia.
11. Plasmocytoma / plazmasejtes myeloma.

MYELOID és LYMPHOID LINE neoplazmák
egyes neoplazmák a myeloid és lymphoid vonalak markereit fejezik ki.differenciálatlan) vagy mindkét vonal jelenlegi jellemzői (vegyes fenotípus vagy vegyes Vonalú akut leukémia).
3. táblázat.Clasificación de la OMS de las neoplasias mieloides y leucemias agudas
BIBLIOGRAFÍA
Bassan R, Hoelzer D. az akut limfoblasztos leukémia Modern terápiája. J-Klin-Onkol. 2011;29:523-43.
Burnett A, Wetzler M, Löwenberg B. J-Klin-Onkol. 2011;29:487-94.
Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. A WHO 2008-as osztályozása a limfoid neoplazmák és azon túl: fejlődő fogalmak és gyakorlati alkalmazások. Vér. 2011 május 12;117(19): 5019-32. Epub 2011 Február 7. Felülvizsgálat.
Cortes J, Hochhaus a, Hugues T, Kantajian H. Front Line és Salvage terápiák tirozin-kináz inhibitorokkal és egyéb kezelések krónikus Myeloid leukémiában. J-Klin-Onkol. 2011;29:524-31.
Chin-Hon Pui, Carroll WL, et al. Biológia, kockázati rétegződés, valamint a gyermekkori akut leukémia terápiája: frissítés. J-Klin-Onkol. 2011;29:551-65.
Gambacorti PC, Antolin L, Hurtado Mr. multicentrikus független értékelés az imatinibbel kezelt krónikus mieloid leukémiában szenvedő betegeken. Journal National Cancer Institute. 2011;103:1-9.
Grever M, Lozanki G. Modern stratégiák szőrös sejt leukémia. J-Klin-Onkol. 2011:29;583-90.
Gribben JG, O ‘ Brien S. Update on Therapy of Chronic lymphocytás leukaemia. J-Klin-Onkol. 2011;29:544-50.
Hurtado MR, Vargas VP, Cortes FJ. Krónikus Myeloid Leukémia. Jelenlegi fogalmak a Fiziopatológiában és a kezelésben. Cancerología. 2007:2:137-47.
Hurtado MR, Vargas VP, et al. Imatinib az Imatinib / Citarabinhoz képest a korai Philadelphia kromoszóma pozitív krónikus mieloid leukémia első vonalbeli kezelésében. A Mexikói kollaboratív leukémia csoport randomizált klinikai vizsgálatának eredményei. Klinikai Leukémia. 2008: 2(2);1128-32.
Lichtman MA. A klonális myeloid rendellenességek osztályozása és klinikai megnyilvánulása. Hu: Williams. Hematológia. Mc Graw-Hill; 2010.
Marcucci G, Haferlach T, Dohner H. a felnőtt akut mieloid leukémia molekuláris genetikája. Prognosztikai és terápiás hatások. J-Klin-Onkol. 2011;29:475-86.
Rafael Hurtado M Mellado Y, Floresw RG, Pablo Vargas. Semiología de la Citometría Hemática. Rev Fac med UNAM. 2010; 53:36-43.
Sanz M, Lo-Coco F. az akut promyelocytás leukémia kezelésének Modern megközelítései. J-Klin-Onkol. 2011;29:495-503.
Megjegyzés
* Dysplasia. A citomorfológiai változásra utal, amely magában foglalja a sejtmag-citoplazma érésének disszociációját (ne feledje, hogy a kromatin érése a DNS-től és az RNS citoplazmától függ, ezért a mag az éréskor megáll, míg a citoplazma folytatja normális folyamatát), amely nem életképes sejteket termel, és intramedulláris apoptózis van.
