Chemguide: Core Chemistry 14 – 16
kettős és hármas kovalens kötések
Ez az oldal több (kettős vagy hármas) kovalens kötés lehetőségét mutatja be az oxigénnel, nitrogénnel, szén-dioxiddal és eténnel rendelkező atomok között példák. Ezek azért vannak kiválasztva, mert ezek mind általánosan meghatározott Brit tananyag 14-16 évesek.
feltételezem, hogy elolvasta a kovalens kötést bevezető oldalt, és hozzáfér egy periódusos táblázathoz, mint például az, amelyet letölthet ezen az oldalon.
kettős kötés oxigénben
ha oxigént keres a periódusos táblán, akkor azt találja, hogy atomszáma 8 – tehát a semleges atomnak 8 protonja és 8 elektronja van. Ezek lesznek elrendezve 2,6.
tehát két ilyen atomja van:
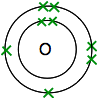
mindegyiknek két páratlan elektronja van. A maximális energetikai stabilitás elérése érdekében ezeket össze kell párosítani.
tehát az oxigéneknek két pár elektronjuk van:
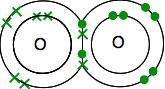
ezt sokkal könnyebb látni a vonalak segítségével a megosztott elektronok párjainak ábrázolására:
![]()
hármas kötés nitrogénben
nitrogén a periódusos rendszerben, akkor képes lesz arra, hogy dolgozzanak ki, hogy az elektronikus szerkezet 2,5. Az oxigénnel összehasonlítva tehát egy pár elektron és három páratlan elektron van a külső szintjén.
ahhoz, hogy a lehető legerőteljesebben stabil legyen, mindezt kovalens kötésekben kell párosítani. Két nitrogén atomok ezért össze így:
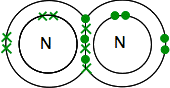
ez sokkal könnyebb a használata vonal képviseli pár közös elektronok: ![]()
Kettős kötés a szén-dioxid
Szén-dioxid-elektronikus szerkezet 2,4 4 pár nélküli elektron a külső szinten.
az oxigén 2,6, a külső szinten 2 pár elektron és 2 Páratlan elektron található.
meg kell, hogy a végén az összes elektronok párosítva -, és csak egy módja van ennek.
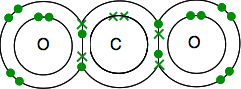
mint korábban, a kötés könnyebb látni vonalak segítségével kötés pár elektronok.
![]()
ha két atom között két elektronpár van, akkor nem meglepő módon kettős kötésnek nevezik. Tehát minden oxigént kettős kötéssel csatlakoztat a szénatomhoz a közepén.
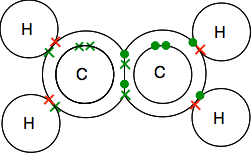
kettős kötés eténben, C2H4
etén és más hasonló vegyületek, amelyek szénatomok közötti kettős kötéssel rendelkeznek, fontos anyagok a kémiában. A tanfolyam során később részletesebben találkozik velük.
nézze meg alaposan a dots-and-crosses diagramot, és győződjön meg róla, hogy megérti, hogy mindez hogyan illeszkedik egymáshoz. Ennek így kell lennie, hogy mind a karbonok, mind a hidrogének egyetlen elektronja párosuljon kötési párokban.
Ha a kötési párokat vonalakként bemutató diagramokkal találkozol, akkor a két változat egyikét találhatod.
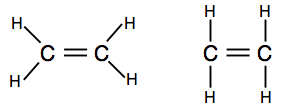
az első jobban mutatja a molekula tényleges alakját, de a második is tökéletesen elfogadható ezen a szinten.
hová szeretne most menni?
a kovalens kötésről szóló szakasz következő oldalára . . .
az atomszerkezet és kötés menüpontra . . .
A kémia 14-16 menübe . . .
A Chemguide főmenübe . . .