tanulási célok
végére ez a szakasz, akkor képes lesz arra, hogy:
- vizsgálja hőátadás.
- Számítsa ki a végső hőmérsékletet a hőátadásból.
eddig a hőátadás miatti hőmérsékletváltozást tárgyaltuk. A hőátadásból nem következik be hőmérsékletváltozás, ha a jég megolvad, és folyékony vízré válik (azaz fázisváltozás során). Vegyük például a jégcsapokból csöpögő vizet, amely a nap által felmelegített tetőn olvad. Ezzel szemben a víz lefagy egy alacsonyabb hőmérsékletű környezetben hűtött jégtálcában.

1.ábra. A levegőből származó hő a jégbe jut, ami megolvad. (hitel: Mike Brand)
energia szükséges a szilárd anyag megolvasztásához, mivel a szilárd molekulák közötti összetartó kötéseket szét kell szakítani úgy, hogy a folyadékban a molekulák hasonló kinetikus energiákon mozoghatnak; így nincs hőmérséklet-emelkedés. Hasonlóképpen energiára van szükség a folyadék elpárologtatásához, mivel a folyadékban lévő molekulák vonzó erők révén kölcsönhatásba lépnek egymással. A fázisváltozás befejezéséig nincs hőmérsékletváltozás. Egy csésze szóda hőmérséklete kezdetben 0ºc-on 0ºc-on marad, amíg az összes jég el nem olvad. Ezzel szemben a fagyasztás és a kondenzáció során felszabadul az energia, általában hőenergia formájában. A munkát kohéziós erők végzik, amikor a molekulákat összehozzák. A megfelelő energiát ki kell adni (eloszlatni), hogy lehetővé tegyék számukra, hogy együtt maradjanak 2.ábra.
a fázisváltozásban részt vevő energia két fő tényezőtől függ: a kötések vagy erőpárok számától és erősségétől. A kötések száma arányos a molekulák számával, így a minta tömegével. Az erők ereje a molekulák típusától függ. Az m tömegű minta fázisának megváltoztatásához szükséges Q hőt
Q = mLf (olvadás / fagyasztás,
Q = mLv (párologtatás/páralecsapódás),
ahol a fúzió látens hője, Lf és a párologtatás látens hője, LV, olyan anyagi állandók, amelyeket kísérletileg meghatároznak. Lásd (1. Táblázat).

2.ábra. a) energia szükséges ahhoz, hogy részben legyőzzük a szilárd molekulák közötti vonzó erőket, hogy folyadékot képezzünk. Ugyanezt az energiát el kell távolítani a fagyasztáshoz. b) a molekulákat nagy távolságok választják el, amikor folyadékról gőzre mennek, jelentős energiát igényelnek a molekuláris vonzerő leküzdéséhez. Ugyanezt az energiát el kell távolítani a kondenzáció bekövetkezéséhez. A fázisváltozás befejezéséig nincs hőmérsékletváltozás.
a látens hőt J / kg egységekben mérik. Mind az Lf, mind az Lv az anyagtól függ, különösen a molekuláris erők erejétől, amint azt korábban említettük. Az Lf-et és az Lv-t együttesen látens hő együtthatóknak nevezzük. Látens vagy rejtett, mert a fázisváltozásokban az energia belép vagy elhagyja a rendszert anélkül, hogy hőmérsékletváltozást okozna a rendszerben; tehát valójában az energia rejtve van. Az 1. táblázat az Lf és Lv reprezentatív értékeit sorolja fel, olvadáspontokkal és forráspontokkal együtt.
a táblázat azt mutatja, hogy jelentős mennyiségű energia vesz részt a fázisváltozásokban. Nézzük meg például, hogy mennyi energiára van szükség egy kilogramm jég megolvasztásához 0ºc-on, hogy 0°C-on kilogramm vizet termeljünk.0 kg) (334 kJ/kg) = 334 kJ az energia, hogy olvad egy kilogramm jég. Ez sok energiát jelent, mivel ugyanazt az energiamennyiséget képviseli, amely az 1 kg folyékony víz hőmérsékletének 0ºc-ról 79,8 ºC-ra történő emeléséhez szükséges. Még több energiára van szükség a víz elpárologtatásához; 2256 kJ-ra lenne szükség ahhoz, hogy 1 kg folyékony vizet a normál forrásponton (100ºC légköri nyomáson) gőzzé (vízgőz) változtasson. Ez a példa azt mutatja, hogy a fázisváltozás energiája óriási, mint a fázisváltozás nélküli hőmérsékletváltozásokhoz kapcsolódó energia.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Vegyük például azt a tényt, hogy a nedves éghajlaton a levegő hőmérséklete ritkán haladja meg a 35,0 ºC-ot, ami azért van, mert a legtöbb hőátadás elpárologtató vízbe kerül a levegőbe. Hasonlóképpen, a nedves időjárás hőmérséklete ritkán esik a harmatpont alá, mert hatalmas hő szabadul fel, amikor a vízgőz kondenzálódik.
a fázisváltozás hatásait pontosabban vizsgáljuk úgy, hogy figyelembe vesszük a hőt −20ºC-os jégmintába (3.ábra). A jég hőmérséklete lineárisan emelkedik, 0,50 cal/G ° C állandó sebességgel elnyeli a hőt, amíg el nem éri a 0ºC-ot. Ezen a hőmérsékleten egyszer a jég megolvad, amíg az összes jég el nem olvad, 79,8 cal/g hőt elnyelve. A hőmérséklet ebben a fázisváltozásban 0ºc-on állandó marad. Miután az összes jég megolvadt, a folyékony víz hőmérséklete emelkedik, elnyeli a hőt egy új állandó sebességgel, 1,00 cal/g º ºC-on. 100 ° C-on a víz forrni kezd, és a hőmérséklet ismét állandó marad, miközben a víz 539 cal/g hőt vesz fel ebben a fázisváltásban. Amikor az összes folyadék gőzgőzvé válik, a hőmérséklet ismét emelkedik, 0,482 cal/G ° C hőmérsékleten elnyeli a hőt.
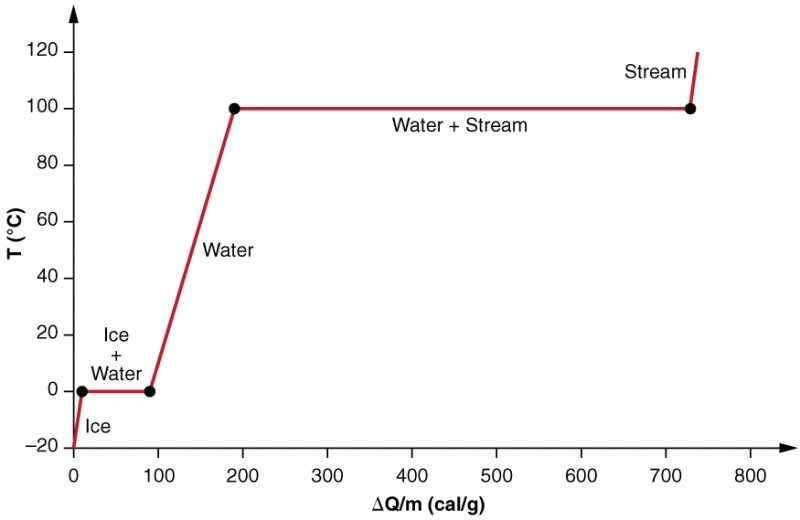
3.ábra. Egy grafikont a hőmérséklet versus energia hozzáadott. A rendszer úgy van kialakítva, hogy a gőz ne párologjon el, miközben a jég felmelegszik, hogy folyékony vízré váljon, így a párologtatás során a gőz a rendszerben marad. A 0 ° C-on és 100 ° C-on mért állandó hőmérsékleti értékek hosszú szakaszai az olvadás és a párolgás nagy látens hőjét tükrözik.
a víz a forráspont alatti hőmérsékleten elpárologhat. Több energiára van szükség, mint a forráspontnál, mivel a vízmolekulák kinetikus energiája 100ºC alatti hőmérsékleten kevesebb, mint 100ºC-on, ezért kevesebb energia áll rendelkezésre véletlenszerű termikus mozgásokból. Vegyük például azt a tényt, hogy a testhőmérsékleten a bőr izzadása 2428 kJ/kg hőbevitelt igényel, ami körülbelül 10 százalékkal magasabb, mint a 100ºC-os párologtatás látens hője. Ez a hő a bőrből származik, így hatékony hűtési mechanizmust biztosít meleg időben. A magas páratartalom gátolja a párolgást, így a testhőmérséklet emelkedhet, így a homlokán egyenetlen izzadság marad.
1. példa. Számítsa ki a végső hőmérsékletet a Fázisváltozástól: hűtési szóda jégkockákkal
három jégkockát használnak a szóda 20ºC-os hűtésére msoda = 0,25 kg tömeggel. A jég 0ºc – on van, minden jégkocka tömege 6,0 g.tegyük fel, hogy a szódát habtartályban tartják, hogy a hőveszteséget figyelmen kívül lehessen hagyni. Tegyük fel, hogy a szóda ugyanolyan hőteljesítménnyel rendelkezik, mint a víz. Keresse meg a végső hőmérsékletet, amikor az összes jég megolvadt.
stratégia
a jégkockák 0ºc olvadási hőmérsékleten vannak. A hőt a szódából a jégbe olvasztják. A jég olvadása két lépésben történik: először a fázisváltozás következik be, majd a szilárd (jég) folyékony vízré alakul az olvadási hőmérsékleten, majd a víz hőmérséklete emelkedik. Az olvadás 0ºc-os vizet eredményez, így több hő kerül át a szódából erre a vízre, amíg a víz plusz szóda rendszer el nem éri a termikus egyensúlyt, Qice = − Qsoda.
a jégre továbbított hő
Qice = egerek Lf + micecW (Tf−0ºC).
a szóda által kibocsátott hő Qsoda = msodacW (Tf−20ºC). Mivel nincs hő elvész, Qice = – Qsoda, úgy, hogy
egerek Lf + micecW(Tf−0ºC) = –msodacW (Tf−20ºC).
hozza a bal oldalon a TF-t érintő összes kifejezést, a jobb oldalon pedig az összes többi kifejezést. Oldja meg az ismeretlen mennyiség Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
oldat
- határozza meg az ismert mennyiségeket. A jég tömege egerek = 3 × 6,0 g = 0,018 kg, a szóda tömege msoda = 0,25 kg.
- Számolja ki a számlálóban szereplő kifejezéseket: m sodacW(20ºC)=(0,25 kg)(4186 J/kg º ºC)(20ºC) = 20,930 J és miceLf = (0,018 kg)(334,000 J/kg) = 6012 J.
- Számítsa ki a nevezőt: (msoda + egerek)cW = (0,25 kg + 0.018 kg) (4186 K/(kg º ºC) = 1122 J/ºC.
- Számítani a végső hőmérséklet: \displaystyle{T}_{\text{f}}=\frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Vita
Ez a példa szemlélteti, hogy a hatalmas energiák benne során egy fázisváltó. A jég tömege körülbelül 7% – a a víz tömegének, de a szóda hőmérsékletének észrevehető változásához vezet. Bár azt feltételeztük, hogy a jég fagyási hőmérsékleten van, ez helytelen: a tipikus hőmérséklet −6ºC. Ez a korrekció azonban olyan végső hőmérsékletet ad, amely lényegében megegyezik a talált eredménnyel. Meg tudja magyarázni, miért?

4.ábra. Kondenzáció egy pohár jeges tea. (hitel: Jenny Downing)
láttuk, hogy a párologtatás hőátadást igényel a környezetből származó folyadékra, hogy az energiát a környezet felszabadítsa. A kondenzáció fordított folyamat, növelve a környezet hőmérsékletét. Ez a növekedés meglepőnek tűnhet, mivel a kondenzációt hideg tárgyakkal társítjuk—például az ábrán látható üveg. Az energiát azonban el kell távolítani a kondenzációs molekulákból, hogy a gőz kondenzálódjon. Az energia pontosan ugyanaz, mint ami ahhoz szükséges, hogy a fázisváltozás a másik irányba, a folyadéktól a gőzig, így kiszámítható Q = mLv.
kondenzáció alakul ki a 4. ábrán, mivel a közeli levegő hőmérséklete a harmatpont alá csökken. A levegő nem képes annyi vizet tartani, mint szobahőmérsékleten, így a víz kondenzálódik. Az energia felszabadul, amikor a víz kondenzálódik, felgyorsítva a jég olvadását az üvegben.
valós alkalmazás
energia is felszabadul, ha egy folyadék lefagy. Ezt a jelenséget a floridai gyümölcstermesztők használják a narancs védelmére, ha a hőmérséklet közel van a fagyponthoz (0ºC). A termelők a gyümölcsösökben permeteznek vizet a növényekre, hogy a víz megfagyjon, és a fákon lévő növekvő narancsoknak hő szabaduljon fel. Ez megakadályozza, hogy a narancs belsejében lévő hőmérséklet fagypont alá csökkenjen, ami károsíthatja a gyümölcsöt.

14.11. A jég ezeken a fákon nagy mennyiségű energiát szabadított fel, amikor megfagyott, segítve megakadályozni, hogy a fák hőmérséklete 0ºc alá csökkenjen. A vizet szándékosan permetezik a gyümölcsösökre, hogy megakadályozzák a kemény fagyokat. (credit: Hermann Hammer)
szublimáció az átmenet a szilárd gőzfázis. Lehet, hogy észrevette, hogy a hó folyékony víz nyom nélkül eltűnik a vékony levegőben, vagy a jégkockák eltűnése a fagyasztóban. A fordított is igaz: a fagy nagyon hideg ablakokon alakulhat ki anélkül, hogy átmenne a folyékony színpadon. Népszerű hatás a szárazjégből származó “füst” előállítása, amely szilárd szén-dioxid. A szublimáció azért következik be, mert a szilárd anyagok egyensúlyi gőznyomása nem nulla. Egyes Légfrissítők a szilárd szublimációt használják, hogy parfümöt fecskendezzenek a helyiségbe. A lepke golyók egy kissé mérgező példa egy fenolra (szerves vegyület), amely szublimálja, míg egyes szilárd anyagok, például az ozmium-tetroxid annyira mérgezőek, hogy zárt tartályokban kell tartani őket, hogy megakadályozzák az emberi expozíciót szublimáció által termelt gőzöknek.

5. ábra. A szilárd és a gőz közötti közvetlen átmenetek gyakoriak, néha hasznosak, sőt gyönyörűek is. a) a szárazjég közvetlenül szublimálja a szén-dioxid-gázt. A látható gőz vízcseppekből készül. (hitel: Windell Oskay) (b) a fagy mintákat képez egy nagyon hideg ablakon, egy példa egy közvetlenül gőzből képződött szilárd anyagra. (hitel: Liz West)
minden fázisátmenet hővel jár. Közvetlen szilárd-gőz átmenetek esetén a szükséges energiát a Q = mLs egyenlet adja meg, ahol Ls a szublimáció hője, amely az 1 megváltoztatásához szükséges energia.00 kg anyag a szilárd fázistól a gőzfázisig. Az Ls hasonló az Lf-hez és az Lv-hez, értéke pedig az anyagtól függ. A szublimáció energiabevitelt igényel, így a szárazjég hatékony hűtőfolyadék, míg a fordított folyamat (azaz a fagyás) energiát bocsát ki. A szublimációhoz szükséges energia mennyisége ugyanolyan nagyságrendű, mint más fázisátmeneteknél.
Az ebben a részben és az előző részben bemutatott anyag lehetővé teszi számunkra, hogy kiszámítsuk a hőmérséklet-és fázisváltozással kapcsolatos hatások számát. Minden esetben meg kell határozni, hogy melyik hőmérséklet-és fázisváltozásra kerül sor, majd alkalmazni kell a megfelelő egyenletet. Ne feledje, hogy a hőátadás és a munka mind a hőmérséklet, mind a fázisváltozást okozhatja.
problémamegoldó stratégiák a hőátadás hatásaira
- vizsgálja meg a helyzetet annak meghatározására, hogy a hőmérséklet vagy a fázis megváltozik-e. Van-e hőátadás a rendszerbe vagy ki? Ha a fázisváltozás jelenléte vagy hiánya nem nyilvánvaló, akkor először meg kell oldania a problémát, mintha nem lenne fázisváltozás, és meg kell vizsgálnia a kapott hőmérsékletváltozást. Ha elegendő egy forráspont vagy olvadáspont túllépése, akkor menjen vissza, és tegye meg a problémát lépésekben—hőmérsékletváltozás, fázisváltozás, későbbi hőmérsékletváltozás stb.
- azonosítsa és sorolja fel azokat az objektumokat, amelyek megváltoztatják a hőmérsékletet és a fázist.
- pontosan határozza meg, hogy mit kell meghatározni a problémában (azonosítsa az ismeretleneket). Az írásbeli lista hasznos.
- készítsen egy listát arról, hogy mi van megadva, vagy mire lehet következtetni a problémából, amint azt (azonosítsa a bohócokat).
- oldja meg a meghatározandó mennyiség (ismeretlen) megfelelő egyenletét. Hőmérsékletváltozás esetén az átvitt hő az adott hőtől függ (Lásd az 1. táblázatot a Hőmérsékletváltozásban és a Hőteljesítményben), míg a fázisváltozásnál az átvitt hő a látens hőtől függ. Lásd Az 1. Táblázatot.
- helyettesítse a knowns együtt egységeit a megfelelő egyenletbe, és így numerikus megoldások komplett egységek. Ezt lépésekben kell elvégeznie, ha a folyamatnak egynél több szakasza van (például hőmérsékletváltozás, amelyet fázisváltozás követ).
- ellenőrizze a választ, hogy ésszerű-e: van-e értelme? Például győződjön meg róla, hogy a hőmérsékletváltozás nem okoz olyan fázisváltozást, amelyet nem vett figyelembe.
ellenőrizze megértését
miért marad a hó a hegyi lejtőkön, még akkor is, ha a nappali hőmérséklet magasabb, mint a fagypont?
a hó jégkristályokból képződik, így a víz szilárd fázisa. Mivel a fázisváltozásokhoz hatalmas hő szükséges, bizonyos ideig tart, amíg ez a hő felhalmozódik a levegőből, még akkor is, ha a levegő 0ºc felett van. Minél melegebb a levegő, annál gyorsabb ez a hőcsere, annál gyorsabban olvad a hó.
szakasz összefoglaló
- a legtöbb anyag szilárd, folyékony és gáz formában is létezhet, amelyeket “fázisoknak” neveznek.”
- a Fázisváltozások egy adott anyag rögzített hőmérsékletén, adott nyomáson fordulnak elő, és ezeket a hőmérsékleteket forráspontnak, fagypontnak (vagy olvadáspontnak) nevezzük.
- a fázisváltozások során az elnyelt vagy felszabaduló hőt a következők adják: Q = mL, ahol L a látens hő együttható.
fogalmi kérdések
- a hőátadás hőmérséklet-és fázisváltozást okozhat. Mi más okozhatja ezeket a változásokat?
- hogyan segít a víz fúziójának látens hője lassítani a levegő hőmérsékletének csökkenését, talán megakadályozva, hogy a hőmérséklet jelentősen ºC alá csökkenjen, nagy víztestek közelében?
- mi a jég hőmérséklete közvetlenül a víz fagyasztása után?
- ha a ºC jeget ºC vízbe helyezi egy szigetelt tartályba, mi fog történni? Néhány jég megolvad, több víz fagy, vagy sem fog megtörténni?
- milyen hatással van a páralecsapódás egy pohár jeges vízre a jég olvadásának sebességére? A kondenzáció felgyorsítja az olvadási folyamatot, vagy lelassítja?
- nagyon nedves éghajlaton, ahol számos víztest van, például Floridában, szokatlan, hogy a hőmérséklet körülbelül 35ºC (95ºF) fölé emelkedik. A sivatagokban azonban a hőmérséklet messze meghaladhatja ezt. Magyarázza el, hogyan segít a víz elpárolgása korlátozni a magas hőmérsékletet nedves éghajlaton.
- télen San Franciscóban gyakran melegebb, mint a közeli Sacramentóban, 150 km-re a szárazföldön. Nyáron, szinte mindig melegebb Sacramento. Magyarázza el, hogy a San Franciscót körülvevő víztestek hogyan mérséklik a szélsőséges hőmérsékleteket.
- a fedél felhelyezése egy forró edényre nagymértékben csökkenti a forráshoz szükséges hőátadást. Magyarázd el, miért.
- a fagyasztva szárított ételeket vákuumban dehidratálták. A folyamat során az élelmiszer lefagy, majd fel kell melegíteni, hogy megkönnyítse a kiszáradást. Magyarázza el mind azt, hogy a vákuum felgyorsítja a kiszáradást, mind azt, hogy az élelmiszer miért fagy le.
- ha a levegő éjszaka sugárzik, szokatlan, hogy a hőmérséklet a harmatpont alá esik. Magyarázd el, miért.
- egy fizika tantermi bemutatón egy oktató szájon át felfújja a léggömböt, majd folyékony nitrogénben lehűti. Hideg állapotban a zsugorodott ballon kis mennyiségű Világoskék folyadékot tartalmaz, valamint néhány hószerű kristályt. Ahogy felmelegszik, a folyadék felforr, a kristályok egy része szublimálódik, néhány kristály egy ideig megmarad, majd folyadékot termel. Azonosítsa a kék folyadékot és a két szilárd anyagot a hideg léggömbön. Igazolja az azonosításokat az 1. táblázat adatai alapján.
Problémákat & Gyakorlatok
- Mennyi hőátadás a (kcal) van szükség, hogy olvadás egy 0.450-kg-os csomag fagyasztott zöldségek eredetileg a 0ºC, ha a hő fusion ugyanaz, mint a víz?
- a 0ºc ice-t tartalmazó zsák sokkal hatékonyabb az energia elnyelésében, mint az azonos mennyiségű 0ºc vizet tartalmazó zsák. a) mennyi hőátadás szükséges a 0,800 kg víz hőmérsékletének 0ºc-ról 30,0 ºC-ra történő emeléséhez? b) mennyi hőátadás szükséges az első olvadáshoz 0.800 kg 0ºc jég, majd emelje fel a hőmérsékletét? (c) magyarázza el, hogy a válasz hogyan támogatja azt az állítást, hogy a jég hatékonyabb.
- (a) Mennyi hő átadása szükséges emelni a hőmérsékletet egy 0.750-kg alumínium edény tartalmazó 2.50 kg víz 30.0 ° c-on a forráspontú majd forraljuk el 0.750 kg víz? b) mennyi ideig tart ez, ha a hőátadás sebessége 500 W 1 watt = 1 joule/másodperc (1 W = 1 J / s)?
- a páralecsapódás kialakulása egy pohár jeges vízen a jég gyorsabban olvad, mint egyébként. Ha 8.00 g kondenzáció alakul ki mind a vizet, mind a 200 g jeget tartalmazó üvegen, hány gramm jég olvad el ennek eredményeként? Tegyük fel, hogy nincs más hőátadás.
- utazás közben észreveszi, hogy egy 3, 50 kg-os jégzsák átlagosan egy napig tart a hűtőben. Mi az átlagos teljesítmény wattban belépve a jégbe, ha 0ºc-on kezdődik, és pontosan egy nap alatt teljesen megolvad 0ºC vízre 1 watt = 1 joule/másodperc (1 W = 1 J/s)?
- egy bizonyos száraz napsütéses napon az úszómedence hőmérséklete 1, 50 ºC-kal emelkedne, ha nem párologna. A víz melyik frakciójának elpárolognia kell ahhoz, hogy pontosan elegendő energiát szállítson a hőmérséklet állandó fenntartásához?
- (a) Mennyi hő átadása szükséges emelni a hőmérsékletet egy 0.200-kg darab jég, a -20.0 ° c-on, hogy 130ºC, beleértve a szükséges energiát fázis változások? b) mennyi időre van szükség az egyes szakaszokhoz, feltételezve az állandó 20,0 kJ / s hőátadást? (c) készíts egy grafikont a hőmérséklet versus idő erre a folyamatra.
- 1986-ban egy óriási jéghegy tört ki az Antarktisz Ross Jégpolcáról. Körülbelül egy téglalap volt 160 km hosszú, 40.0 km széles és 250 m vastag. a) mi a jéghegy tömege, tekintettel arra, hogy a jég sűrűsége 917 kg/m3? b) mennyi hőátadásra van szükség (joule-ban) annak megolvasztásához? c) hány évig tartana egyedül a napfény, hogy ilyen vastag jég olvadjon, ha a jég átlagosan 100 W/m2, 12.00 h / nap elnyeli?
- hány gramm kávét kell elpárolognia 350 g kávéból egy 100 g-os üvegcsészében, hogy a kávét 95,0 ºC-ról 45,0 ºC-ra hűtse? Feltételezheti, hogy a kávénak ugyanolyan termikus tulajdonságai vannak, mint a víznek, és hogy a párolgás átlagos hője 2340 kJ/kg (560 cal/g). (Figyelmen kívül hagyhatja a kávé tömegének változását, amikor lehűl, ami a helyesnél valamivel nagyobb választ ad.)
- (a) nehéz eloltani a tüzet egy nyersolaj-tartályhajón, mert minden liter nyersolaj 2, 80 × 107 J energiát bocsát ki Égéskor. Jól illusztrálja ezt a nehézséget, kiszámítani, hogy hány liter víz kell kiürültek, hogy felszívja a felszabaduló energia elégetésével 1.00 L a nyersolaj, ha a víz hőmérséklete emelte 20.0 ° c-on, hogy 100ºC, a kelések, de a keletkező gőz fel, hogy 300ºC. b) beszélje meg az által okozott további szövődményeket, hogy a nyersolaj sűrűsége kisebb, mint a víz.
- a zivatarokban a kondenzációból felszabaduló energia nagyon nagy lehet. Számítsa ki a légkörbe kibocsátott energiát egy 1 km sugarú kis viharra, feltételezve, hogy 1, 0 cm eső egyenletesen kicsapódik ezen a területen.
- a fagykárosodás megelőzése érdekében 4, 00 kg 0ºc vizet permeteznek egy gyümölcsfára. a) mennyi hőátadás történik, amikor a víz lefagy? b) mennyivel csökken a 200 kg-os FA hőmérséklete, ha ez a hőmennyiség átkerül a fáról? Vegyük a fajlagos hőt 3,35 kJ/kg · ºC-ra, és feltételezzük, hogy nem következik be fázisváltozás.
- Egy 0.250-kg alumínium tállal kezében 0.800 kg levest 25.0 ° c-on kerül a fagyasztóba. Mi a végső hőmérséklet, ha 377 kJ energiát viszünk át a tálból és a levesből, feltételezve, hogy a leves hőtulajdonságai megegyeznek a vízéval?
- Egy 0.0500-kg jégkocka a -30.0 ° c-on kerül 0.400 kg-35.0 ° c-on víz egy nagyon jól szigetelt tartályban. Mi a végső hőmérséklet?
- ha 0, 0100 kg 20, 0 ºC vizet önt egy 1, 20 kg-os jégtömbre (amely kezdetben -15, 0 ºC), mi a végső hőmérséklet? Feltételezheti, hogy a víz olyan gyorsan lehűl, hogy a környezet hatása elhanyagolható.
- az őslakosok néha vízzáró kosarakban szakácsolnak, forró sziklákat helyezve a vízbe, hogy felforralják. Milyen tömegű 500ºc-os kőzetet kell elhelyezni 4,00 kg 15,0 ºC-os vízben, hogy hőmérséklete 100ºC-ra emelkedjen, ha 0,0250 kg víz távozik gőzként a kezdeti sistergésből? Lehet, hogy figyelmen kívül hagyja a hatását a környéken, és hogy az átlagos fajlagos hő a sziklák, hogy a gránit.
- Mi lenne a végső hőmérséklet a serpenyőben, víz Kiszámítása során a Végső Hőmérséklet, Amikor a Hőt Át Két test Között: Szakadó Hideg Víz, Forró Serpenyőben, ha 0.260 kg víz került a serpenyőbe, majd 0.0100 kg a víz elpárolgott azonnal, így a fennmaradó, hogy közös hőmérséklet a serpenyőben?
- egyes országokban folyékony nitrogént használnak tejelő teherautókon a mechanikus hűtőszekrények helyett. A 3.A 00 órás szállítási út 200 L folyékony nitrogént igényel,amelynek sűrűsége 808 kg / m3. A) kiszámítja az ilyen mennyiségű folyékony nitrogén elpárologtatásához szükséges hőátadást, és 3,00 ºC-ra emeli annak hőmérsékletét. (Használja a cp-t, és vállalja, hogy állandó a hőmérsékleti tartományban.) Ez az érték a folyékony nitrogénkészletek hűtésének mennyisége. b) mi ez a hőátadási Arány kilowattórában? C) hasonlítsa össze a 0ºc-os jég azonos tömegének megolvasztásából nyert hűtési mennyiséget a folyékony nitrogén elpárologtatásával.
- néhány fegyvergyártó saját golyókat készít, ami magában foglalja az ólomcsigák olvasztását és öntését. Mennyi hőátadás szükséges a hőmérséklet emeléséhez, 0,500 kg ólom megolvasztásához, 25,0 ºC-tól kezdve?
Szójegyzék
hő szublimációs: az energia módosításához szükséges anyag a szilárd fázisban, hogy a gőz fázis
látens hő együttható: egy fizikai állandó egyenlő mennyiségű hőt át minden 1 kg anyag alatt a változás szakaszában az anyag
szublimációs: az átmenet a szilárd fázis a gőz fázis
kiválasztott megoldások problémák & gyakorlatok
1. 35, 9 kcal
3. a) 591 kcal; b) 4,94 × 103 s
5. 13,5 W
7. (a) 148 kcal; (b) 0.418 s, 3.34 s, 4.19 s, 22.6 s, 0.456 s
9. 33, 0 g
10. a) 9,67 L; B) A nyersolaj kevésbé sűrű, mint a víz, így a víz tetején lebeg, ezáltal kitéve a levegőben lévő oxigénnek, amelyet éget. Továbbá, ha a víz az olaj alatt van, kevésbé hatékony az olaj által termelt hő elnyelésében.
12. a) 319 kcal; b) 2, 00 ºC
14. 20, 6 ºC
16. 4, 38 kg
18. (a) 1,57 × 104 kcal; (b) 18,3 kW ⋅ h; (c) 1,29 × 104 kcal
- a normál olvadási és forráspontú hőmérsékleten standard légköri nyomáson (1 atm) megadott értékek. ↵
- A 37.0 ° c-on (testhőmérséklet), a hő párolgás Lv a víz 2430 kJ/kg, illetve 580 kcal/kg ↵
- A 37.0 ° c-on (testhőmérséklet), a hő párolgás Lv a víz 2430 kJ/kg, illetve 580 kcal/kg ↵