mi az ionos kötés?
kémiai kötések akkor alakulnak ki, amikor a ragasztott atomok teljes energiája alacsonyabb, mint a különálló atomok teljes energiája.A kötés formáját az elektron elrendezése határozza meg, amely minimalizálja az energiát.
bizonyos esetekben az elektronok meg vannak osztva az atomok között – ezt kovalens kötésnek nevezik.
más esetekben egy vagy több elektron teljes átvitele az egyik atomról a másikra.Az atom, amely elveszíti az elektronokat, pozitív töltésű ionvá válik.Az elektronokat fogadó atom negatív töltésű ionvá válik.
Ez Ionos kötéshez vezet – a pozitív és negatív kölcsönös elektrosztatikus vonzereje charges.In legtisztább formája, az ionos kötés nem irányított. Ez lehet tekinteni, mint egyszerű Coulombic vonzás pont díjak között.Ez különbözik a kovalens kötéstől, amelyben az elektronok megosztása irányított kötéseket eredményez.
Elektron Transzfer
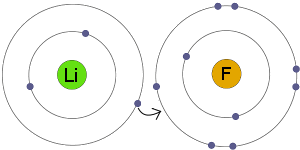
Li transzferek elektron F. az eredmény Az, hogy mind a keletkező ionok válnak elektromosan feltöltődött teljes, stabil elektron héjak.
elektrosztatikus vonzerő
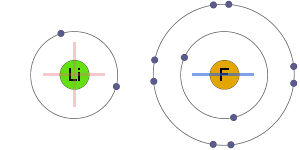
a pozitív és negatív ionok elektrosztatikusan vonzódnak egymáshoz, ami ionos kötést eredményez.
a coulombikus erőnek nincs előnyben részesített iránya, aminek következtében az ionos vegyületek általában az ionok óriási kristályrácsszerkezeteként léteznek.
lítium-fluorid kristályrácsának mintája

Elektronegativitás és ionos kötés
két elem hajlamos ionikusan kötődni, ha elektronegativitásban széles körben különböznek egymástól.
periódusos Elektronegativitás
minél világosabb a zöld árnyalat, annál nagyobb az elektronegativitás. A szürke azt jelenti, hogy nincs ismert érték. (Kattintson a képre a nagyobb nézetért.)

kovalens kötési karakter
abszolút tiszta ionikusan kötődő vegyületek nem léteznek, mivel a pozitív töltésű ion polarizálja a negatív ion elektronfelhőjét.Ez különösen akkor észrevehető, ha kis, nagy töltésű fémionokkal, például Al3+ – tal foglalkozik, bár a polarizáló hatás bizonyos mértékig jelen van minden Ionos vegyületben.A polarizáció hatékonyan irányított, elektron megosztó hatás, ezért kis mennyiségű kovalenciát vezet be az ionos vegyületekben.
az ionos/kovalens viselkedés aránya egy kötésben nagyon durván értékelhető az elektronegativitás Pauling skálájával.Linus Pauling becslése szerint az elemek közötti 1,7-es elektronegativitási különbség 50 százalékos Ionos kötéshez vezet.
az 1 alatti értékek kovalens kötésnek felelnek meg, a 2 feletti értékek pedig Ionos kötésnek dominálnak.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
a 0,35-ös különbséggel rendelkező C-H kötés kovalens, míg a 2,23-as NaCl kötés Ionos lesz.A 0,96-os HCl kötés poláris kovalens lesz,a LiI kötés pedig 1,68-nál 50/50 Ionos/kovalens.
a legnagyobb elektronegativitási különbség 3,19, a cézium (0,79) és a fluor (3,98) között. A kapott kötés körülbelül 95 százalékos Ionos jellegű.
