az Antiaromatikus vegyületek szokatlanul instabilak
melyek azok a kulcsfontosságú tényezők, amelyek meghatározzák, hogy egy molekula antiaromatikus-e?
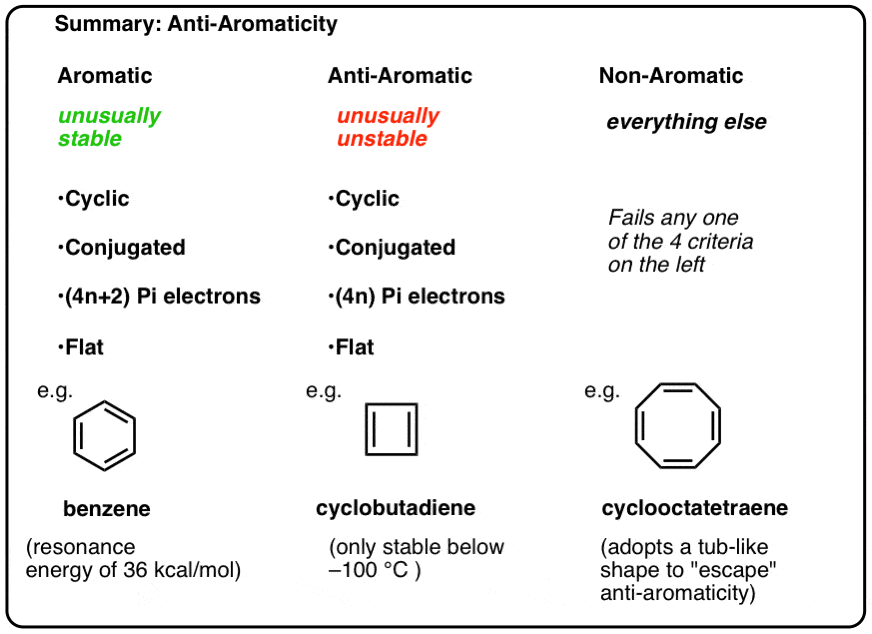
az aromaticity sorozatunk korábbi hozzászólásainkban láttuk, hogy az aromás molekulák szokatlanul stabilak. Különösen nagy rezonancia energiájuk van, inkább helyettesítésen mennek keresztül, mint additív reakciókon, és delokalizált pi elektronokkal rendelkeznek (például a benzol Összes C-C kötési hossza egyenlő).
ahhoz, hogy aromás legyen, a molekulának a következő négy szerkezeti jellemzővel kell rendelkeznie:
- ciklikus
- a gyűrű körül konjugált
- pi elektronok
ík (sík)
Ha ez a négy feltétel teljesül, a molekula aromás.
Ha még egy kérdést is feltesz a teszten, akkor nem aromás.
Ez elég egyértelműnek tűnik. Vagy mégis?
lehet kitalálni, ahogy én keretezés ezt a kérdést, hogy a válasz “nem egészen”. :–)
Tartalomjegyzék
- egyes molekulák olyan látványosan és szokatlanul instabilak és nehezen izolálhatók, hogy megérdemlik a saját kategóriájukat: Antiaromatic
- Ciklopentadienil kation: a “rezonancia-stabilizált” Karbokáció, amely nem stabil
- Antiaromatikus háromtagú Gyűrűk: Oxirén, 1h-Azirén, Tiirén
- a Ciklobutadién Antiaromatikus
- egy Antiaromatikus vegyület 8 pi-elektron példája: Pentalene
- mi teszi a molekulát Anti-aromás?
- a Ciklooktatetraén a Laposságból való Kiforgatással” menekül ” az Aromátlanság ellen
- következtetés: Antiaromatikus vegyületek
- Megjegyzések
- haladó: referenciák és további olvasmányok
1. Látványosan instabil molekulák, amelyek egy kategóriát alkotnak maguknak:”Anti-aromás”
itt van a dolog. Van egy kis számú molekula, hogy flunk a aromaticity teszt, amelyek nem csak nem aromás: az a tulajdonságuk, hogy olyan látványosan, szokatlanul instabilak és nehezen elkülöníthetők, hogy más nevet érdemelnek.
ezeket a molekulákat “anti-aromás” – nak nevezzük.
ami érdekes, hogy sok esetben maguk a molekulák nem tűnnek különösebben instabilnak az első elvektől, ellentétben például a kubánnal. Elég vicces, hogy Cubane-t (többé-kevésbé) vásárolhat Aldrich-től, de az alábbiakban tárgyalt anti-aromás molekulák többsége csak rendkívül alacsony hőmérsékleten stabil – ha egyáltalán el lehet különíteni őket!
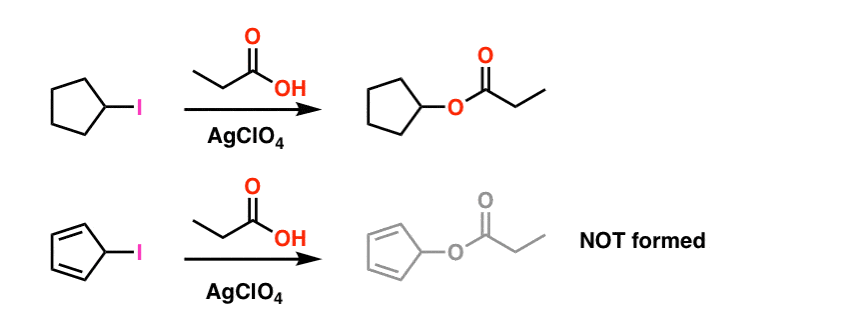
2. Ciklopentadienil Kation: A “rezonancia-stabilizált” Karbokáció, amely nem stabil
kezdjük utunkat a nyúl lyukon egy egyszerű példával, amely az első félévi szerves kémiából ismerősnek tűnik.
emlékszik az SN1 reakcióra? A macska, amely először elhagyja a kényelmes széket?
gyors áttekintés: kezdje egy alkil-haliddal. A csoport elhagyása elhagyja a karbokációt. Nukleofil támadások. Ezt SN1-nek hívják, mert a sebesség-meghatározó lépés (karbokációképződés) unimolekuláris. A lényeg: minél stabilabb a karbokáció,annál gyorsabb a reakció. Ezért az alkil-halidok reakciósebessége tercier > másodlagos > elsődleges, és a karbokáció különleges bónuszpontokat kap, ha rezonanciával stabilizálódik.
nézze meg ezt a két SN1 reakciót. Ön szerint melyik lenne gyorsabb – az SN1 reakció, amely egy másodlagos karbokáción (a) megy keresztül, vagy az SN1 reakció, amely egy másodlagos karbokáción megy keresztül, és több rezonancia formát képezhet (B)?
mindentől, amit eddig megtanultál, azt várnád, hogy a válasz B) legyen.
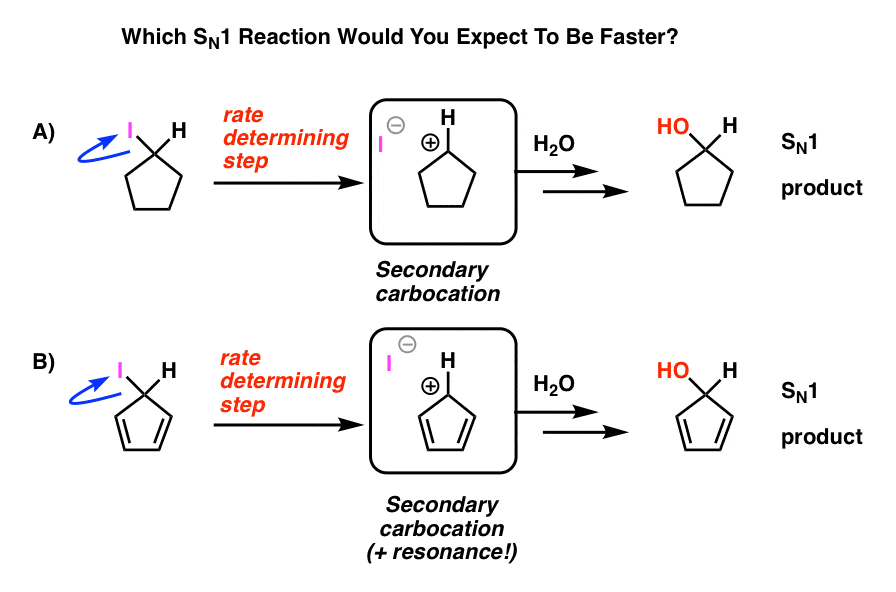
ez nem.
a válasz az, hogy a reakció a) gyorsabban történik. A B reakció egyáltalán nem történik meg.
ennek mélyen furcsanak kell lennie.
Ez!
hogyan lehet, hogy ez az állítólag rezonancia-stabilizált karbokáció kevésbé stabil, mint egy másodlagos karbokáció?
végül is hányszor fúrják a fejébe, hogy a rezonancia stabilizálja a molekulákat, különösen a karbokációkat?
de itt úgy tűnik, hogy destabilizálódik. Ez … ez … ez …

de instabil! A ciklopentadienil kation hihetetlenül instabil és nehezen elkészíthető-és nem a próbálkozás hiánya miatt. Van valami nagyon furcsa a ciklopentadienil kation szerkezetében, ami szokatlan instabilitást ad.

ciklikus, konjugált, lapos…. és 4 pi elektronja van. Érdekes!
3. Antiaromatikus háromtagú Gyűrűk: Oxirén, 1h-Azirén, Thirene
a “megfoghatatlan” molekulák egy másik osztálya a háromtagú gyűrűk családja. Az Org 1-ből emlékeztethet arra, hogy könnyű epoxidokat készíteni alkénekből oxidálószer, például m-CPBA segítségével.
gondolkodtál már azon, hogy miért nem fedtük le ugyanazt a reakciót az alkinokra?
Nos, ez nem a próbálkozás hiánya. A vegyészek mindenféle módszert kipróbáltak az alkinek epoxidálására, és tudod mit? A reakció egyszerűen nem működik.
például az acetilén epoxidációja adja az alábbi molekulát (oxirén).
maga az Oxirén soha nem volt megfigyelhető, bár átmeneti létezésének kínzó nyomai vannak. Egyébként sem a nitrogénanalóg, sem az 1H-azirén, sem a tiirén.
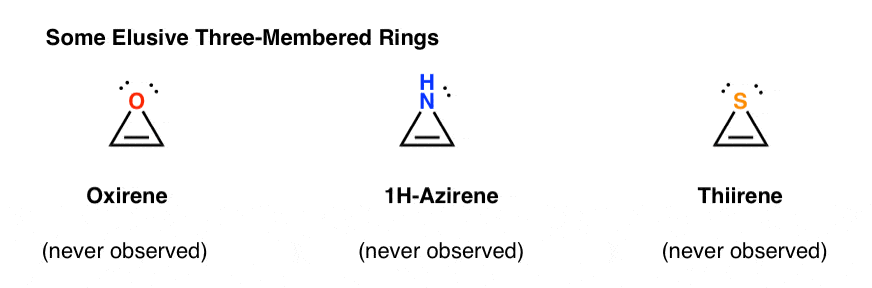
miért ne? Mi a különleges ezekben az esetekben?
lehet, hogy észre, hogy, mint a ciklopentadienil kation, ezek a molekulák ciklikus, konjugált, lapos, és van 4 pi elektronok (kettő a PI kötés, és kettő egy magányos pár).
OK. Mi lehet még ciklikus, konjugált, lapos, és van 4 pi elektron?
4. A ciklobutadién Antiaromatikus
a Ciklobutadién elég egyszerű molekulának tűnik, de valójában csak 1965-ben szintetizálták. Még akkor is azt találták,hogy 35 Kelvin feletti hőmérsékleten nem stabil.
a kérdés az, miért?

persze, ez egy négytagú gyűrű, és igen, sok gyűrűtörzs van, de több feszült molekulát készítettek, amelyek szobahőmérsékleten stabilak.
azt is megjegyezhetjük, hogy a fenti példákhoz hasonlóan a ciklobutadién egy másik példa egy ciklikus, konjugált molekulára, amelynek 4 pi-elektronja van, és lapos.
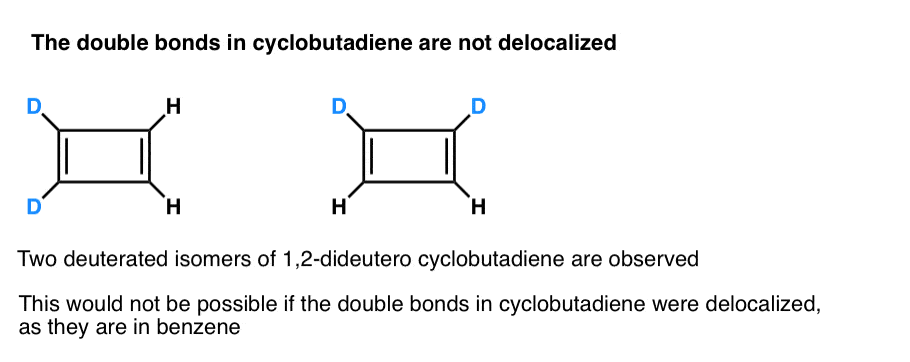
ami még érdekesebb, hogy mit tanult a ciklobutadién geometriájáról. Ahelyett, hogy azonos kötéshosszúságú molekula (például benzol) lenne, a ciklobutadién téglalap alakú volt, jelezve, hogy az elektronokat nem delokalizálták.
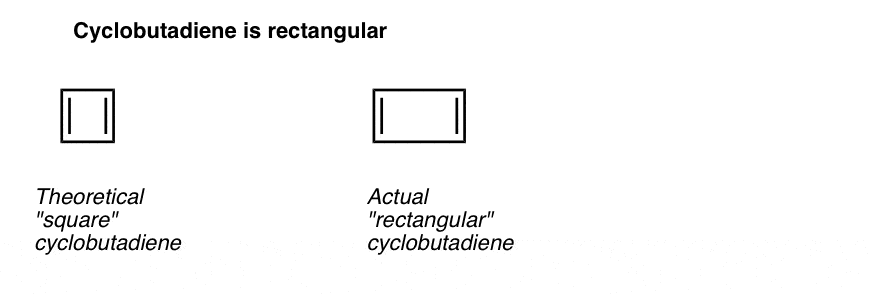
Ez azt mondja nekünk, hogy még akkor is, ha egy molekula teljesíti az összes feltételt (ciklikus, konjugált, lapos, 4 pi elektronok), a szimmetrikus geometria különösen instabil. . Nagyon érdekes!
egy 8 pi-elektron példa egy Antiaromatikus vegyületre: Pentalén
eddig az összes példa, amelyet eddig láttunk, 4 pi elektronokkal rendelkezett. Lehet, hogy kíváncsi: vannak-e példák az aromás molekulák ellen, amelyek több mint 4 pi elektronokkal rendelkeznek? Miért, igen.
az alábbi molekulát “Pentalénnek”nevezik. Szintetizálták, de csak stabil -100 °C alatt.ezen hőmérséklet felett kombinálódik egy másik molekulával (referencia). Egy másik példa a látványos instabilitásra.

a Pentalén 8 pi elektronral rendelkezik. Ez beindíthat néhány riasztási harangot az elismerésről. Ne feledje, hogy az aromás molekulákban a PI-elektronok száma követte a szekvenciát (2, 6, 10, 14….) ?
Ez a példa arra utal, hogy az anti-aromás molekulákban a PI elektronok száma követi a szekvenciát (4, 8, 12…)
mi teszi a molekulát Anti-aromás?
tehát mi a közös ezekben a molekulákban ebben a tolvajok galériájában?
mindegyik ciklikus, konjugált és lapos-és ha a PI elektronok számát számoljuk, akkor a 4 többszöröse. Tehát míg az aromás molekulák (4N+2) pi elektronokkal rendelkeznek, az anti aromás molekulák “szabálya” (4N). (egy másik módja annak, hogy megnézzük: a PI elektronok száma kétszer páros szám lesz).
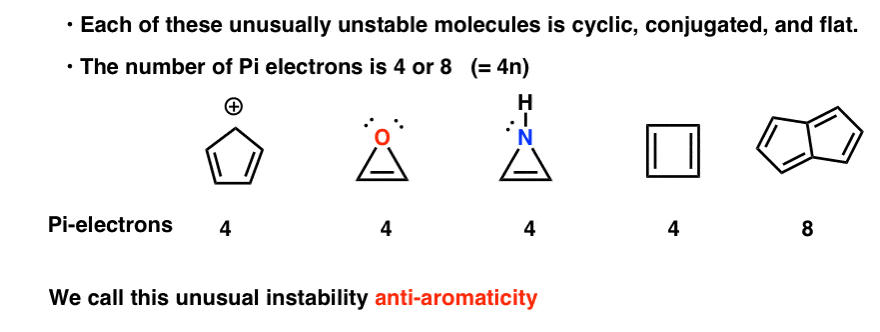
ezt a szokatlan instabilitást “aromátlanságnak”nevezik.
Ez azt jelenti, hogy most már készítenie három kategóriában molekulák, a következő kritériumok szerint:
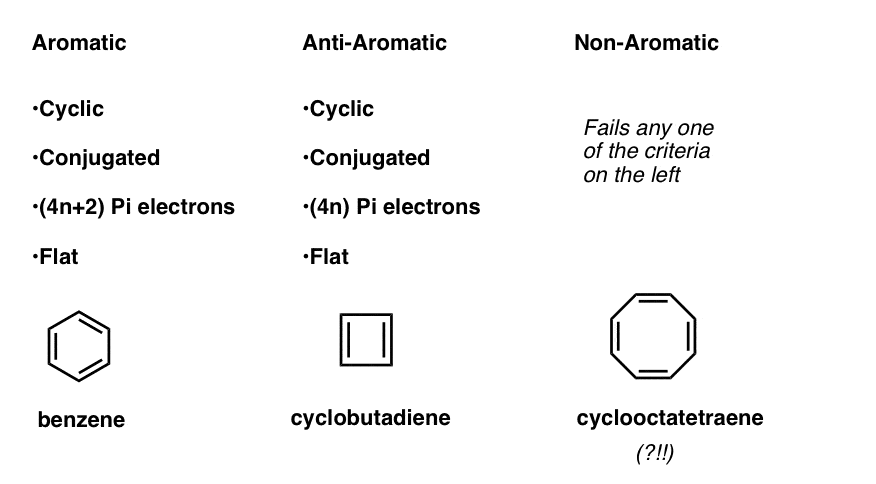
- Aromás molekulák ciklikus, konjugált, van (4n+2) pi elektronok, majd lapos.
- az antiaromatikus molekulák ciklikusak, konjugáltak, (4n) pi elektronokkal rendelkeznek, és laposak.
- a nem aromás molekulák minden más molekula, amely ezen állapotok egyikét meghiúsítja.
várjon egy másodpercet-kíváncsi lehet, hogy a ciklooktatetraén miért minősül “nem aromás”-nak. 8 pi elektronokkal (kétszer páros szám) nem kellene “anti-aromás”?
Cyclooctatetraene “menekül” Anti-Aromaticity keresztül csavaró ki laposság
Gondolj feltételeinek teljesítése “anti-aromaticity”, mint egy kicsit, mint jogosult egy rendkívül bünteti jövedelemadó. Tekintettel arra, hogy megtalálja a kiskaput, hogy kilépjen az adóból, megtenné? Valószínűleg.
a Ciklooktatetraén csak akkor aromás, ha lapos. A ciklooktatetraén viszonylag “Hajlékony” szerkezete azonban bizonyos rugalmasságot tesz lehetővé. A kötvények lehet forgatni távol a sík olyan, hogy a molekula fogad el, a “kád -, mint a” forma, ezáltal elkerülve a “antiaromaticity adó” 18 12 kcal/mol fizetendő, ha a p-elektronpályák a molekula volt konjugált egymással.
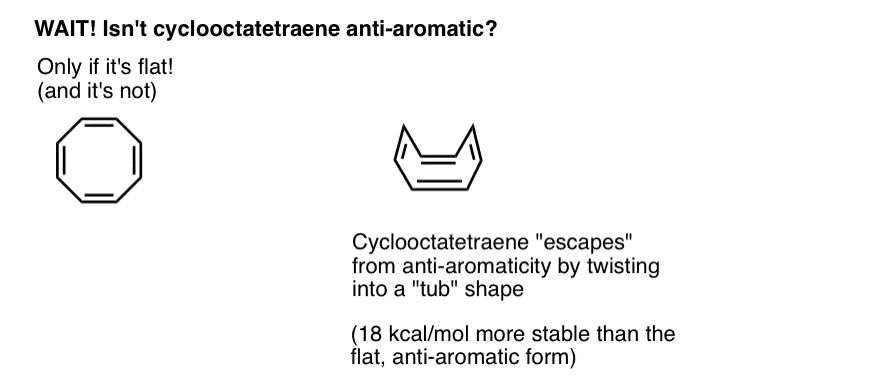
kiderül, hogy ciklooktatetraén szintetizált, stabil (lehet kapni itt, például), és úgy viselkedik, mint egy “normális” alkén, megy kívül reakciók, hidrogénezés, és így tovább.
Pentalén (fent), amely szintén 8 pi-elektronokkal rendelkezik, nagyon merev biciklusos szerkezettel rendelkezik, amely megakadályozza a kötés-forgást a síkságtól. Ezért beragadt az aromás konformációjába.
a 8 pi-nál nagyobb elektronokkal rendelkező molekulák aromátlansága ismert, de nagyon szokatlan. (Itt egy szórakoztató példa egy másik” menekülésre ” az aromátságtól egy 18 pi elektronokkal rendelkező molekula számára.)
következtetés: Antiaromatikus vegyületek
az aromaticitás és az aromaticitás elleni kezelésünk eddig tisztán leíró és empirikus volt. Sok példát mutattunk be, és sok szabályt is figyelembe vettünk, de a vitából hiányzott minden mély magyarázat a “miért” – ra.
mi olyan különleges a benzolgyűrűben, ami annyira stabil? Miért stabil?
mi olyan különleges a ciklobutadién rendszerben, ami annyira instabillá teszi. Miért instabil?
ezeknek a mélyebb kérdéseknek a megválaszolásához vissza kell lépnünk, és meg kell vizsgálnunk e két molekula molekuláris pályáit, majd mélyebben meg kell értenünk az aromát és az aromát.
ezt fogjuk tenni a következő bejegyzésben.
köszönet Matthew Knowe-nak a bejegyzés előkészítéséhez.
Megjegyzések
1. lábjegyzet. Az egyszerűség kedvéért a fő cikkben látható kép a tényleges reakcióviszonyokról szól. A tényleges kísérleti körülményeket az alábbiakban mutatjuk be. Az oldószer propionsav, a Lewis-sav ezüst-perklorátot pedig a jód levételéhez adják. .
még ilyen körülmények között sem alakul ki a ciklopentadienil-karbokáció, amely szélsőséges instabilitásának bizonyítéka.
2.lábjegyzet. Az etén (más néven etilén) epoxidációját évente 15 millió tonna mennyiségben végezzük. Az acetilén oxirén képződéséhez való epoxidációja nem ismert.
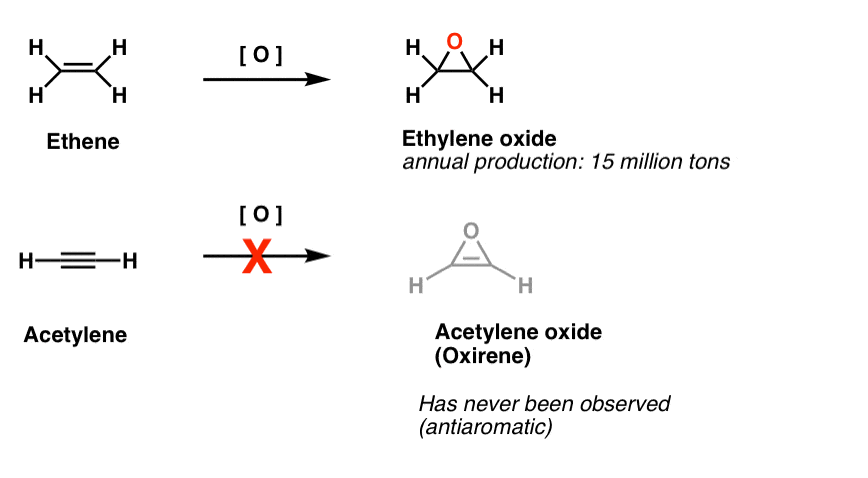
Az oxirén létezésének Átmeneti bizonyítékait találták. Az izotóp címkézési vizsgálatokból jó bizonyíték van arra, hogy az oxirének bizonyos Wolff-átrendeződésekben átmeneti intermedierek. Két példa van az oxirénekre is, amelyek rendkívül alacsony hőmérsékleten csapdába estek, de 35 Kelvin felett lebomlottak.
az 1H-azirin átmeneti létezését egy acetilénhez adott nitrén hozzáadásával posztulálták, amely gyorsan átrendeződik a (stabil) 2H-azirénre (lent).
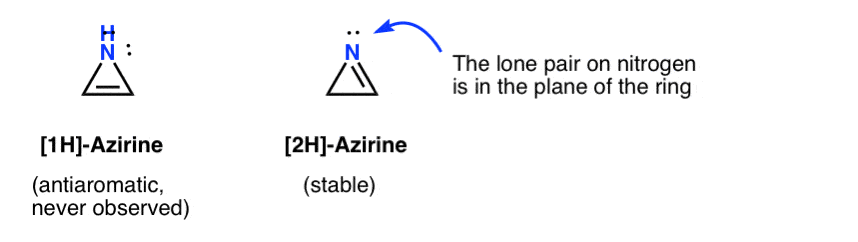
megjegyezzük, hogy a 2H-azirene a magányos pár a nitrogén derékszögben a PI rendszer, így ez a rendszer nem aromás, szemben anti-aromás.
további információkért lásd március fejlett szerves kémiáját. Az 5.kiadás 62-63. oldalán dolgozom.
. 3. lábjegyzet. Egy nagyon okos kísérlet megállapította, hogy az 1,2-dideutero ciklobutadiénnek két izomere van, nem egy (lásd alább). Ez azt jelzi, hogy a ciklobutadién kettős kötései nem delokalizáltak, mivel benzolban vannak, hanem inkább kettős kötések egy hagyományos diénben.
a Ciklobutadién 35 K-On reagál önmagával, hogy” dimer ” – et képezzen, egy Diels-Alder reakció példáján.
4. lábjegyzet. Igen, igaz, hogy az azirén magányos párja sp3 hibrid orbitális pályára helyezhető (lent). Ez valószínűleg kissé csökkenti az aromás “büntetést”, de a molekula még mindig hihetetlenül instabil. Az aromátlanság elleni küzdelem a legegyszerűbb módja ennek.

5. A téglalap alakú geometria a Jahn-Teller-effektus néven ismert hatás következménye. Emlékszel a Pauli kizárási elvre, ahol az elektronok nem rendelkezhetnek azonos kvantumszámmal? Nos, amint a ciklobutadién molekuláris orbitális diagramját nézzük ,a” négyzet “ciklobutadiénnek két” degenerált ” elektronja van, azaz ugyanazok az energiák és kvantumszámok. Ez egy “Pauli repulzió” néven ismert jelenséghez vezet, ahol a kötések megnyúlása addig történik, amíg a két elektron energiaszintje meg nem differenciálódik. Határozottan egy fejlett téma.
(Advanced) References and Further Reading
- Transition-State Spectroscopy of Cyclooctatetraene
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
tudomány, 1996, 272, 1456-1459.
DOI: 10.1126 / tudomány.272.5267.1456
Ez a tanulmány az alapja annak a kijelentésnek, hogy a ciklooktatetraén nem aromás földi állapota 12 kcal/mol az “antiaromatikus” konformáció alatt. - The Taming of Cyclobutadiene
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
a Nobel-díjas Prof. Donald J. Cram (UCLA) tanulmánya leírja a ciklobutadién első spektroszkópos jellemzését. Ezt úgy végezzük, hogy a prekurzort egy hemicarcerandba (ketrec komplex) helyezzük, majd UV-fénnyel besugározzuk, ezáltal ciklobutadiént hozunk létre, amely nem képes semmit tenni, mivel csapdába esik. - Cyclobutadiene
Thomas Bally, Satoru Masamune
tetraéder 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
Ez a cikk 1980-tól a cyclobutadiene-en addig végzett felülvizsgálatok. Ez 2 részre oszlik-kísérleti szintetikus erőfeszítések és elméleti számítások. - Tetrahedrán és Ciklobutadién
Günther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
Ez a tanulmány áttekinti a tetraéder és a ciklobutadién szintetikus erőfeszítéseit – mindkét molekula c4h4 képlettel rendelkezik. Eddig csak a szubsztituált (tetra t-butil és tetra trimetilszilil) tetraédereket sikerült szintetizálni és izolálni. - Ciklobutadién – és Benzociklobutadién-vas-Trikarbonil komplexek
F. Emerson, L. Watts és R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - li > Ciklobutadieneiron Trikarbonil. Egy új aromás rendszer
D. Fitzpatrick, L. Watts, G. F. Emerson, and R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
bónusz téma: a ciklobutadién fémekkel stabilizálható – az organometallikus komplex ciklobutadién vas-trikarbonil stabil, kristályos szilárd anyag. Amint a szerzők megemlítik, nem valószínű, hogy szabad ciklobutadién keletkezik a szintézisben. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
az antipszichotikus olanzapin a ciklooktatetraénhez hasonló antiaromatikus hatások elkerülése érdekében “pillangó” alakot alkalmaz. Ez nyilvánvalóan kritikus a funkciója szempontjából. - Antiaromaticity
Ronald Breslow
Fiókok Kémiai Kutatás 1973, 6 (12), 393-398
DOI: 1021/ar50072a001
Érdekes módon, Prof. Breslow (Columbia) tagállamok ezen a számlán, hogy ő volt az, aki először azt sugallják, hogy a kifejezés “antiaromatic” a különösen bomlasztotta ciklikus vegyületek 4n o elektronok. Idéz még Prof. M. J. S. Dewar és mások más munkáit is, ahol a ciklobutadién antiaromatikus destabilizációja a lineáris butadiénhez képest 18-33 kcal/mol között van. - a Ciklobutadién Antiaromaticitásának kísérleti meghatározása
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
tudomány 1999, 286 (5442), 1119-1122
DOI: 1126/tudomány.286.5442.1119
Ez egy nagyon szigorú papír, amely új spektroszkópiai technikákat alkalmaz a ciklobutadién antiaromatikus destabilizációjának meghatározására. Egy hipotetikus törzs nélküli, konjugált dién referenciához képest a ciklobutadiént összesen 87 kcal/mol destabilizálja, ebből 32 kcal/mol a gyűrűs törzsnek, 55 kcal/mol pedig az antiaromaticitásnak tulajdonítható (összehasonlítva a benzol aromás stabilizálására szolgáló 21 kcal/mol-val). - Nem cyclopentadienyl kation, egy föld-állami triplett
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ‘ neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
DOI: 10.1021 / ja00790a049
a ciklopentadienil kation csak nehezen készíthető el, ahogy ez a tanulmány leírja. Miután létrejött, triplett elektronikus földállapotú (2 párosítatlan elektronnal), amelyet EPR (elektron paramágneses rezonancia) spektroszkópiával lehet jellemezni. - Oxirenes
Errol G. Lewars
Chemical Reviews 1983, 83 (5), 519-534
DOI: 10.1021 / cr00057a002