a hidrogén szén-szén kettős kötéshez való hozzáadását hidrogénezésnek nevezzük. Az ilyen kiegészítés általános hatása a kettős kötés funkcionális csoportjának reduktív eltávolítása. A regioszelektivitás nem kérdés, mivel ugyanaz a csoport (hidrogénatom) kötődik az egyes kettős kötésű karbonokhoz. Két hidrogénatom legegyszerűbb forrása a molekuláris hidrogén (H2), de az alkének hidrogénnel való keverése nem eredményez észrevehető reakciót. Bár a teljes hidrogénezési reakció exoterm, a magas aktiválási energia megakadályozza, hogy normális körülmények között megtörténjen. Ezt a korlátozást katalizátor alkalmazásával ki lehet kerülni, amint az az alábbi ábrán látható.
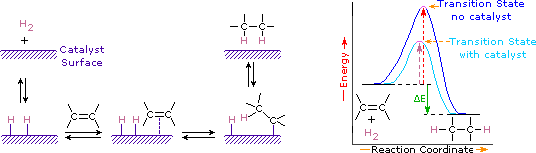
a katalizátorok olyan anyagok, amelyek megváltoztatják a kémiai reakció sebességét (sebességét) anélkül, hogy a termék részeként fogyasztanák vagy megjelennének. A katalizátorok a reakciók aktiválási energiájának csökkentésével hatnak, de nem változtatják meg a reagensek és termékek relatív potenciális energiáját. A legszélesebb körben használt hidrogénező katalizátorok közé tartoznak a finomra osztott fémek, mint például a platina, a palládium és a nikkel. A katalitikus hidrogénezés legalább két szakaszban történik, az ábrán látható módon. Először az alként adszorbeálni kell a katalizátor felületén, néhány hidrogénnel együtt. Ezután két hidrogén eltolódik a fémfelületről a kettős kötés szénére, a kapott telített szénhidrogén, amely gyengébben adszorbeálódik, elhagyja a katalizátor felületét. Az utolsó események pontos jellege és időzítése nem tisztázott.
amint az az energiagazdálkodási ábrán látható, az alkének hidrogénezése exoterm, a hő pedig az ábrán látható ΔE (zöld színű) értéknek megfelelően szabadul fel. Ez a reakcióhő felhasználható azon alkének termodinamikai stabilitásának értékelésére, amelyek különböző számú alkil-szubsztituenst tartalmaznak a kettős kötésen. Például az alábbi táblázat három C5H10 alkén hidrogénezésének melegítését sorolja fel, amelyek ugyanazt az alkánterméket (2-metil-bután) adják. Mivel a reakció nagy hője nagy energiájú reagenst jelez, ezek a melegítések fordítottan arányosak az alkén-izomerek stabilitásával. Egy durva közelítés, azt látjuk, hogy minden alkil szubsztituens egy kettős kötés stabilizálja ezt a funkcionális csoport egy kicsit több, mint 1 kcal/MOL.
| Alkén Izomer | (CH3)2CHCH=CH2 3-metil-1-butene |
CH2=C(CH3)CH2CH3 2-metil-1-butene |
(CH3)2C=CHCH3 2-metil-2-buten |
|---|---|---|---|
| Hő Reakció ( ΔHº ) |
-30.3 kcal/mól | -28.5 kcal/mól | -26.9 kcal/mól |
a mechanizmus itt látható számíthatunk, a mellett a hidrogén előfordulása a syn-stereoselectivity. Ez gyakran igaz, de a hidrogénező katalizátorok a kettős kötés izomerizációját is okozhatják a hidrogén hozzáadása előtt, ebben az esetben a sztereoszelektivitás bizonytalan lehet.
az alkénekkel történő átmeneti fémkomplexek kialakulását meggyőzően igazolták olyan stabil platinakomplexek izolálásával, mint a Zeise sója, K. H2O, és az etilén-bisz(trifenilfoszfin)platina, 2pt(H2C=CH2). Utóbbiban a platina háromkoordinátás és nulla-Valens, míg a Zeise sója a platina(II) származéka. A Zeise sójának modelljét és az ilyen komplexumok szokatlan kötődésének megvitatását ide kattintva tekintheti meg. Hasonló komplexekről számoltak be a nikkel és a palládium, valamint az alkénhidrogénezés katalizátoraként is funkcionáló fémek esetében.
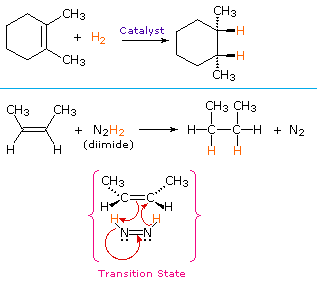
nem katalitikus eljárás a hidrogén szin-hozzáadásával az instabil vegyület diimid, N2H2. Ezt a reagenst frissen kell előállítani a reakciórendszerben, általában hidrazin oxidációjával, az erősen exoterm reakciót pedig A nitrogéngáz (egy nagyon stabil vegyület) eltávolítása támogatja. Diimid létezhet cisz-transz izomerként; csak a cisz-izomer szolgál redukálószerként. Az alábbiakban bemutatjuk az alkén mindkét eljárással történő csökkentésére vonatkozó példákat.
- William Reusch, Professor Emeritus (Michigan State U.), Virtual tankönyv of Organic Chemistry