időszakos tendenciák és oldószerhatások a nukleofilitásban
a nukleofilitásban kiszámítható időszakos tendenciák vannak. A táblázat második sorában vízszintesen haladva a nukleofilitás tendenciája párhuzamba állítja a bázikusság tendenciáját:
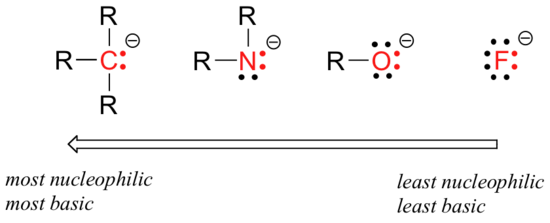
a horizontális nukleofilitási trend mögött meghúzódó érvelés megegyezik a bázikus trend mögött meghúzódó érveléssel: több elektronegatív elem szorosabban tartja az elektronokat, és kevésbé képes új kötés kialakítására.
ez a horizontális tendencia azt is mondja, hogy az aminok nukleofilebbek, mint az alkoholok, bár mindkét csoport általában nukleofilként működik mind laboratóriumi, mind biokémiai reakciókban.
emlékezzünk arra, hogy az atomok alapossága csökken, Amikor függőlegesen lefelé haladunk a periódusos oszlopon: a tiolátionok kevésbé bázikusak, mint például az alkoxidionok, a bromidion pedig kevésbé bázikus, mint a kloridion, ami viszont kevésbé bázikus, mint a fluoridion. Emlékezzünk arra is, hogy ez a tendencia azzal magyarázható, hogy figyelembe vesszük az “elektronfelhő” növekvő méretét a nagyobb ionok körül: a negatív töltésben rejlő elektronsűrűség nagyobb területre terjed, ami növeli a stabilitást (és ezáltal csökkenti a bázikusságot).
a nukleofilitás függőleges időszakos tendenciája valamivel bonyolultabb, mint a bázikusság esetében: attól függően, hogy az oldószer, hogy a reakció zajlik, a nukleofilitás trend mehet mindkét irányba. Vegyük az alábbi SN2 reakció egyszerű példáját:
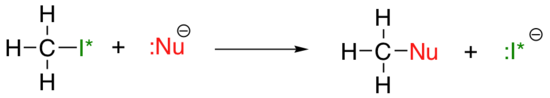
. . .ahol a Nu-az egyik halidion: fluorid, klorid, bromid vagy jodid, és a kilépő i* csoport a jód radioaktív izotópja (amely lehetővé teszi számunkra, hogy megkülönböztessük a kilépő csoportot a nukleofiltól abban az esetben, ha mindkettő jodid). Ha ez a reakció protikus oldószerben fordul elő (azaz olyan oldószerben, amelynek hidrogénje oxigénhez vagy nitrogénhez kötődik – víz, metanol és etanol a legfontosabb példák), akkor a reakció akkor megy a leggyorsabban, ha a jodid a nukleofil, és a leglassabb, ha a fluorid a nukleofil, ami tükrözi a nukleofil relatív szilárdságát.

relatív nukleofilitás protikus oldószerben
Ez természetesen ellentétes a bazicitás függőleges periodikus trendjével, ahol a jodid a legkevésbé alapvető. Mi folyik itt? Nem kellene az erősebb bázisnak, a reaktív, nem kötődő valenciaelektronokkal, az erősebb nukleofilnak is lennie?
mint már említettük, mindennek köze van az oldószerhez. Ne feledje, most a protikus oldószerben, például etanolban futó reakcióról beszélünk. A protikus oldószermolekulák nagyon erős ion-dipól kölcsönhatásokat képeznek a negatív töltésű nukleofilokkal, lényegében “oldószeres ketrecet” hoznak létre a nukleofil körül:

annak érdekében, hogy a nukleofil megtámadja az elektrofilt, legalább részben meg kell szabadulnia az oldószeres ketrecéből. A magányos pár elektronok a nagyobb, kevésbé bázikus jodid ion kölcsönhatásba kevésbé szorosan a protonok a protikus oldószer molekulák-így a jodid nukleofil jobban képes kitörni az oldószer ketrec képest a kisebb, több alapvető fluorid ion, amelynek magányos pár elektronok vannak kötve szorosabban a protonok a ketrec.
a kép megváltozik, ha poláris aprotikus oldószerre, például acetonra váltunk, amelyben molekuláris dipól van, de nincs oxigénhez vagy nitrogénhez kötött hidrogén. A fluorid a legjobb nukleofil, a jodid pedig a leggyengébb.
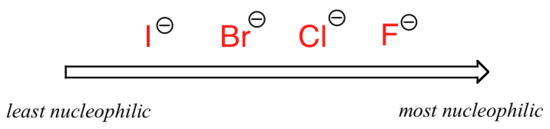
relatív nukleofilitás poláris aprotikus oldószerben
a megfordítás oka az, hogy aprotikus oldószerrel az oldószer és az oldószer közötti ion-dipol kölcsönhatások a nukleofil sokkal gyengébb: az oldószer dipóljának pozitív vége el van rejtve a molekula belsejében, így árnyékolva van a nukleofil negatív töltésétől.
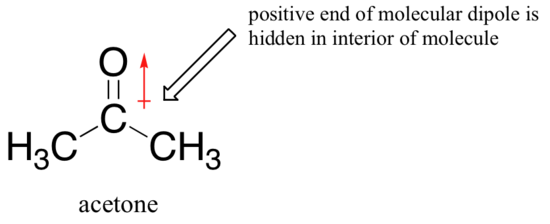
a gyengébb oldószer-nukleofil kölcsönhatás gyengébb oldószeres sejtet jelent a nukleofil áttöréséhez, így az oldószer hatása sokkal kevésbé fontos,és a több alapvető fluorid ion is a jobb nukleofil.
miért nem használ ehhez a reakcióhoz teljesen nem poláris oldószert, például hexánt, hogy az oldószer ketrec teljesen eliminálódjon? A válasz erre egyszerű – a nukleofilnak oldatban kell lennie ahhoz, hogy érzékelhető sebességgel reagáljon az elektrofillal, és egy olyan oldószer, mint a hexán, egyáltalán nem oldja meg az a töltött (vagy erősen poláris) nukleofilt. Ezért a vegyészek poláris aprotikus oldószereket használnak a nukleofil szubsztitúciós reakciókhoz a laboratóriumban: elég polárisak ahhoz, hogy megoldják a nukleofilt, de nem annyira polárisak, hogy egy áthatolhatatlan oldószeres ketrecbe zárják. Az aceton mellett három másik általánosan használt poláris aprotikus oldószer az acetonitril, dimetilformamid (DMF) és dimetil-szulfoxid (DMSO).
a biológiai kémiában, ahol az oldószer protikus (víz), a nukleofilitás időszakos tendenciáinak legfontosabb következménye, hogy a tiolok erősebb nukleofilek, mint az alkoholok. A cisztein aminosav tiolcsoportja például egy erős nukleofil, gyakran enzimatikus reakciókban nukleofilként működik, és természetesen a negatív töltésű tiolátok (RS-) még nukleofilabbak. Ez nem azt jelenti, hogy a szerin, a treonin és a tirozin hidroxilcsoportjai nem is nukleofilként működnek – ők.