Video \(\PageIndex{1}\): rövid bevezetés Mendelejev géniuszához.
mivel a korai kémikusok az ércek tisztítására dolgoztak, és több elemet fedeztek fel, rájöttek, hogy a különböző elemeket hasonló kémiai viselkedésük alapján csoportosíthatják. Az egyik ilyen csoport a lítium( Li), a nátrium( Na) és a kálium (k): Ezek az elemek mind fényesek, jól vezetik a hőt és a villamos energiát, és hasonló kémiai tulajdonságokkal rendelkeznek. A második csoportba tartoznak a kalcium (Ca), a stroncium (Sr) és a bárium (Ba), amelyek szintén fényesek, jó hő-és villamosenergia-vezetők, és közös kémiai tulajdonságokkal rendelkeznek. E két csoport sajátos tulajdonságai azonban jelentősen különböznek egymástól. Például: Li, Na és K sokkal reaktívabbak, mint a Ca, Sr és Ba; Li, Na és K vegyületeket alkotnak oxigénnel két atomjuk arányában egy oxigénatomhoz, míg a Ca, Sr és Ba vegyületeket alkotnak, amelyek egyik atomjuk egy oxigénatomhoz kapcsolódik. A fluor (F), a klór( Cl), a bróm (Br) és a jód (I) szintén hasonló tulajdonságokkal rendelkeznek, de ezek a tulajdonságok drasztikusan különböznek a fenti elemek bármelyikétől.
Dimitri Mendelejev Oroszországban (1869) és Lothar Meyer Németországban (1870) önállóan felismerte, hogy az akkoriban ismert elemek tulajdonságai között időszakos kapcsolat van. Mindkét közzétett táblázat a növekvő atomtömeg szerint elrendezett elemekkel. De Mengyelejev ment egy lépéssel tovább, mint Meyer: használta a táblázat megjósolni, hogy létezik olyan elem, ami a hasonló tulajdonságokkal alumínium, szilícium, de voltak még ismeretlen. A gallium (1875) és germánium (1886) felfedezései nagy támogatást nyújtottak Mendelejev munkájához. Bár Mendelejevnek és Meyernek hosszú vitája volt a prioritással kapcsolatban, Mendelejev hozzájárulása a periódusos rendszer fejlesztéséhez ma már szélesebb körben elismert (ábra \(\PageIndex{1}\)).
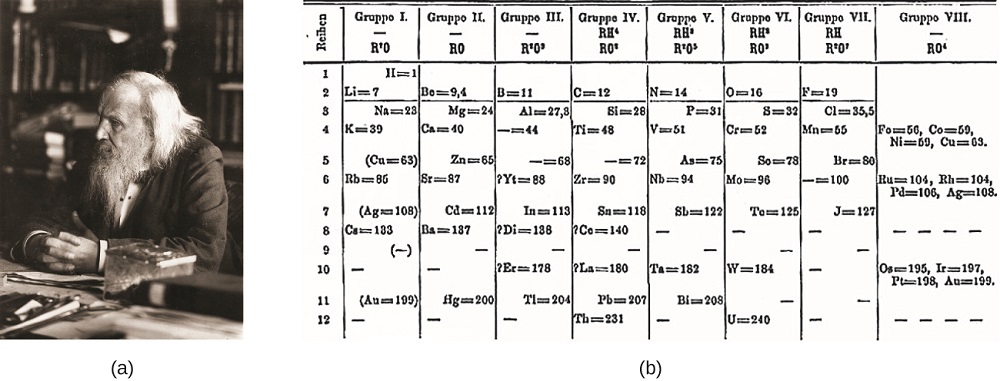
ábra \ (\PageIndex{1}\): a) Dimitri Mendelejevnek széles körben jóvá kell hagynia az elemek első periódusos rendszerének létrehozását (b). (a hitel: Serge Lachinov munkájának módosítása; B hitel: a “Den fjättrade ankan”/Wikimedia Commons munkájának módosítása)
Video \(\PageIndex{2}\): Bevezetés a periódusos rendszer szervezésébe időszakokba és csoportokba. Ez a szervezet fontos lesz, mivel továbbra is a kémia elveire építünk.
a huszadik századra nyilvánvalóvá vált, hogy az időszakos kapcsolat atomszámokat, nem pedig atomtömegeket tartalmaz. Ennek a kapcsolatnak a modern kijelentése, az időszakos törvény a következő: az elemek tulajdonságai atomszámuk periodikus funkciói. Egy modern periódusos rendszer az atomok számának növekvő sorrendjében rendezi az elemeket, és csoportosítja a hasonló tulajdonságokkal rendelkező atomokat ugyanabban a függőleges oszlopban (\(\PageIndex{2}\)). Minden doboz egy elemet ábrázol, és tartalmazza annak atomi számát, szimbólumát, átlagos atomtömegét és (néha) nevét. Az elemek hét vízszintes sorban vannak elrendezve, úgynevezett időszakok vagy sorozatok, valamint 18 függőleges oszlop, úgynevezett csoportok. A csoportokat az egyes oszlopok tetején jelölik. Az Egyesült Államokban a címkék hagyományosan nagybetűkkel ellátott számok voltak. Az IUPAC azonban azt javasolja, hogy az 1-től 18-ig terjedő számokat használják, és ezek a címkék gyakoribbak. Ahhoz, hogy a táblázat egyetlen oldalra illeszkedjen, a sorok két részének, összesen 14 oszlopnak a részeit általában a táblázat fő teste alatt írják.

ábra \(\PageIndex{2}\): A periódusos rendszer elemei tulajdonságaik szerint vannak rendezve.
sok elem drámai módon különbözik kémiai és fizikai tulajdonságaikban, de egyes elemek viselkedésükben hasonlóak. Például sok elem fényesnek tűnik, képlékeny (törés nélkül deformálódhat), gömbgrafitos (vezetékekbe húzható), és jól vezeti a hőt és a villamos energiát. Más elemek nem fényesek, képlékenyek vagy képlékenyek, és rossz hő-és villamosenergia-vezetők. Mi lehet rendezni az elemeket a nagy osztályok közös tulajdonságokkal: Fémek( elemek, amelyek fényes, képlékeny, jó vezetők a hő és a villamos energia-árnyékos sárga); nem fémek( elemek jelennek unalmas, rossz vezetők a hő és a villamos energia-árnyékos zöld); a metalloidok (olyan elemek, amelyek mérsékelten jól vezetik a hőt és a villamos energiát, és rendelkeznek a fémek bizonyos tulajdonságaival, valamint a nem fémek bizonyos tulajdonságaival—árnyékos lila).
elemek is sorolni a fő-csoport elemei (vagy képviselője elemek), az oszlopok jelölése 1, 2, 13-18; az átmeneti fémek az oszlopok jelölt 3-12; valamint belső átmeneti fémek a két sort az alján a táblázat (a felső sorban az elemek neve lantanidák, valamint az alsó sorban az elemek actinides; Ábra a \(\PageIndex{3}\)). Az elemek tovább oszthatók konkrétabb tulajdonságokkal, például az általuk alkotott vegyületek összetételével. Például az 1. csoportba tartozó elemek (az első oszlop) olyan vegyületeket képeznek, amelyek az elem egy atomjából és egy hidrogénatomból állnak. Ezek az elemek (a hidrogén kivételével) alkálifémek, amelyek mindegyike hasonló kémiai tulajdonságokkal rendelkezik. A 2. csoportba tartozó elemek (a második oszlop) az elem egy atomjából és két hidrogénatomból álló vegyületeket alkotnak: ezeket alkáliföldfémeknek nevezik, hasonló tulajdonságokkal a csoport tagjai között. Más konkrét nevekkel rendelkező csoportok a pniktogének (15.csoport), kalcogének (16. csoport), halogének (17. csoport), valamint a nemesgázok (18. csoport, más néven inert gázok). A csoportokra a csoport első eleme is utalhat: például a kalcogéneket oxigéncsoportnak vagy oxigéncsaládnak lehet nevezni. A hidrogén egy egyedülálló, nem fémes elem, amelynek tulajdonságai hasonlóak mind az 1., mind a 17. csoporthoz. Ezért a hidrogén mindkét csoport tetején, vagy önmagában is megjeleníthető.
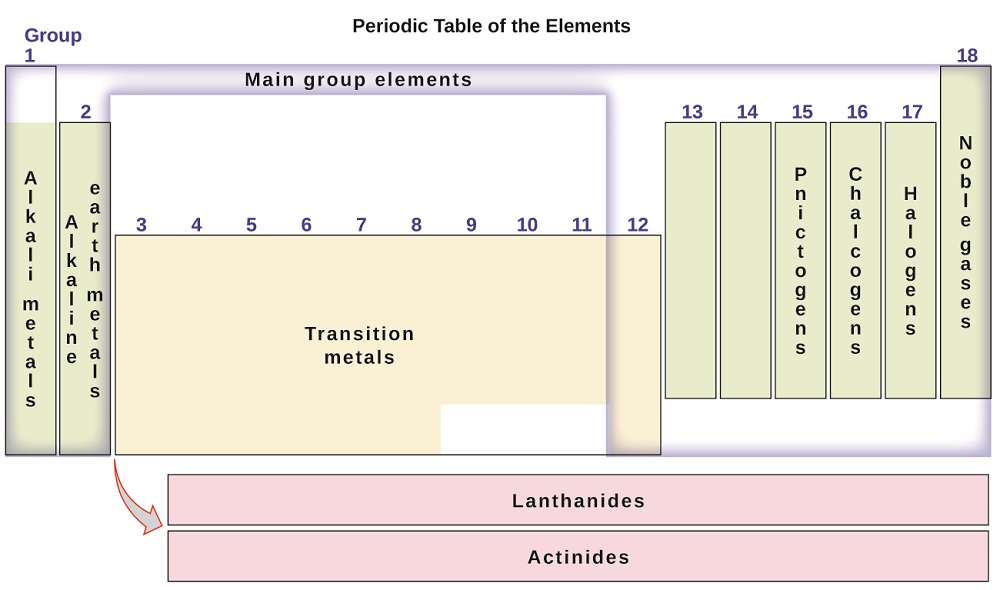
ábra \(\PageIndex{3}\): a periódusos rendszer csoportokba szervezi a hasonló tulajdonságokkal rendelkező elemeket.
példa \ (\PageIndex{1}\): Az elemek elnevezési csoportjai
A következő elemek atomjai nélkülözhetetlenek az élethez. Adja meg a csoport nevét a következő elemekhez:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- kripton
- szelén
- bárium
- lítium
Válasz egy
nemesgáz
Válasz b
chalcogen
Válasz c
alkáli fém
Válasz d
alkáli fém
A tanulás, a periódusos rendszer, lehet, hogy észre valamit az atomi tömegek bizonyos elemeit. A 43-as elem (technécium), a 61-es elem (prométium) és a 84-es (polónium) és a magasabb atomszámú elemek nagy része szögletes zárójelben van megadva. Ez olyan elemekre vonatkozik, amelyek teljes egészében instabil, radioaktív izotópokból állnak (többet megtudhat a radioaktivitásról a nukleáris kémia fejezetben). Ezeknek az elemeknek az átlagos atomtömege nem határozható meg, mivel radioizotópjaik a forrástól függően jelentősen eltérhetnek, vagy a természetben sem létezhetnek. A szögletes zárójelben lévő szám az elem legstabilabb izotópjának atomtömege (és hozzávetőleges atomtömege).
összefoglaló
Video \(\PageIndex{3}\): a periódusos rendszer felfedezésének és tulajdonságainak összefoglalása.
a hasonló tulajdonságok időszakos megismétlődésének felfedezése az elemek között a Periódusos táblázat megfogalmazásához vezetett, amelyben az elemek az atomszám növekvő sorrendjében vannak elrendezve a csoportokként ismert időszakokban és oszlopokban. A periódusos rendszer ugyanazon csoportjában lévő elemek hasonló kémiai tulajdonságokkal rendelkeznek. Elemek lehet besorolni Fémek, fémek, nem fémek, vagy mint a fő-csoport elemek, átmeneti fémek, és a belső átmeneti fémek. A csoportok számozása 1-18 balról jobbra. Az 1. csoport elemeit alkálifémeknek nevezik; a 2.csoportban az alkáliföldfémek; a 15-ben a pniktogének; a 16-ban a kalkogének; a 17-ben a halogének; a 18-ban pedig a nemesgázok.