Tanulási Célok
a végén ez a rész, akkor képes lesz arra, hogy:
- Magyarázni közötti kapcsolatok mikroszkopikus, valamint a makroszkopikus mennyiségek egy gázzal
- Megoldani a problémákat érintő keverékek a gázok
- Megoldani a problémákat érintő, a távolságot, az időt között egy gáz molekulák ütközése
megvizsgáltuk, nyomás, hőmérséklet alapján a makroszkopikus meghatározások. A nyomás az a terület, amelyen az erőt kifejtik, a hőmérsékletet hőmérővel mérik. A gázok kinetikai elméletéből, a gázok makroszkopikus tulajdonságaira vonatkozó elméletből jobban megérthetjük a nyomást és a hőmérsékletet. Először két feltételezést teszünk az ideális gáz molekuláiról.
- nagyon nagy számú n molekula van, mindegyik azonos és mindegyik m tömegű.
- a molekulák engedelmeskednek Newton törvényeinek, és folyamatos mozgásban vannak, ami véletlenszerű és izotróp, azaz minden irányban azonos.
Az ideális gáztörvény és a mikroszkopikus mennyiségek, például egy tipikus molekula energiája és a makroszkopikus mennyiségek, például a hőmérséklet közötti kapcsolat meghatározásához egy ideális gáz mintáját elemezzük egy merev tartályban, amelyről két további feltételezést teszünk:
- a molekulák sokkal kisebbek, mint a köztük lévő átlagos távolság, tehát teljes térfogatuk sokkal kisebb, mint a tartályuk (amelynek v térfogata van). Más szavakkal, a Van der Waals constant B-t, a gázmolekulák móljának térfogatát elhanyagolhatónak tekintjük a tartályban lévő mól gáz térfogatához képest.
- a molekulák tökéletesen rugalmas ütközéseket tesznek a tartály falaival és egymással. Más erők rájuk, beleértve a gravitációt és a Van der Waals constant a által képviselt látnivalókat, elhanyagolhatóak (az izotropia feltételezéséhez szükséges).
a molekulák közötti ütközések nem jelennek meg az ideális gáztörvény levezetésében. A származékot sem zavarják, mivel a véletlenszerű sebességgel mozgó molekulák közötti ütközések új véletlenszerű sebességeket adnak. Továbbá, ha a tartályban lévő gázmolekulák sebessége kezdetben nem véletlenszerű és izotróp, akkor a molekuláris ütközések teszik őket véletlenszerűvé és izotrópvá.
még további feltételezéseket teszünk, amelyek egyszerűsítik a számításokat, de nem befolyásolják az eredményt. Először hagyjuk, hogy a tartály téglalap alakú doboz legyen. Másodszor, kezdjük figyelembe véve a monatomi gázokat, amelyek molekulái egyetlen atomokból állnak, például héliumból. Ezután feltételezhetjük, hogy az atomoknak nincs energiájuk, kivéve a transzlációs kinetikus energiájukat; például, nincs sem forgó, sem vibrációs energiájuk. (Később megvitatjuk ennek a feltételezésnek az érvényességét a valódi monatomikus gázokra vonatkozóan, és eltekintünk attól, hogy a diatomikus és a poliatomikus gázokat figyelembe vegyük.)
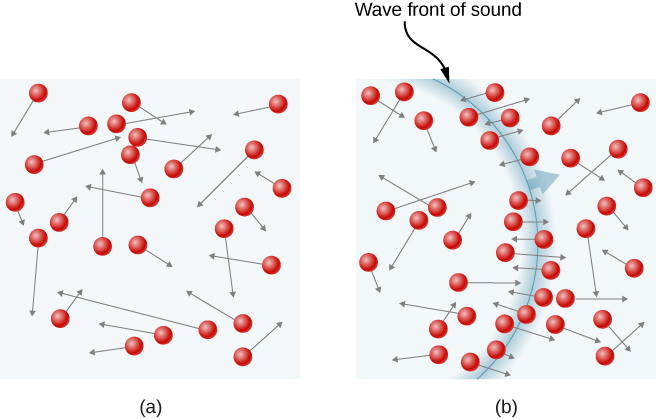
ábra \ (\PageIndex{1}\) egy gázmolekula ütközését mutatja egy tartály falával, úgy, hogy erőt fejt ki a falon (Newton harmadik törvénye szerint). Ezek az ütközések a gáz nyomásának forrása. Ahogy a molekulák száma nő, az ütközések száma, így a nyomás nő. Hasonlóképpen, ha a molekulák átlagos sebessége magasabb, akkor a gáznyomás magasabb.
egy tartályban lévő gázmintában a molekuláris mozgás véletlenszerűsége miatt a molekulák ütközésének száma a fal bármely részével egy adott időben ingadozik. Mivel azonban egy hatalmas számú molekula ütközik a fal rövid idő alatt, az ütközések száma a mérleg idő és a tér mérjük ingadozik csak egy apró, általában nem látható frakció az átlagtól. Összehasonlíthatjuk ezt a helyzetet egy kaszinóéval, ahol a fogadások eredményei véletlenszerűek, és a kaszinó bevételei percről órára ingadoznak. Azonban hosszú idő, mint például egy év, a kaszinó bevételei nagyon közel állnak az esélyektől várható átlagokhoz. Egy tank gáznak egy év alatt sokkal több molekulája van, mint egy Kaszinónak, és a molekulák egy másodperc alatt sokkal több ütközést okoznak, mint egy Kaszinónak.
a molekulák által a doboz falára kifejtett átlagos erő kiszámítása az ideális gáztörvényhez, valamint a hőmérséklet és a molekuláris kinetikus energia közötti kapcsolathoz vezet. (Valójában két átlagot fogunk venni: az egyik az idő múlásával, hogy az egyik molekula által egy adott sebességgel kifejtett átlagos erőt kapjuk, majd egy másik átlagot a különböző sebességgel rendelkező molekulák felett.) Ezt a megközelítést Daniel Bernoulli (1700-1782) fejlesztette ki, aki a fizikában legismertebb a folyadékáramlással (hidrodinamika) kapcsolatos munkájáról. Figyelemre méltó, hogy Bernoulli ezt a munkát tette, mielőtt Dalton létrehozta az anyag atomokból álló nézetét.
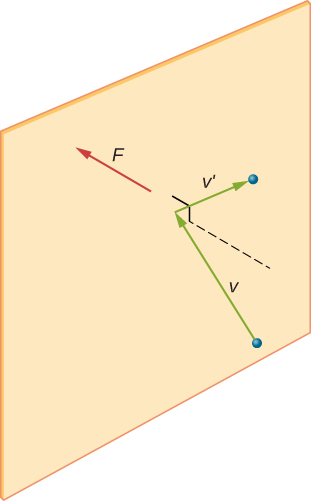
ábra \ (\PageIndex{2}\) egy gázzal teli tartályt ábrázol, és egy gázmolekula rugalmas ütközését mutatja a tartály falával, komponensekre bontva. Feltételeztük, hogy egy molekula kicsi a gázban lévő molekulák elválasztásához képest, és hogy más molekulákkal való kölcsönhatása figyelmen kívül hagyható. Ilyen körülmények között az ideális gáztörvény kísérletileg érvényes. Mivel azt is feltételeztük, hogy a fal merev és a részecskék pontok, az ütközés rugalmas (az energia megőrzésével-nincs sehol egy részecske kinetikus energiája). Ezért a molekula kinetikus energiája állandó marad, így sebessége és lendülete is állandó marad. Ez a feltételezés nem mindig érvényes, de a modul többi részének eredményei olyan modellekben is megtalálhatók, amelyek lehetővé teszik a molekulák energiájának és lendületének cseréjét a falhoz.
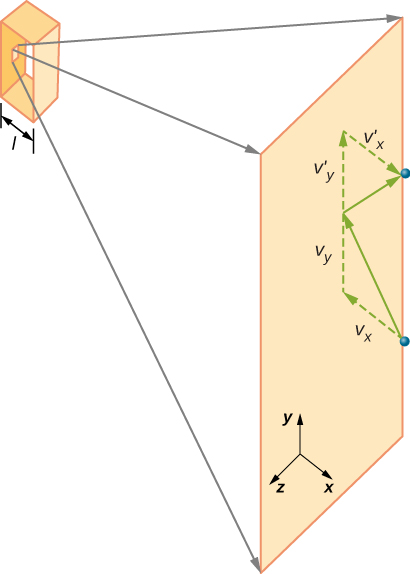
Ha a molekula sebessége X irányban változik, akkor a lendülete \(- m_x\)- ról \(+mv_x\) – ra változik. Így a lendület változása \(\Delta mv = +mv_x -(-mv_x) = 2mv_x\). A lineáris Momentumról és ütközésekről szóló fejezetben megadott impulzusmomentum-tétel szerint az I.molekulára kifejtett erőt, ahol a molekulákat 1-től N-ig jelölöm, \
adja(ebben az egyenletben csak a P jelent lendületet, nem pedig a nyomást.) A fal és a molekula között nincs erő, kivéve, ha a molekula megérinti a falat. Az ütközés rövid ideje alatt a molekula és a fal közötti erő viszonylag nagy, de nem ezt az erőt keressük. Az átlagos erőt keressük, ezért a \(\Delta T\) – ot az adott molekula ütközései közötti átlagos időnek tekintjük ezzel a falral, amely az az idő, amikor elvárjuk, hogy egy ütközést találjunk. L legyen a doboz hossza x irányban. Akkor \(\Delta t\) az az idő, amikor a molekula átmegy a dobozon és vissza, egy távolság 2L, \(v_x\) sebességgel. Így \(\delta t = 2L/v_x\), és az erő kifejeződése
\
Ez az erő egy molekulának köszönhető. Ahhoz, hogy megtaláljuk a teljes erőt a falon, F, hozzá kell adnunk az összes n molekula hozzájárulását:
\
most az átlag meghatározását használjuk, amelyet egy sávval jelölünk, hogy megtaláljuk az erőt:
\
az erőt a v sebesség szempontjából akarjuk, nem pedig a sebesség x-összetevőjét. Vegye figyelembe, hogy a teljes sebesség négyzetével az az összeg, a négyzet az összetevők, hogy
\
a feltételezés, isotropy, a három átlagok, a jobb oldalon, vagy egyenlő, tehát
\
Helyettesítő ez a kifejezés a F ad
\
A nyomás F/A, így megkapjuk
\, ahol régen \(V = Al\) a hangerőt. Ez adja a fontos eredmény
\
kombinálásával ezt az egyenletet \(pV = Nk_BT\) ad
\
tudjuk, hogy az átlagos kinetikus energia egy molekula, \(\frac{1}{2}m\overline{v}^2\), a bal oldali az egyenlet elosztjuk n és megszorozzuk 3/2.
molekula átlagos kinetikus energiája
egy molekula átlagos kinetikus energiája közvetlenül arányos abszolút hőmérsékletével:
az egyenlet \(\overline{k} = \frac{3}{2} k_bt\) a molekulánkénti átlagos kinetikus energia. Vegye figyelembe különösen, hogy ebben az egyenletben semmi sem függ a gáz molekulatömegétől (vagy bármely más tulajdonságától), a nyomástól vagy bármi mástól, kivéve a hőmérsékletet. Ha a nagyon különböző molekulatömegű hélium-és xenongáz-minták ugyanazon a hőmérsékleten vannak, akkor a molekulák átlagos kinetikus energiával rendelkeznek.
a termodinamikai rendszer belső energiája az összes benne lévő molekula mechanikai energiájának összege. Most egy egyenletet adhatunk egy monatomi ideális gáz belső energiájához. Egy ilyen gázban a molekulák egyetlen energiája a transzlációs kinetikus energiájuk. Ezért jelöli a belső energia, a \(E_{int}\) csak az van, \(E_{int} = N\overline{K}\), vagy
\
Gyakran szeretnénk használni ezt az egyenletet szempontjából mol:
\
meg Tudjuk oldani a \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) egy tipikus sebesség egy molekula egy ideális gáz szempontjából hőmérséklet meghatározni, hogy mi is ismert, mint a root-mean-square (rms) sebesség a molekula.
RMS Sebesség egy Molekula
A root-mean-square (rms) sebesség a molekula, vagy a négyzetes átlaga a tér a sebesség \(\overline{v}^2\), a
\
Az effektív sebesség nem az átlagos, vagy a legvalószínűbb sebesség molekulák, mint látni fogjuk, a Forgalmazási a Molekuláris Sebesség, de ez biztosítja, hogy egy könnyen számított becslés a molekulák sebessége, amely kapcsolódik a mozgási energia. Ismét írhatjuk ezt az egyenletet az R gázállandó, valamint az M moláris tömeg kg/mol-ban:
\
egy pillanatra elkalandozunk, hogy válaszoljunk egy olyan kérdésre, amely esetleg felmerült: amikor a modellt az atomokra alkalmazzuk az elméleti pontrészecskék helyett, a forgási kinetikus energia megváltoztatja eredményeinket? A kérdés megválaszolásához a kvantummechanikához kell fordulnunk. A kvantummechanikában a forgási kinetikus energia nem vehet fel egyetlen értéket sem; diszkrét értékkészletre korlátozódik, a legkisebb érték pedig fordítottan arányos a forgási tehetetlenséggel. Az atom forgási tehetetlensége kicsi, mert szinte az összes tömege a magban van, amelynek sugara általában kevesebb, mint \(10^{-14} m\). Így egy atom minimális forgási energiája sokkal több, mint \(\frac{1}{2}k_bt\) bármely elérhető hőmérsékletnél, és a rendelkezésre álló energia nem elegendő ahhoz, hogy egy atom forogjon. A következő részben visszatérünk erre a pontra, amikor a diatómiás és a poliatómiás gázokról beszélünk.
példa \ (\PageIndex{1}\): Egy gázmolekula kinetikus energiájának és sebességének kiszámítása
- mi a gázmolekula átlagos kinetikus energiája \(20.0^oC\) (szobahőmérséklet)?
- keresse meg egy nitrogénmolekula (\(N_2\) RMS sebességét ezen a hőmérsékleten.
stratégia
(a) az egyenletben ismert átlagos kinetikus energia a hőmérséklet:
\
mielőtt az értékeket ebbe az egyenletbe helyettesítjük, az adott hőmérsékletet kelvinre kell konvertálnunk: \(t = (20,0 + 273)\, K = 293 \, K\). A nitrogénmolekula rms sebességét a
\
egyenlet segítségével találjuk meg,de először meg kell találnunk egy nitrogénmolekula tömegét. A nitrogén moláris tömegének \(N_2\) megszerzése a periódusos táblázatból
\
- a hőmérséklet önmagában elegendő ahhoz, hogy megtaláljuk az átlagos transzlációs kinetikus energiát. A hőmérséklet helyettesítése a transzlációs kinetikus energia egyenletbe a \
- értéket, a\ (k_B\) értéket pedig a\ (v_{RMS}\) egyenletbe adja \
szignifikancia
Megjegyzendő, hogy a molekula átlagos kinetikus energiája független a molekula típusától. Az átlagos transzlációs kinetikus energia csak az abszolút hőmérséklettől függ. A kinetikus energia nagyon kicsi a makroszkopikus energiákhoz képest, így nem érezzük, amikor egy légmolekula eltalálja a bőrünket. Másrészt sokkal nagyobb, mint a gravitációs potenciális energia tipikus különbsége, amikor egy molekula például egy szoba tetejéről az aljára mozog, így a gravitáció elhanyagolása indokolt a tipikus valós helyzetekben. A nitrogén molekula rms sebessége meglepően nagy. Ezek a nagy molekuláris sebességek nem eredményezik a levegő makroszkopikus mozgását, mivel a molekulák azonos valószínűséggel mozognak minden irányban. A levegőben lévő molekulák átlagos szabad útja (egy molekula átlagosan az ütközések között mozog, amelyet egy kicsit később tárgyaltunk) nagyon kicsi, így a molekulák gyorsan mozognak, de egy másodperc alatt nem jutnak messzire. Az rms sebesség magas értéke tükröződik a hangsebességben, amely szobahőmérsékleten körülbelül 340 m/s. Minél nagyobb a légmolekulák rms sebessége,annál gyorsabb a hang rezgése a levegőn keresztül. A hang sebessége a hőmérséklettel nő, és nagyobb a kis molekulatömegű gázokban, mint például a hélium (lásd a \(\PageIndex{3}\) ábrát).
Például a \(\PageIndex{2}\): Számítási Hőmérséklet: a Szökési Sebességet a Hélium Atomok
ahhoz, Hogy elkerülje a Föld gravitációs, egy tárgy, a csúcs közelében a légkör (tengerszint feletti magasságban 100 km) kell utazni a Földtől a 11.1 km/s. Ezt a sebességet nevezzük a szökési sebességet. Milyen hőmérsékleten lenne a hélium atomok rms sebessége megegyezik a menekülési sebességgel?
stratégia
azonosítsa az ismeretleneket és határozza meg, hogy mely egyenleteket kell használni a probléma megoldásához.
megoldás
- azonosítsa a knowns-t: v a menekülési sebesség, 11,1 km/s.
- azonosítsa az ismeretleneket: meg kell oldanunk a hőmérsékletet, T. meg kell oldanunk a hélium atom m tömegét is.
- határozza meg, hogy mely egyenletekre van szükség.
- a hélium atom m tömegének megszerzéséhez a periódusos táblázatból származó információkat felhasználhatjuk: \
- megoldani a hőmérséklet-T, meg tudjuk rendezni \ hozam \
- Helyettesíti az ismert értékeket a egyenleteket megoldani az ismeretlen, \ s \
Jelentősége
Ez a hőmérséklet sokkal magasabb, mint a légköri hőmérséklet, ami körülbelül 250 K (\(-25^oC -\) vagy \(-10^a\)) nagy magasságban. Nagyon kevés héliumatom maradt a légkörben, de sokan jelen voltak, amikor a légkör kialakult, és több mindig jön létre a radioaktív bomlás (lásd a fejezetet a nukleáris fizika). A hélium atomok elvesztésének oka az, hogy a hélium atomok kis száma normál hőmérsékleten is nagyobb sebességgel rendelkezik, mint a Föld menekülési sebessége. A hélium atom sebessége az egyik ütközésről a másikra változik, így bármely pillanatban kicsi, de nem nulla esély van arra, hogy az atom sebessége nagyobb, mint a menekülési sebesség. Az esély elég nagy ahhoz, hogy a Föld élettartama alatt szinte az összes héliumatom, amely a légkörben volt, nagy magasságban elérte a menekülési sebességet, és elmenekült a Föld gravitációs vonzásától. A nehezebb molekulák, mint például az oxigén, a nitrogén és a víz, kisebb rms sebességgel rendelkeznek, így sokkal kevésbé valószínű, hogy bármelyiküknek nagyobb sebessége lesz, mint a menekülési sebesség. Valójában a valószínűsége olyan kicsi, hogy több milliárd évre van szükség ahhoz, hogy jelentős mennyiségű nehezebb molekulát veszítsen el a légkörből. A \(\PageIndex{4}\) ábra azt mutatja, hogy a légkör hiánya milyen hatással van a Holdra. Mivel a Hold gravitációs vonzása sokkal gyengébb, szinte az egész légkörét elvesztette. A föld és más testek légkörét e fejezet gyakorlatai hasonlítják össze.

Exercise \(\PageIndex{2}\)
Ha egy nagyon kis tárgyat, például pollenszemcsét tekintünk egy gázban, akkor a felszínét érintő molekulák száma is viszonylag kicsi lenne. Számítana arra,hogy a pollenszemcsék bármilyen nyomásingadozást tapasztalnak a gázmolekulák számának statisztikai ingadozása miatt egy adott idő alatt?
válasz
Igen. Az ilyen ingadozások valójában egy gáz bármely méretű testénél fordulnak elő, de mivel a molekulák száma óriási a makroszkopikus testek számára, az ingadozások az ütközések számának apró százalékát teszik ki, és az ebben a szakaszban említett átlagok észrevehetetlenül változnak. Nagyjából elmondható, hogy az ingadozások fordítottan arányosak az ütközések számának négyzetgyökével, így a kis testek esetében jelentősek lehetnek. Ezt valójában a tizenkilencedik században figyelték meg a vízben lévő pollenszemcsék esetében, amelyet Brownian mozgásnak neveznek.
gőznyomás, parciális nyomás, és Dalton törvénye
Az a nyomás, amelyet egy gáz hoz létre, ha elfoglalja a rendelkezésre álló teljes térfogatot, a gáz részleges nyomásának nevezik. Ha két vagy több gáz keveredik, akkor a molekulák közötti ütközések következtében termikus egyensúlyba kerülnek; a folyamat a hővezetéshez hasonló, a hőmérsékletről és a hőről szóló fejezetben leírtak szerint. Amint azt a kinetikus elméletből láttuk, amikor a gázok hőmérséklete azonos, molekuláik átlagos kinetikus energiával rendelkeznek. Így minden gáz külön-külön betartja az ideális gáztörvényt, és ugyanolyan nyomást gyakorol egy tartály falára, mint ha egyedül lenne. Ezért gázok keverékében a teljes nyomás az alkotó gázok részleges nyomásának összege, ideális gáz viselkedést feltételezve, az összetevők között nincs kémiai reakció. Ezt a törvényt Dalton részleges nyomásról szóló törvényének nevezik, miután John Dalton (1766-1844) angol tudós javasolta. Dalton törvénye összhangban van azzal a ténnyel, hogy a nyomás Pascal elve szerint növekszik.
a termikus egyensúlyban lévő ideális gázok keverékében az egyes gázok molekuláinak száma arányos a részleges nyomásával. Ez az eredmény abból következik, hogy az ideális gáztörvényt mindegyikre \(p/n = RT/V\) formában alkalmazzák. Mivel a jobb oldali ugyanaz minden gáz esetében egy adott hőmérsékleten egy adott térfogatú tartályban, a bal oldali ugyanaz is.
- a parciális nyomás az a nyomás, amelyet egy gáz létrehozna, ha önmagában létezne.
- Dalton törvénye kimondja, hogy a teljes nyomás a jelen lévő összes gáz részleges nyomásának összege.
- bármely két (1-es és 2-es jelzésű), egy tartályban egyensúlyban lévő gáz esetében \ (\frac{p_1}{n_1} = \ frac{p_2}{n_2}.\)
a parciális nyomás fontos alkalmazása az, hogy a kémiában a gáz koncentrációjaként működik a reakció sebességének meghatározásában. Itt csak azt említjük, hogy az oxigén részleges nyomása az ember tüdejében létfontosságú az élet és az egészség szempontjából. A 0,16 atm alatti parciális oxigénnyomású levegő károsíthatja a koordinációt és az ítélőképességet, különösen azokban az emberekben, akik nem szoktak hozzá a magas magassághoz. A \(O_2\) alacsonyabb parciális nyomásnak súlyosabb következményei vannak; a 0,06 atm alatti parciális nyomás gyorsan halálos lehet, és az állandó károsodás akkor is valószínű, ha a személyt megmentik. Azonban az érzés, hogy lélegezni kell, mint amikor a lélegzetét tartja, sokkal nagyobb a szén-dioxid magas koncentrációja a vérben, mint az alacsony oxigénkoncentráció. Így, ha egy kis helyiség vagy szekrény tele van alacsony oxigén koncentrációjú levegővel, talán azért, mert egy sűrített gáz szivárgó hengerét tárolják ott, az ember nem érez semmilyen “fulladás” érzést, és görcsökbe kerülhet, vagy elveszítheti az eszméletét anélkül, hogy észrevenne valami rosszat. A biztonsági mérnökök jelentős figyelmet fordítanak erre a veszélyre.
a parciális nyomás másik fontos alkalmazása a gőznyomás, amely egy olyan gőz részleges nyomása, amely egyensúlyban van ugyanazon anyag folyadék (vagy szilárd, szublimáció esetén) fázisával. Bármely hőmérsékleten a víz részleges nyomása a levegőben nem haladhatja meg a víz gőznyomását ezen a hőmérsékleten, mert amikor a részleges nyomás eléri a gőznyomást, a víz kondenzálódik a levegőből. A harmat példa erre a kondenzációra. A levegőminta kondenzációjának hőmérsékletét harmatpontnak nevezik. Könnyen mérhető egy fémgolyó lassú hűtésével; a harmatpont az a hőmérséklet, amelyen a kondenzáció először megjelenik a labdán.
a víz gőznyomását a meteorológia szempontjából érdekes bizonyos hőmérsékleteken a\(\PageIndex{1}\) táblázat tartalmazza.
| T(\(^oC\)) | gőznyomás (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) a T hőmérsékleten a
\
\(100\%\) relatív páratartalma azt jelenti, hogy a víz részleges nyomása megegyezik a gőznyomással; más szóval, a levegő vízzel telített.
példa \(\PageIndex{3}\): relatív páratartalom kiszámítása
mi a relatív páratartalom, ha a levegő hőmérséklete \(25^oC\), a harmatpont pedig \ (15^oC\)?
stratégia
egyszerűen felnézzük a gőznyomást az adott hőmérsékleten és a harmatpontban, és megtaláljuk az arányt.
megoldás
\
jelentősége
R. H. fontos a kényelem. A \(53.8\%\) értéke a \(40\%\) – \(60\%\) tartományon belül van, amelyet beltéri kényelemre ajánlunk.
Amint a fejezet a hőmérséklet, valamint a hőség, a hőmérséklet ritkán esik a harmatpont alatti, mert ha eléri a harmatpont vagy frost pont, víz lecsapódik, majd kiad egy viszonylag nagy mennyiségű látens hő párolgás.
Mean Free Path and Mean Free Time
most kifejezetten az ütközéseket vesszük figyelembe. A szokásos első lépés (ami minden, amit megteszünk) az átlagos szabad út kiszámítása, \(\lambda\), a molekula átlagos távolsága a többi molekulával való ütközések között, valamint az átlagos szabad idő \(\tau\), a molekula ütközései közötti átlagos idő. Ha feltételezzük, hogy az összes molekula \(r\) sugárú gömb, akkor egy molekula ütközik egy másikkal, ha központjaik egymástól 2r távolságra vannak. Egy adott részecske esetében azt mondjuk, hogy az adott sugarú kör területe, \(4 \ pi r^2\), az ütközések “keresztmetszete”. Ahogy a részecske mozog, egy hengert nyomoz azzal a keresztmetszettel. Az átlagos szabad út a hossza \ (\lambda\), így a várható számú más molekulák egy henger hossza \ (\lambda\) és keresztmetszete \ (4 \ pi r^2\) 1. Ha ideiglenesen figyelmen kívül, hogy a mozgás a molekulák más, mint az, akit keresünk, a várható száma a száma, sűrűsége molekulák, N/V, szer mennyisége, valamint a kötet \(4\pi^2 \lambda\), úgyhogy \((N/V)4\pi^2 \lambda = 1\), vagy
\
Figyelembe a mozgás a molekulák figyelembe teszi a számítás sokkal nehezebb, de a változás csak egy tényező a \(\sqrt{2}\). Az eredmény
\
Az ideális gáz, mi helyettesítheti \(V/N = k_BT/o\) megszerzése
\
A szabad időt \(\tau\) csak az azt jelenti, szabad utat osztva egy tipikus sebesség, valamint a szokásos választás az effektív sebesség. Ezután
\
Az átlagos szabad idő kiszámítása
keresse meg az argonatomok átlagos szabadidejét (\(m = 39,9 \, g / mol\)) \(0^oC\) hőmérsékleten és 1,00 atm nyomáson. Vegyük az argon atom sugarát \(1.70 \szor 10^{-10}\space m\).
Solution
- azonosítsa a knowns-t és alakítsa át SI egységekké. Tudjuk, hogy a moláris tömeg 0.0399 kg/mol, a hőmérséklet 273 K, a nyomás \(1.01 \ – szor 10^5 \, Pa\), a sugár \(1.70 \ – szor 10^{-10}\, m\).
- keresse meg az rms sebességet: \(v_{rms} = \ sqrt {\frac{3RT}{M}} = 413 \, m/s\).
- helyettesítse az egyenletbe az átlagos szabadidőt: \
szignifikancia
alig tudjuk összehasonlítani ezt az eredményt a gázmolekulákkal kapcsolatos intuíciónkkal, de képet ad nekünk a rendkívül nagy frekvenciával ütköző molekulákról.
gyakorlat \(\PageIndex{4}\)
amely hosszabb átlagos szabad utat, folyékony vizet vagy vízgőzt tartalmaz a levegőben?
válasz
folyadékban a molekulák nagyon közel vannak egymáshoz, folyamatosan ütköznek egymással. Ahhoz, hogy a gáz szinte ideális legyen, mivel a levegő rendes körülmények között van, a molekuláknak nagyon távol kell lenniük egymástól. Ezért az átlagos szabad út sokkal hosszabb a levegőben.
-
Samuel J. Ling (Truman Állami Egyetem), Jeff Sanny (Loyola Marymount Egyetem) és Bill Moebs számos közreműködő szerzővel. Ezt a munkát az OpenStax University Physics engedélyezi a Creative Commons Attribution License alapján (4.0-ig).