allil-Karbokáció molekuláris pályái
a propén karbokációjának stabilitása konjugált π elektronrendszernek köszönhető. A “kettős kötés” valójában nem létezik. Helyette, ez egy csoport 3 szomszédos, átfedő, nem hibridizált p pályák nevezzük konjugált π elektron rendszer. Világosan láthatja, hogy a három karbon közül mind a három P-pálya közötti kölcsönhatások valóban stabil kationot eredményeznek. Minden jön le, ahol a helyét az elektron-hiányos szén.
A molekuláris orbitális Leírások A 2-propenil segítségével még más módon magyarázzák az allil stabilitását. Fig.6
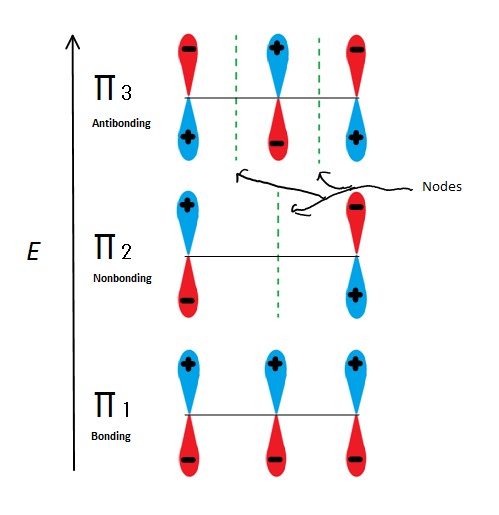
ábra.A 6 A 2-propenil
3 lehetséges molekuláris pályáját mutatja, ha csak a π molekuláris orbitált vesszük, nem pedig az s-t, akkor hármat kapunk. a π1 csomópont nélküli kötés, a π2 nem kötődő (más szóval ugyanaz az energia, mint egy szabályos p-orbitális) egy csomóponttal, a π3 pedig 2 csomóponttal ellentétes (egyik orbitális sem kölcsönhatásba lép). Az első két elektron a π1 molekuláris pályára kerül, függetlenül attól, hogy kation, radikális vagy anion. Ha radikális vagy anion, akkor a következő elektron a π2 molekuláris orbitába kerül. Az utolsó anion elektron is belép a nembonding orbitális pályára. Tehát függetlenül attól, hogy milyen szénközpont létezik, egyetlen elektron sem fog bejutni az antibonding orbitális pályára.
A kötési pályák a legalacsonyabb energiájú pályák és kedvezőek, ezért először töltődnek be. Annak ellenére, hogy a nem tapadó pályák tölthetők, a rendszer teljes energiája még mindig alacsonyabb és stabilabb a töltött kötés molekuláris pályái miatt.
ez a szám azt is mutatja, hogy π2 az egyetlen molekuláris orbitális, ahol az elektrion különbözik, és ott is, ahol egyetlen csomópont áthalad a közepén. Emiatt a molekula töltése elsősorban a két terminális szénre vonatkozik, nem pedig a középső szénre.
Ez a molekuláris orbitális leírás az allil-szén-központok stabilitását is szemlélteti a 7. ábrán.
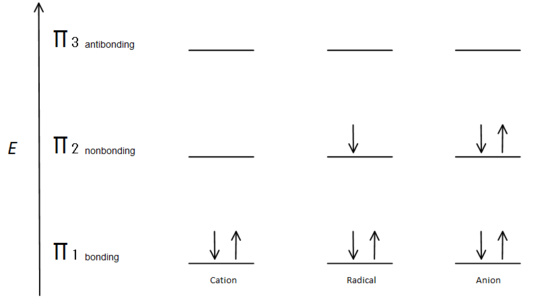
ábra.7 ábra mutatja, hogy az elektronok töltse alapján Aufbau elv.
A π kötés orbitális energiája alacsonyabb, mint a nem tapadó p orbitális. Mivel minden szén-center látható két elektronok az alacsonyabb energia, kötés π elektronpályák, az energia, minden rendszer csökkentette általános (így stabilabb), függetlenül attól, kation, radikális, vagy anion.