monien molekyylien Lewis-Diagrammi ei kuitenkaan ole yhdenmukainen molekyylin Havaittujen ominaisuuksien kanssa.
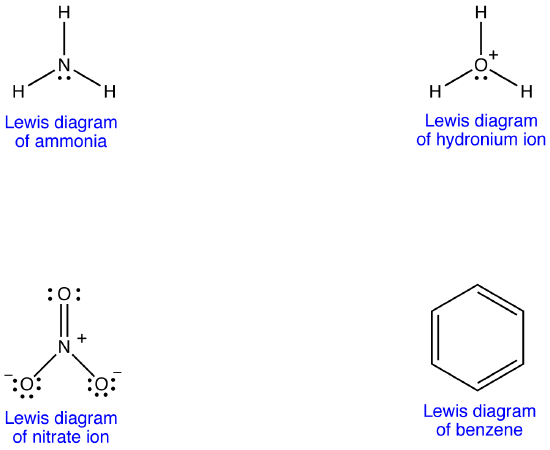
Esimerkki 1: Nitraatti-ionilla
nitraatti-ionilla on Lewisin diagrammin mukaan kahdenlaisia typpi-happi-sidoksia, yksi kaksoissidos ja kaksi yksittäistä sidosta, mikä viittaa siihen, että nitraatti-ionin yksi typpi-happi-sidos on lyhyempi ja vahvempi kuin kummallakaan muulla. Lewis-rakenne merkitsee myös muodollisen varauksen osalta, että nitraatti-ionissa on kahdenlaisia happiatomeja, joista toinen on muodollisesti neutraali ja toinen kahdesta muusta, joiden muodollinen varaus on -1. Kokeellisesti nitraatti-ionin kolmella typpi-happi-sidoksella on kuitenkin sama sidoksen pituus ja sama sidosenergia, ja kolmea happiatomia on mahdoton erottaa toisistaan. Lewisin Diagrammi ei selitä tyydyttävästi nitraatti-ionin rakennetta ja sidosta.
nitraatti-Ionille voidaan piirtää vielä kaksi Lewis-diagrammia.
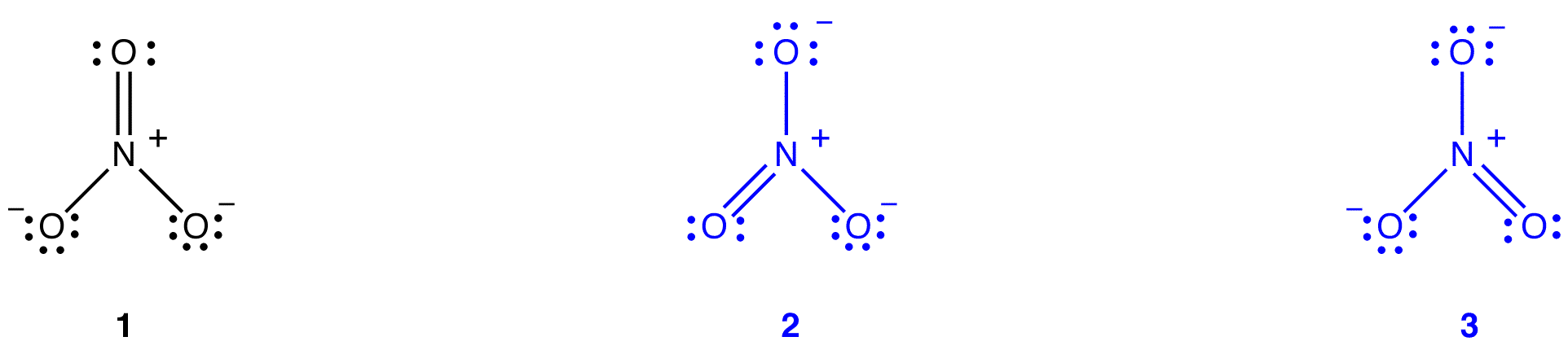
mikään niistä ei kuitenkaan vastaa nitraatti-ionin havaittavia ominaisuuksia, eikä näin ollen kuvaa nitraatti-Ionia oikein.
Esimerkki 2: Bentseenillä
bentseenillä on Lewisin diagrammin mukaan kahdenlaisia hiili-hiili-sidoksia, kolme kaksoissidosta ja kolme yksittäistä sidosta, mikä viittaa siihen, että jokainen bentseenin kolmesta hiili-hiili-sidoksesta on lyhyempi ja vahvempi kuin kukin kolmesta muusta. Kokeellisesti bentseenin kuudella hiili-hiili-sidoksella on kuitenkin sama sidoksen pituus ja sama sidosenergia. Lewisin Diagrammi ei pysty selittämään bentseenin rakennetta ja sidoksia tyydyttävästi.
niiden molekyylien attribuutti, joiden klassinen Lewisin Diagrammi ei ole yhdenmukainen Havaittujen ominaisuuksien kanssa, on se, että niille voidaan luoda muita kelvollisia Lewis-diagrammeja. Bentseenille voidaan piirtää vielä yksi Lewis-Diagrammi.

mikään niistä ei kuitenkaan vastaa bentseenin havaittuja ominaisuuksia, eikä näin ollen kuvaa bentseeniä oikein.
Resonanssiteoria on yritys selittää jonkin lajin rakenne, kuten nitraatti-ionin tai bentseenin, jonka Lewis-Diagrammi ei vastaa lajin havaittuja ominaisuuksia. Resonanssiteorian suurin etu on se, että vaikka se perustuukin tiukkaan matemaattiseen analyysiin, resonanssiteoriaa voidaan soveltaa menestyksekkäästi vetoamalla vähäiseen tai olemattomaan matematiikkaan. Resonanssiteoria selitetään alla käyttäen esimerkkinä nitraatti-Ionia.
resonanssiteorian mukaan nitraatti-ionin rakenne ei ole 1, 2 eikä 3, vaan kaikkien kolmen keskiarvo, jota painotetaan stabiilisuudella. Lewisin diagrammeja 1, 2 ja 3 kutsutaan nitraatti-ionin resonanssimuodoiksi, resonanssirakenteiksi tai resonanssivaikuttajiksi. Nitraatti-ionin rakenteen sanotaan olevan resonanssihybridi tai yksinkertaisesti resonanssimuotojen 1, 2 ja 3 Hybridi. Aina kun on tarpeen osoittaa nitraatti-ionin rakenne, piirretään resonanssimuodot 1, 2 ja 3, jotka on yhdistetty toisiinsa kaksipäisillä nuolilla.
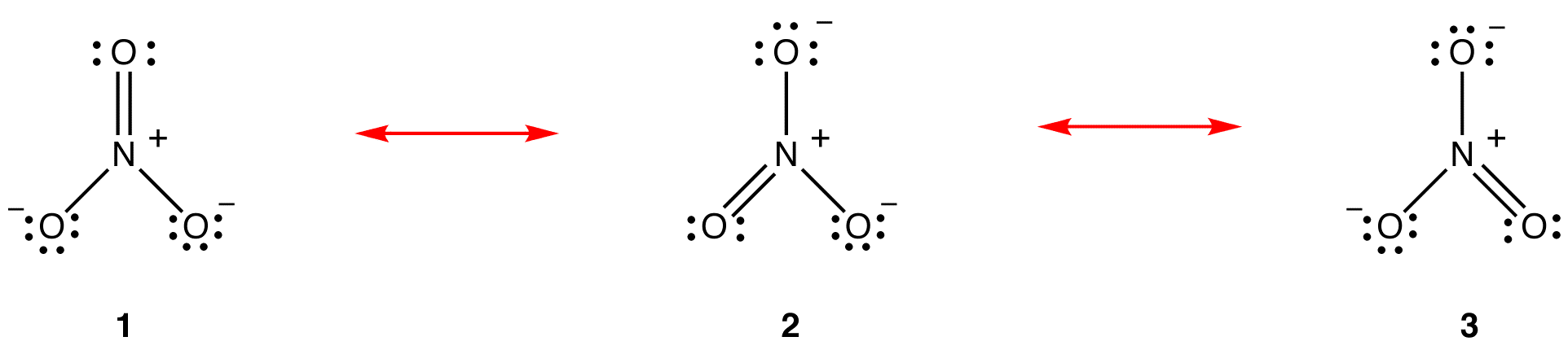
nitraatti-ionin kolme resonanssimuotoa, 1, 2 ja 3, ovat identtisiä, joten niillä on sama Stabiilisuus ja näin ollen vaikuttavat yhtä lailla hybridiin. Koska tiedetään tarkasti, missä määrin nitraatti-ionin jokainen resonanssimuoto vaikuttaa hybridiin, voidaan helposti määrittää kunkin typpi-happi-sidoksen sidosjärjestys sekä hybridin kunkin happiatomin muodollinen varaus:
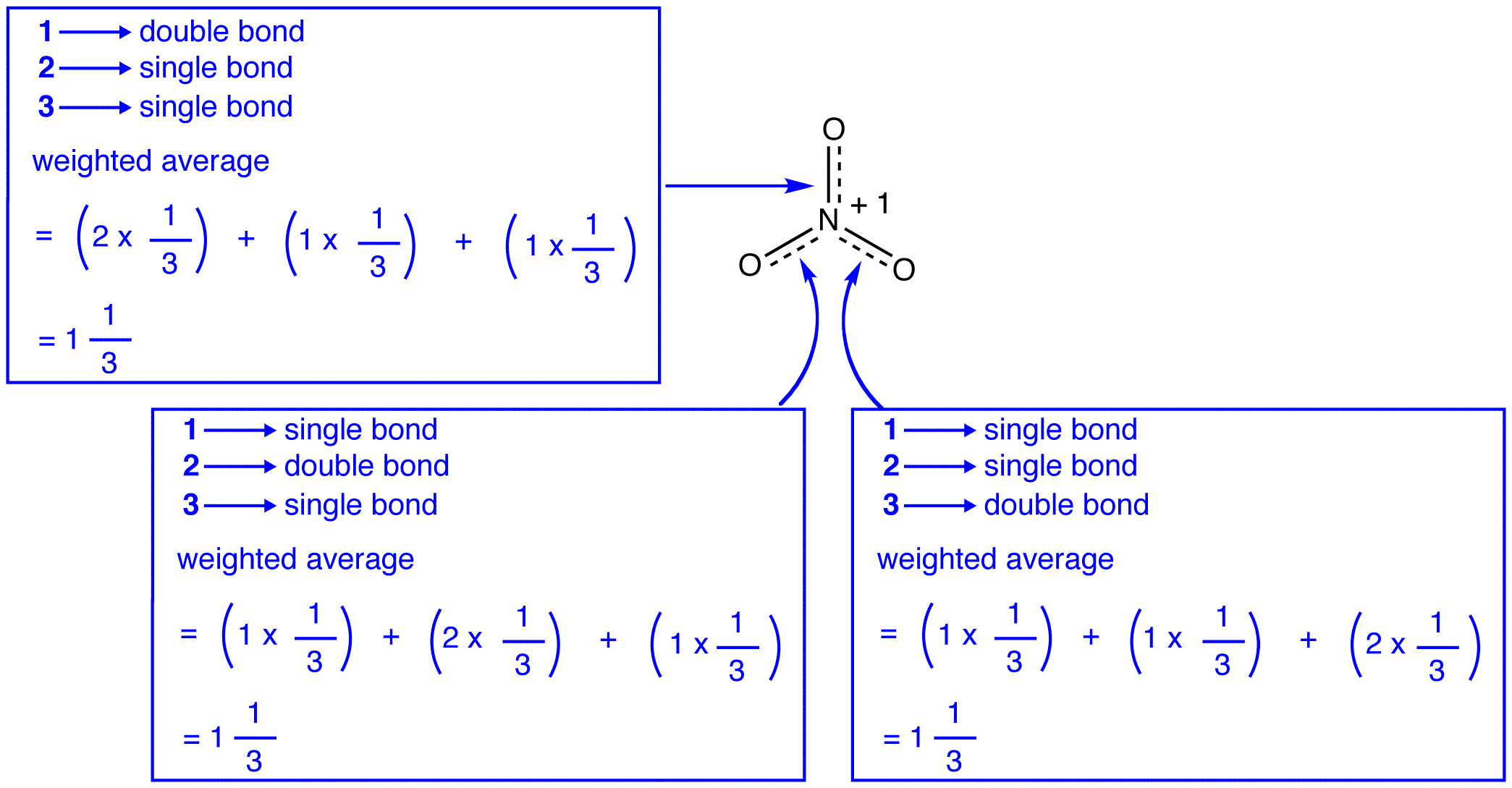
resonanssiteorian mukaan jokainen nitraatti-ionin sidos on yksi ja kolmasosa sidoksesta, mikä on yhtäpitävä havainnon kanssa, että nitraatti-ionin kolmella sidoksella on sama sidoksen pituus ja sama sidosenergia.
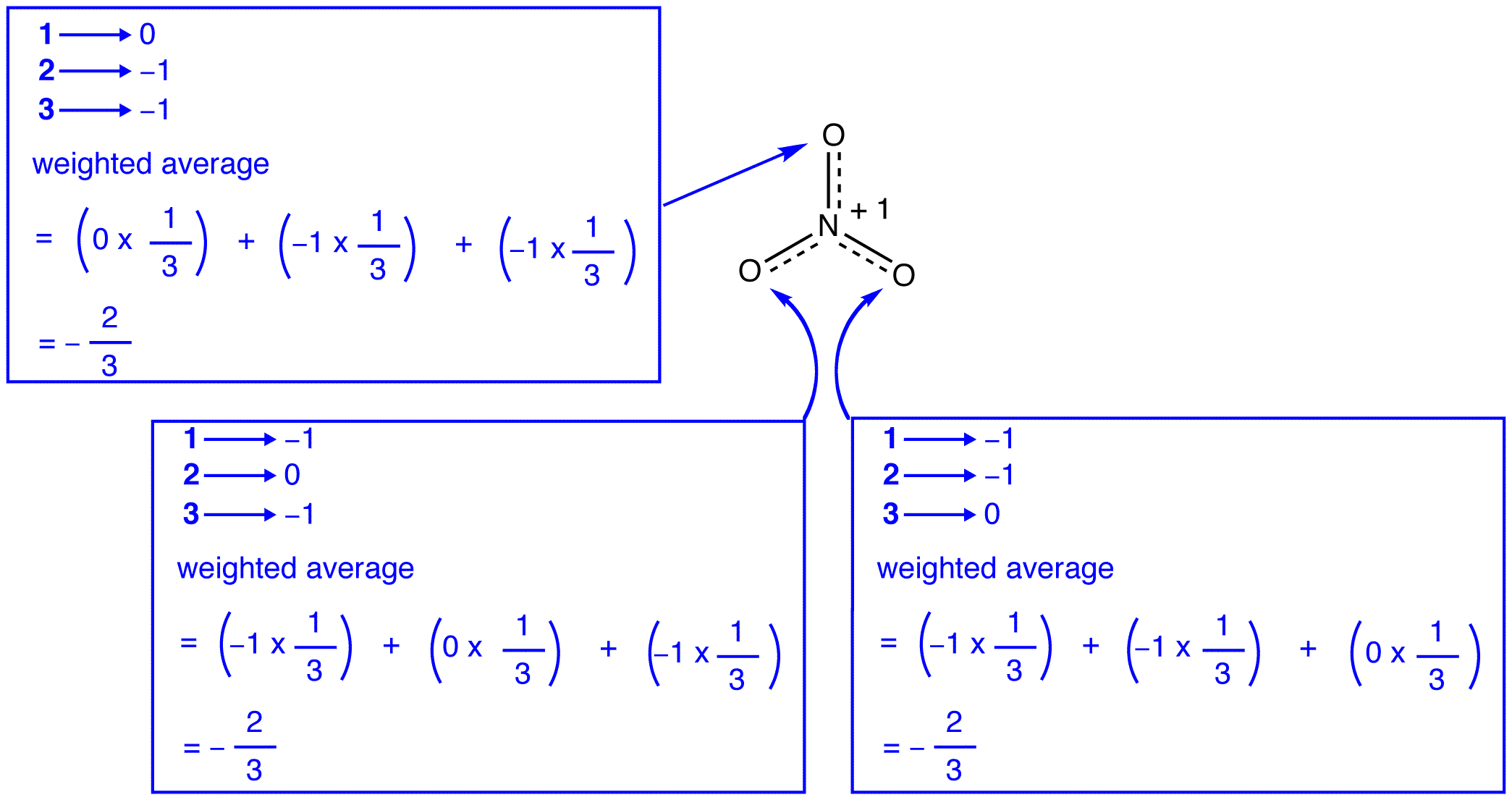
resonanssiteorian mukaan jokaisen nitraatti-ionin happiatomin muodollinen varaus on -2 / 3, mikä yhdessä sen kanssa, että kolme typpi-happi-sidosta ovat identtisiä, vastaa havaintoa siitä, että nitraatti-ionin kolme happiatomia ovat erottamattomia.
nitraatti-ionin jokaisessa resonanssimuodossa on kaksi pi-elektronia, ja niitä jakaa vain kaksi atomia. Vain kahden atomin jakaman elektronin sanotaan olevan lokalisoitu. Näin nitraatti-ionin kunkin resonanssimuodon kaksi pi-elektronia ovat lokalisoituneet. Nitraatti-ionilla on hybridin edustamana kaksi pi-elektronia:
# elektroneja yhdessä pi-sidoksessa = 2
# elektroneja kolmessa niistä = 3 x (2/3) = 2
nitraatti-ionin kaksi pi-elektronia jaetaan yhteensä neljällä atomilla, yhdellä typpiatomilla ja kolmella happiatomilla. Useamman kuin kahden atomin jakaman elektronin sanotaan olevan delokalisoitunut. Näin nitraatti-ionin kaksi pi-elektronia delokalisoituvat. Nitraatti-ionin pi-elektronien delokalisoituminen edellyttää, että neljä atomia ovat samassa tasossa, mikä mahdollistaa niiden p-orbitaalien lateraalisen päällekkäisyyden.

Jos nitraatti-ionin energia olisi sen kolmen resonanssimuodon energioiden painotettu keskiarvo, aivan kuten nitraatti-ionin rakenne on sen kolmen resonanssimuodon rakenteiden painotettu keskiarvo, sen tulisi olla yhtä suuri kuin yhden kolmesta identtisestä resonanssimuodosta energia:

jos hybridin energia olisi yhtä suuri kuin resonanssimuodon energia, sillä kaikki kemialliset entiteetit (alkeishiukkaset, atomit, molekyylit jne.) on luonnollisesti taipumus olla mahdollisimman alhaisessa energiatilassa, nitraatti-Ionille ei olisi mitään etua olla olemassa hybridinä, vaan se voisi yksinkertaisesti olla olemassa resonanssimuotona. Koska nitraatti-ioni on olemassa hybridinä, ei resonanssimuotona, voidaan päätellä, että hybridin energia on pienempi kuin minkään resonanssimuodon.

resonanssiteorian mukaan silloin molekyylin energia on pienempi kuin matalaenergisen resonanssimuodon energia. Koska nitraatti-ionilla on pienempi energia ja se on siten vakaampi kuin millään resonanssimuodollaan, nitraatti-ionin sanotaan olevan resonanssistabiloitunut.
alkavien oppilaiden keskuudessa on kaksi harhaluuloa resonanssiteoriasta, jotka johtuvat todennäköisesti sanan resonanssi kirjaimellisesta tulkinnasta. Niitä kuvataan alla käyttäen esimerkkinä nitraatti-Ionia.
harhaluulo 1: Nitraatti-ioni esiintyy hetken resonanssimuodossa 1 ja muuttuu sitten joko resonanssimuodoksi 2 tai resonanssimuodoksi 3, joka konvertoituu eli palautuu muotoon 1.

nitraatti-ionin rakenne ei ole 1 eikä 2 eikä 3 vaan Hybridi eikä muutu ajan kanssa, ellei se käy läpi reaktiota.
harhaluulo 2: nitraatti-ionien otoksessa kolmasosa ioneista on tietyllä hetkellä resonanssimuodossa 1, toinen kolmasosa resonanssimuodossa 2 ja loput kolmannes resonanssimuodossa 3.

nitraatti-ionien näytteessä tietyllä hetkellä kaikilla ioneilla on sama rakenne eli Hybridi.
klassinen analogia, jota käytetään näiden kahden harhaluulon selventämiseen, on the mule (Morrison, R. T.; Boyd, R. N. Organic Chemistry, viides painos; Allyn and Bacon: Boston, 1987, pg. 373). Biologisesti muuli on hevosen ja aasin risteymä. Tämä ei tarkoita sitä, että muuli muistuttaa hetken hevosta ja muuttuu sitten aasin näköiseksi. Muulin ulkonäkö on yhdistelmä hevosen ja aasin ulkonäköä, eikä se muutu ajan myötä. Se ei myöskään merkitse sitä, että laumassa toiset muulit muistuttavat hevosta ja toiset Aasia. Laumassa kaikki muulit ovat samannäköisiä, mikä on hevosen ja aasin yhdistelmä. Tämän analogian heikkoutena on se, että hevosia ja aaseja on olemassa, kun taas resonanssimuodot ovat puhtaasti hypoteettisia. Morrisonin ja Boydin kirjassa mainittu parempi vertaus on sarvikuono. Sarvikuonon nähtyään sitä voisi kuvailla Lohikäärmeen ja yksisarvisen risteytykseksi, kahdeksi olennoksi, joita ei ole olemassa.
säännöt Resonanssimuotojen piirtämiseen
1. Resonanssimuodot ovat Lewisin diagrammeja, jotka perustuvat valenssisidosteoriaan.Niiden on siis noudatettava valenssisidosteorian perussääntöjä. Vedyllä voi siis olla enintään kaksi valenssielektronia; periodi-kahdella alkuaineella voi olla enintään kahdeksan valenssielektronia; alkuaineilla kolmannessa ja sitä alemmassa periodissa voi olla enemmän kuin kahdeksan valenssielektronia. esim: jokaisessa nitraatti-ionin resonanssimuodossa on kaksi alkuainetta, typpi ja happi, jotka ovat periodi-kaksi alkuainetta. Yhdessäkään nitraatti-ionin resonanssimuodossa ei ole enempää kuin kahdeksan valenssielektronia millään atomilla.
2. Kaikilla resonanssimuodoilla tulee olla sama sigma-sidoskehys, joka eroaa vain pi-elektronien ja bonenssielektronien sijainneissa. esim: nitraatti-ionin kaikilla kolmella resonanssimuodolla on sama sigma-sidoskehys:
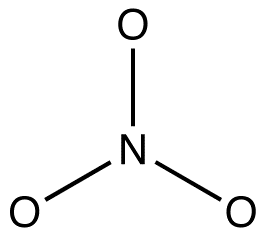
ne eroavat toisistaan vain pi-elektronien ja yksinäisten parien sijainneissa.
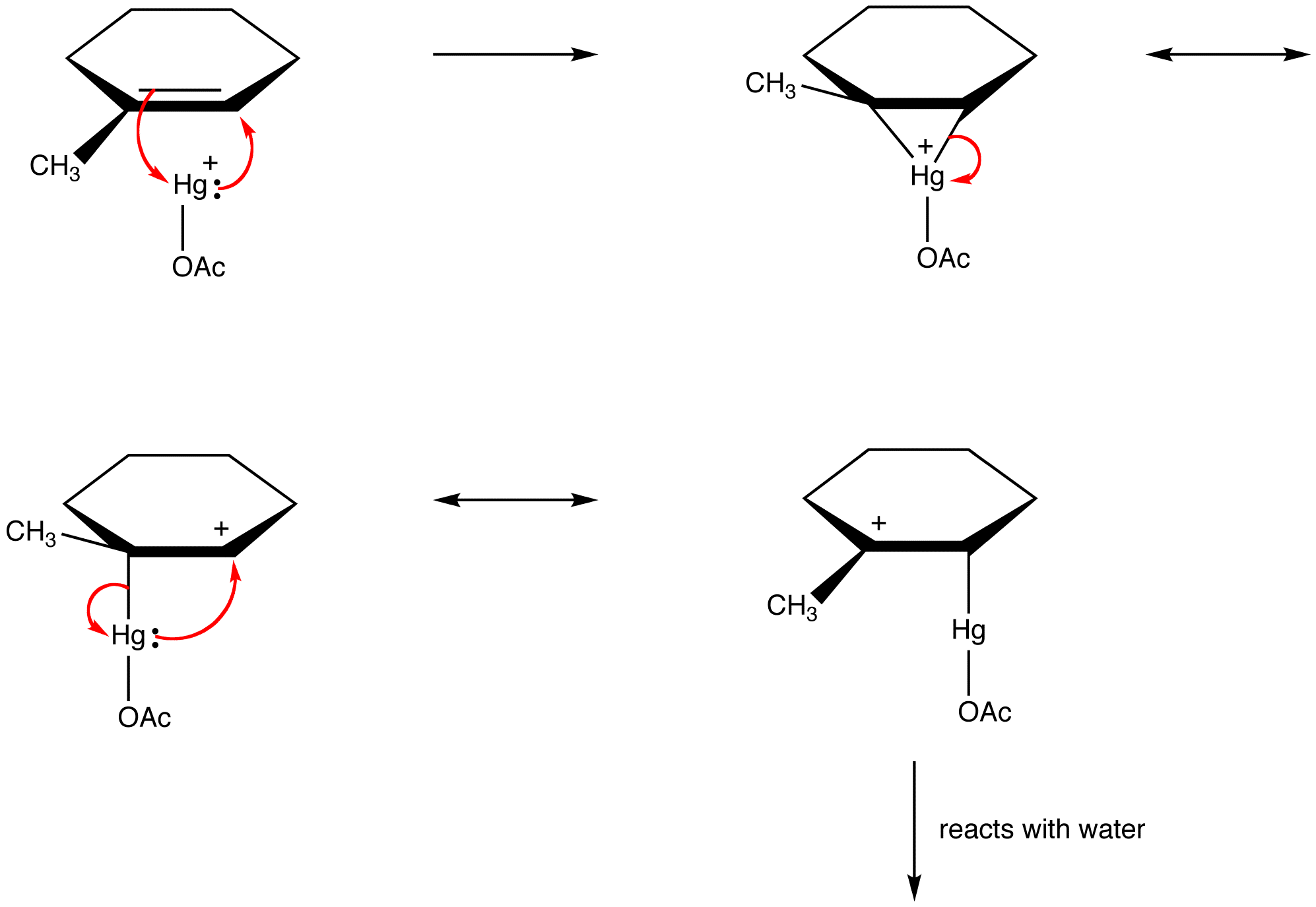
orgaaniset kemistit rikkovat yhä useammin tätä sääntöä selittääkseen reaktiivisten välituotteiden rakenteet resonanssistabiloituneina lajeina. esim: oksimerkuraatio
Resonanssimuotojen suhteellisen osuuden määrittäminen Hybridille
nitraatti-ionin kolme muotoa ovat identtiset ja siten stabiiliudeltaan samat. Näin ollen ne vaikuttavat yhtä lailla hybridiin. Useimpien resonanssistabiloituneiden molekyylien resonanssimuodot eroavat toisistaan, joten ne eivät edistä hybridiä tasapuolisesti. Mitä vakaampi resonanssimuoto on, sitä enemmän se vaikuttaa hybridiin. Näin ollen hybridin suhteellisen osuuden tai resonanssimuotojen määrittäminen edellyttää niiden suhteellisen stabiilisuuden määrittämistä. Käytä seuraavia sääntöjä resonanssimuotojen suhteellisen stabiilisuuden määrittämiseksi.
Sääntö 1:
resonanssimuoto, jossa kaikilla atomeilla on oktetti valenssielektroneja, on stabiilimpi kuin sellainen, jossa ainakin yhdellä atomilla ei ole. esim.:
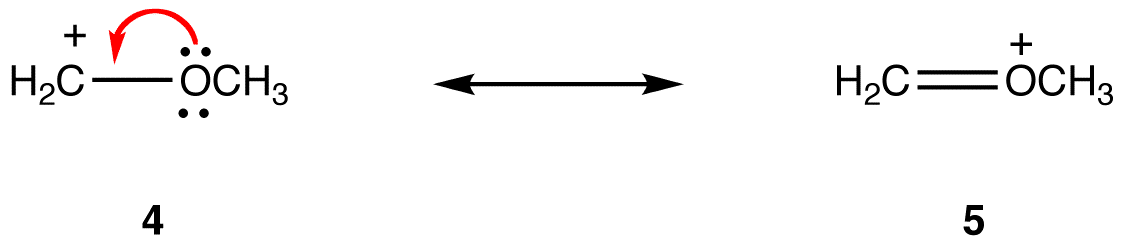
resonanssimuodossa 5 kaikilla atomeilla on oktetti valenssielektroneja; 4: ssä yksi atomi, jonka muodollinen varaus on +1, ei ole. Siten resonanssimuoto 5 on vakaampi kuin resonanssimuoto 4.
Sääntö 2:
kaiken muun ollessa yhtä suuri on resonanssimuoto, jolla on formaali negatiivinen varaus elektronegatiivisemmalla atomilla, stabiilimpi kuin sellainen, jolla on formaali negatiivinen varaus vähemmän elektronegatiivisella atomilla. esim.:
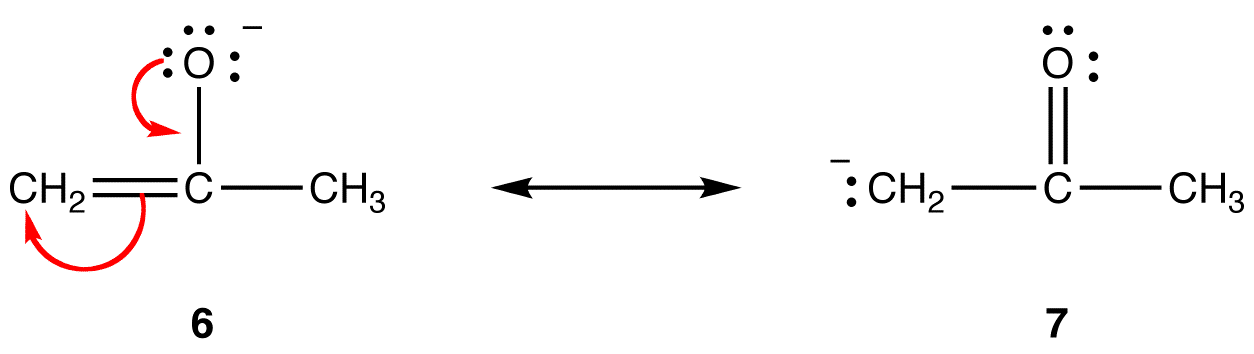
resonanssimuodossa 6 formaali negatiivinen varaus on happiatomilla; 7: ssä se on hiiliatomilla. Happi on elektronegatiivisempi kuin hiili. Siten resonanssimuoto 6 on vakaampi kuin resonanssimuoto 7.
suuntaus on päinvastainen muodollisten positiivisten maksujen osalta. Koska kaikki muu on yhtä suuri, resonanssimuoto, jolla on formaali positiivinen varaus vähemmän elektronegatiivisella atomilla, on stabiilimpi kuin sellainen, jolla on formaali positiivinen varaus elektronegatiivisemmalla atomilla. esim.:
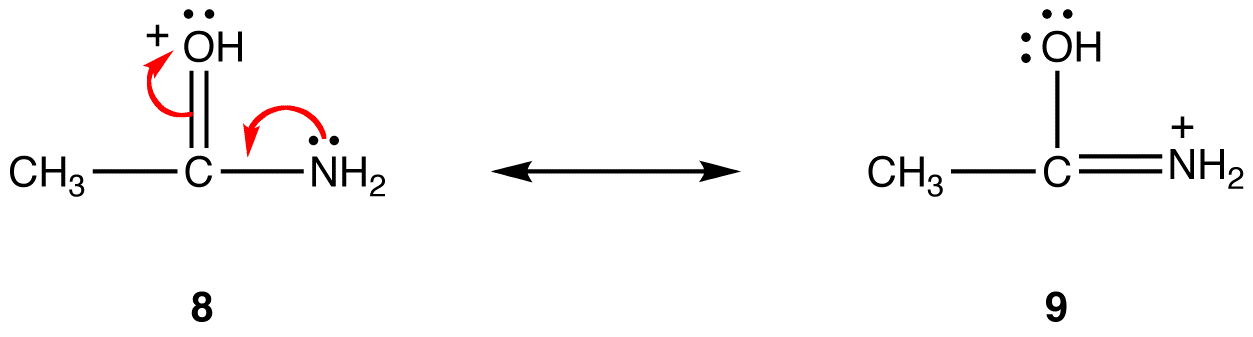
resonanssimuodossa 8 formaali positiivinen varaus on happiatomilla; 9: ssä se on typpiatomilla. Typpi on vähemmän elektronegatiivista kuin happi, joten resonanssimuoto 9 on vakaampi kuin resonanssimuoto 8.
Sääntö 3:
kaiken muun ollessa yhtä, resonanssimuoto, jolla ei ole varauserotusta, eli dipolaarinen resonanssimuoto, on stabiilimpi kuin sellainen, jolla on. eg:
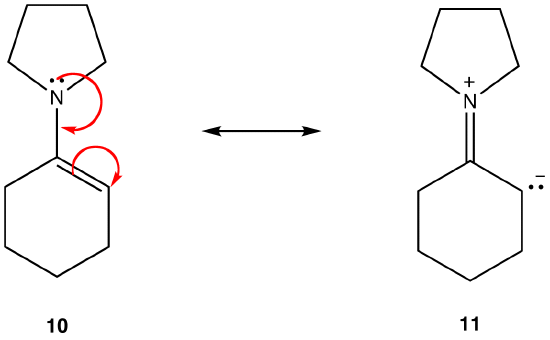
Resonanssimuoto 11 on dipolaarinen resonanssimuoto; 10 ei ole. Näin ollen 10 on vakaampi kuin 11. Tämä sääntö on seurausta Koloumbin lain vektorimuodosta, jonka mukaan vastakkaiset varaukset vetävät puoleensa. Tästä seuraa, että vastakkaisten varausten pitämiseksi erillään tarvitaan energiaa, eli 11: llä on suurempi energia kuin 10, joten 10 on stabiilimpi kuin 11: llä.
sääntö 4:
dipolaarisissa resonanssimuodoissa, joissa kaikki muu on yhtä suuri, mitä suurempi etäisyys toisistaan on, sitä vakaampi resonanssimuoto. eg:
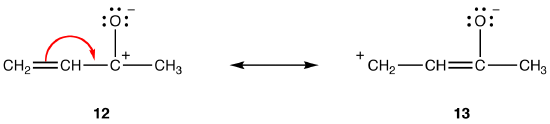
sekä resonanssimuodot 12 että 13 ovat dipolaarisia resonanssimuotoja. Erotettujen varausten välinen etäisyys on suurempi 13: ssa (kolme sidosta) kuin 12: ssa (yksi sidos), joten 13 on vakaampi kuin 12. Tämä sääntö on seurausta Koloumbin lain skalaarimuodosta, jonka mukaan vastakkaisten varausten välinen vetovoima on kääntäen verrannollinen niiden välisen etäisyyden neliöön. Näin ollen 12: ssa vastakkaisten varausten erottamiseen tarvittava energia on suurempi kuin 13: ssa, eli 12: ssa on suurempi energia kuin 13: ssa, joten 13 on stabiilimpi kuin 12: ssa.
edellä mainitut säännöt eivät välttämättä päde resonanssiin, jossa on mukana kolmannen ja sitä alhaisemman jakson alkuaineita, koska niiden valenssikuoreen mahtuu enemmän kuin kahdeksan elektronia. eg:
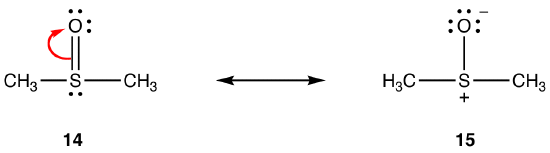
kaksoissidos 14: ssä koostuu sigma-sidoksesta ja sidoksesta, jotka muodostuvat happiatomin 2P-orbitaalin ja rikkiatomin tyhjän 3d-orbitaalin päällekkäisyyksistä. Näillä kahdella orbitaalilla on hyvin erilaiset energiat, koot ja muodot, joten niiden välinen päällekkäisyys, joka tunnetaan PN–dn-vuorovaikutuksena, on heikko. Näin ollen hybridissä rikki-happi-sidoksessa ei ole juurikaan kaksoissidosta, eli 15 on merkittävä resonanssimuoto.
Contributors and Attributions
- Gamini Gunawardena the Ochempal site (Utah Valley University)