yleisnimi: fluocinonide
annosmuoto: voide
Drugs.com. viimeksi päivitetty 22. joulukuuta 2020.
- yleiskatsaus
- sivuvaikutukset
- yhteisvaikutukset
- lisää
annostus Professional
Rx Only
Lidex-tuotenimen käyttö on lopetettu Yhdysvalloissa.jos FDA on hyväksynyt tämän tuotteen geneeriset versiot, saatavilla voi olla geneerisiä vastineita.
Lidex Description
lidex® (fluosinonidi) voide 0, 05% on tarkoitettu paikalliseen annosteluun. Vaikuttava aine on kortikosteroidi fluosinonidi,joka on fluosinoloniasetonidin 21-asetaattiesteri ja jonka kemiallinen nimi on pregna-1,4-dieeni-3,20-dioni, 21-(asetyylioksi)-6,9-difluori-11-hydroksi-16,17–, (6α,11β, 16α)-. Sen kemiallinen rakenne on seuraava:
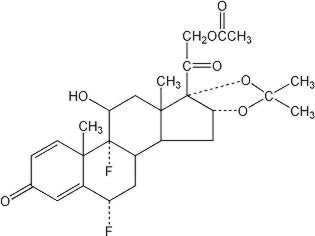
Lidex Voide sisältää fluosinonidia 0.5 mg / g erityisesti kehitetyssä voidepohjassa, joka koostuu glyseryylimonostearaatista, valkoisesta vaseliinista, propyleenikarbonaatista, propyleeniglykolista ja valkovahasta. Se tarjoaa okklusiiviset ja pehmentävät vaikutukset, jotka ovat suotavia voiteessa.
tässä formulaatiossa vaikuttava aine on täysin liuoksessa.
Lidex – Kliininen farmakologia
paikallisesti käytettävillä kortikosteroideilla on anti-inflammatorisia, anti-kutisevia ja vasokonstriktiivisia vaikutuksia.
paikallisesti käytettävien kortikosteroidien anti-inflammatorisen aktiivisuuden mekanismi on epäselvä. Eri laboratoriomenetelmiä, mukaan lukien vasokonstriktorimääritykset, käytetään paikallisesti käytettävien kortikosteroidien potenssien ja/tai kliinisen tehon vertailuun ja ennustamiseen. On jonkin verran näyttöä siitä, että vasokonstriktorisen tehon ja terapeuttisen tehon välillä ihmisellä on tunnistettava korrelaatio.
farmakokinetiikka
paikallisesti käytettävien kortikosteroidien imeytymisen laajuuteen vaikuttavat monet tekijät, kuten kantaja-aine, epidermaalisen esteen eheys ja okklusiivisten sidosten käyttö.
paikallisesti käytettävät kortikosteroidit voivat imeytyä normaalista ehjästä ihosta. Ihon tulehdus-ja / tai muut sairausprosessit lisäävät perkutaanista imeytymistä. Okklusiiviset sidokset lisäävät huomattavasti paikallisesti käytettävien kortikosteroidien perkutaanista imeytymistä. Siksi okklusiiviset sidokset voivat olla arvokas terapeuttinen lisä resistenttien ihosairauksien hoidossa (KS.annostus ja anto).
ihon läpi imeytyneenä paikallisesti annosteltavia kortikosteroideja käsitellään samankaltaisten farmakokineettisten reittien kautta kuin systeemisesti annosteltavia kortikosteroideja. Kortikosteroidit sitoutuvat plasman proteiineihin vaihtelevassa määrin. Kortikosteroidit metaboloituvat pääasiassa maksassa ja erittyvät sitten munuaisten kautta. Osa paikallisesti käytettävistä kortikosteroideista ja niiden metaboliiteista erittyy myös sappeen.
käyttöaiheet ja käyttö lidex
Lidex voide on tarkoitettu kortikosteroidille reagoivien dermatoosien tulehduksellisten ja kutisevien ilmenemismuotojen lievittämiseen.
vasta-aiheet
paikallisesti käytettävät kortikosteroidit ovat vasta-aiheisia potilaille, jotka ovat aiemmin olleet yliherkkiä jollekin valmisteen aineosalle.
varotoimet
yleinen
paikallisten kortikosteroidien systeeminen imeytyminen on aiheuttanut joillakin potilailla palautuvaa hypotalamus-aivolisäke-lisämunuaisakselin suppressiota, Cushingin oireyhtymän ilmenemismuotoja, hyperglykemiaa ja glukosuriaa.
systeemistä imeytymistä lisääviä tiloja ovat voimakkaampien steroidien käyttö, suurten pinta-alojen käyttö, pitkäaikainen käyttö ja okklusiivisten sidosten lisääminen.
siksi potilaat, jotka saavat suuren annoksen voimakasta paikallista steroidia, jota levitetään suurelle pinta-alalle tai okklusiivisen sidoksen alle, tulee arvioida määräajoin HPA-akselin suppression osoittamiseksi virtsattoman kortisolin ja ACTH: n stimulaatiotesteillä. Jos hPa-akselin tukahduttaminen havaitaan, on pyrittävä poistamaan lääke, vähentämään levitystiheyttä tai korvaamaan vähemmän voimakas steroidi.
HPA-akselin toiminnan palautuminen on yleensä nopeaa ja täydellistä lääkkeen käytön lopettamisen jälkeen. Harvoin, merkkejä ja oireita steroidien vieroitusoireita voi esiintyä, jotka vaativat täydentäviä systeemisiä kortikosteroideja.
lapset saattavat absorboida suhteessa suurempia määriä paikallisesti käytettäviä kortikosteroideja ja siten olla alttiimpia systeemiselle toksisuudelle (KS.varotoimet – lapsipotilaiden käyttö). Jos potilaalle kehittyy ärsytystä, paikallisesti käytettävien kortikosteroidien käyttö on lopetettava ja asianmukainen hoito aloitettava.
kuten minkä tahansa paikallisesti käytettävän kortikosteroidivalmisteen kohdalla, pitkäaikainen käyttö saattaa aiheuttaa ihon ja ihonalaiskudosten surkastumista. Kun sitä käytetään intertrigiinisille tai taipuisille alueille tai kasvoille, tämä voi tapahtua myös lyhytaikaisessa käytössä.
dermatologisten infektioiden yhteydessä tulee aloittaa sopivan antifungaalisen tai antibakteerisen aineen käyttö. Jos suotuisaa vastetta ei ilmene nopeasti, kortikosteroidihoito tulee keskeyttää, kunnes infektio on saatu riittävästi hallintaan.
tietoa
paikallisesti kortikosteroideja käyttäville potilaille tulee antaa seuraavat tiedot ja ohjeet:
- tätä lääkitystä tulee käyttää lääkärin ohjeiden mukaan. Se on tarkoitettu vain ulkoiseen käyttöön. Vältä kosketusta silmiin.
- potilaita tulee neuvoa olemaan käyttämättä tätä lääkitystä mihinkään muuhun häiriöön kuin siihen, johon se on määrätty.
- hoidettua ihoaluetta ei saa sitoa tai muuten peittää tai kääriä okklusiiviseksi, ellei lääkäri määrää.
- potilaiden tulee ilmoittaa paikallisista haittavaikutuksista, erityisesti okklusiivisessa sidoksessa.
- lapsipotilaiden vanhempia tulee neuvoa olemaan käyttämättä tiiviitä vaippoja tai muovihousuja lapselle, jota hoidetaan vaippaalueella, koska nämä vaatteet voivat muodostaa okkluusiositeitä.
laboratoriotestit
seuraavista testeistä voi olla hyötyä arvioitaessa HPA-akselin vaimennusta:
virtsasta vapaa kortisolitesti
ACTH-stimulaatiotesti
karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
pitkäaikaisissa eläinkokeissa ei ole arvioitu paikallisesti käytettävien kortikosteroidien karsinogeenisuutta tai vaikutusta fertiliteettiin.
prednisolonin ja hydrokortisonin mutageenisuutta selvittävistä tutkimuksista on saatu negatiivisia tuloksia.
Raskauskategoria C
kortikosteroidit ovat yleensä teratogeenisia koe-eläimillä, kun niitä annetaan systeemisesti suhteellisen pieninä annoksina. Tehokkaampien kortikosteroidien on osoitettu olevan teratogeenisiä ihon kautta annosteltaessa koe-eläimillä. Paikallisesti käytettävien kortikosteroidien teratogeenisista vaikutuksista ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Siksi paikallisesti käytettäviä kortikosteroideja tulee käyttää raskauden aikana vain, jos hoidon mahdollinen hyöty on suurempi kuin mahdollinen riski sikiölle. Tämän luokan lääkkeitä ei tule käyttää laajasti raskaana oleville potilaille, suuria määriä tai pitkiä aikoja.
imettävät äidit
ei tiedetä, johtaako kortikosteroidien paikallinen annostelu riittävään systeemiseen imeytymiseen, jotta äidinmaitoon kertyisi havaittavissa olevia määriä. Systeemisesti annettavia kortikosteroideja erittyy äidinmaitoon sellaisia määriä, joilla ei todennäköisesti ole haitallista vaikutusta lapseen. Varovaisuutta on kuitenkin noudatettava, kun imettäville naisille annetaan paikallisesti käytettäviä kortikosteroideja.
lapsipotilailla
lapsipotilailla saattaa olla suurempi alttius paikalliseen kortikosteroidien aiheuttamaan hypotalmisen aivolisäkkeen ja lisämunuaisen (hPa) akselin suppressioon ja Cushingin oireyhtymään kuin aikuisilla potilailla, koska ihon pinta-alan ja painon suhde on suurempi.
hPa-akselin suppressiota, Cushingin oireyhtymää ja kallonsisäistä hypertensiota on raportoitu paikallisesti käytettäviä kortikosteroideja saavilla lapsilla. Lisämunuaiskuoren suppression ilmentymiä lapsilla ovat lineaarinen kasvun hidastuminen, viivästynyt painonnousu, alhainen plasman kortisolitaso ja vasteen puuttuminen ACTH-stimulaatioon. Kallonsisäisen hypertension ilmenemismuodot ovat pullistuneet fontanellit, päänsärky ja molemminpuolinen papilledema.
paikallisesti annosteltavia kortikosteroideja tulisi antaa lapsille vain mahdollisimman vähän tehokkaan hoito-ohjelman mukaisesti. Krooninen kortikosteroidihoito voi häiritä lasten kasvua ja kehitystä.
haittavaikutukset
seuraavia paikallisia haittavaikutuksia on raportoitu harvoin paikallisesti käytettävien kortikosteroidien käytön yhteydessä, mutta niitä voi esiintyä useammin okklusiivisten sidosten käytön yhteydessä. Nämä reaktiot on lueteltu likimääräisesti alenevassa esiintymisjärjestyksessä.:
| Burning | Perioral dermatitis |
| Itching | Allergic contact dermatitis |
| Irritation | Maceration of the skin |
| Dryness | Secondary infection |
| Folliculitis | Skin atrophy |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Overdosage
Topically applied corticosteroids can be absorbed in sufficient amounts to produce systemic effects (see PRECAUTIONS).
lidex Annostus ja anto
lidex voide levitetään yleensä hoidettavalle alueelle ohuena kalvona kahdesta neljään kertaa päivässä riippuen tilan vakavuudesta.
Okkluusiosidoksia voidaan käyttää psoriaasin tai vastahakoisten sairauksien hoitoon.
jos infektio kehittyy, okklusiivisten sidosten käyttö tulee lopettaa ja aloittaa asianmukainen mikrobilääkitys.
miten Lidex: ää annetaan
lidex® (fluosinonidi) voide 0.05% on saatavilla
15 g putki –NDC 99207-514-13
30 g putki –NDC 99207-514-14
60 g putki –NDC 99207-514-17
120 g putki –NDC 99207-514-22
Säilytä huoneenlämmössä. Vältä yli 30°C: n (86°F) lämpötilaa.
U. S. Patent No. 4,017,615
valmistettu:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
by: Patheon, Inc.
Mississauga, Ontario
Canada L5N 7K9
IN-5070/S
| Lidex fluocinonide ointment |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – MEDICIS
Frequently asked questions
- Is it used for hair loss?
- What is a substitute for fluocinonide cream?
- Is fluocinonide an antifungal cream?
- How long should you use fluocinonide for?
- What is fluocinonide cream good for?
- voidaanko fluosinonidia käyttää Myrkkymuratti-ihottuman hoitoon?
- onko se steroidi?
- onko tämä antibiootti?
lisää lidexistä (fluosinonidin ajankohtainen)
- haittavaikutukset
- raskauden tai imetyksen aikana
- annostustiedot
- lääkkeiden yhteisvaikutukset
- 8 arviota
- yleinen saatavuus
- Lääkeluokka: ajankohtaiset steroidit
Consumer resources
Professional resources
muut merkit vanos, lidex-e
hoito-oppaat
- atooppinen ihottuma
- psoriaasi
ekseema dermatiitti
lääketieteellinen vastuuvapauslauseke