kovalenttisten yhdisteiden ominaisuudet
kun puhuimme Ioniyhdisteiden kiinteistä ioniyhdisteistä, huomasimme, että niiden ominaisuudet johtuvat usein vastakkaisten sähkövarausten voimakkaasta vetovoimasta. Ei pitäisi tulla yllätyksenä, että kovalenttisten yhdisteiden ominaisuudet johtuvat suurelta osin kovalenttisten sidosten luonteesta.
yksi tärkeimmistä kovalenttisista yhdisteistä on se, että ne eivät ole ionisia. Tämä vaikuttaa ilmeiseltä, mutta ero on itse asiassa hienovaraisempi kuin voit kuvitella. Tätä käsitettä havainnollistaa seuraava luku:
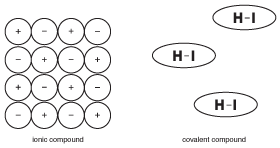
kuva 9.5 kiinteiden ioniyhdisteiden ominaisuudet perustuvat siihen, että monet ionit pysyvät lujasti paikoillaan sähkövoimien avulla. Kovalenttisten yhdisteiden molekyylit toimivat kuitenkin suhteellisen itsenäisesti naapurimolekyyleistä.
toisin kuin ioniyhdisteet, joissa kaikki suuren Kiteen ionit auttavat pitämään toisiaan koossa, kovalenttisen yhdisteen molekyylejä pitävät koossa ”intermolekulaarisiksi voimiksi” kutsutut voimat, jotka ovat paljon kemiallisia sidoksia heikompia (enemmän kiinteiden aineiden intermolekulaarisista voimista). Tämän seurauksena kovalenttisen yhdisteen molekyylit eivät vetäydy toisiinsa yhtä paljon kuin ioniyhdisteiden ionit. Tämä rakenneero on tärkeä kovalenttisten yhdisteiden ominaisuuksien ymmärtämisessä.
kovalenttisilla yhdisteillä on matalat sulamis-ja kiehumispisteet
kuten ioniyhdisteissä mainitaan, ioniyhdisteen sulamiseen tarvitaan suuri määrä energiaa, koska ionikiteessä kationien ja anionien väliset voimakkaat vuorovaikutukset ovat tärkeitä. Kovalenttisissa yhdisteissä kaikki molekyylit ovat kuitenkin sitoutuneet vain heikosti naapurimolekyyleihin; siksi kovalenttisten molekyylien erottamiseen toisistaan kuluu hyvin vähän energiaa.
monet aloittelevat kemian opiskelijat uskovat virheellisesti, että kovalenttisen molekyylin sulaessa kovalenttiset sidokset katkeavat. Tämä ei ole totta. Ioniyhdisteiden sulaessa ionien vetovoima pettää. Kovalenttisten yhdisteiden sulaessa molekyylit yksinkertaisesti vetäytyvät toisistaan jättäen sidokset ehjiksi.
kovalenttiset yhdisteet ovat huonoja johtimia
ioniyhdisteet ovat liuetessaan tai sulaessaan suuria sähkön johtimia. Kuten ioniyhdisteissä mainitaan, tämä johtuu siitä, että ioniyhdisteissä on liikkuvia ioneja, jotka kykenevät siirtämään sähkövarausta paikasta toiseen. Ne myös johtavat lämpöä erittäin hyvin, koska ionit ovat aivan vierekkäin, mikä mahdollistaa energian tehokkaan siirron paikasta toiseen.
kovalenttiset yhdisteet sen sijaan ovat lähes aina hyviä sekä sähkön että lämmön eristäjiä. Sähkö ei pysty toimimaan tehokkaasti kovalenttisten yhdisteiden läpi, koska sähkövarausta siirtäviä ioneja ei ole. Erinomainen esimerkki tästä on omassa talossa, jossa jatkojohtojen metalli on peitetty muovilla, jotta kissa ei saa sähköiskua. Lämpö ei myöskään kulje hyvin kovalenttisten yhdisteiden läpi, koska molekyylit eivät ole yhtä tiukasti kiinni toisissaan kuin ioniyhdisteen ionit, mikä tekee lämmönsiirrosta tehottomampaa. Tämän vuoksi otat keksit uunikintailla pois uunista sen sijaan, että peittäisit kätesi suolalla.
kovalenttiset yhdisteet joskus palavat
orgaaniset yhdisteet ovat kovalenttisia yhdisteitä, jotka sisältävät hiiltä. Niissä on yleensä myös vetyä. ja voi sisältää pienempiä määriä muita alkuaineita, kuten typpeä, rikkiä, fosforia, happea tai mitä tahansa halogeeneja.
monet kovalenttiset yhdisteet ovat syttyviä ja palavat helposti lämmön mukana. Palavien kovalenttisten yhdisteiden pääryhmää kutsutaan orgaanisiksi yhdisteiksi. Orgaaniset yhdisteet palavat, koska ne sisältävät hiiltä ja vetyä, jotka molemmat yhdistyvät mukavasti hapen kanssa korkeissa lämpötiloissa.
on tärkeää pitää mielessä, etteivät kaikki kovalenttiset yhdisteet pala?esimerkiksi vesi on kovalenttinen yhdiste ja sen kanssa on vaikea sytyttää tulta. Monet kovalenttisemmat kuin ioniyhdisteet ovat kuitenkin syttyviä.
syttyvyys on kovalenttisten yhdisteiden yleinen ominaisuus, koska suuri osa tunnetuista kovalenttisista yhdisteistä on orgaanisia. Koska useimmat orgaaniset yhdisteet palavat, voimme turvallisesti luetella tämän kovalenttisten yhdisteiden ominaisuudeksi, vaikka on olemassa monia kovalenttisia yhdisteitä, jotka eivät pala.
ote Ian Guchin teoksesta Complete Idiot ’ s Guide to Chemistry 2003. Kaikki oikeudet pidätetään, mukaan lukien kopiointioikeus kokonaan tai osittain missä tahansa muodossa. Käytetään järjestely Alpha Books, jäsen Penguin Group (USA) Inc.
Jos haluat tilata tämän kirjan suoraan kustantajalta, käy Penguin USA: n verkkosivuilla tai soita numeroon 1-800-253-6476. Voit myös ostaa tämän kirjan Amazon.com ja Barnes & Noble.