Chemguide: Ydinkemia 14-16
kaksois-ja kolmoissidokset
Tämä sivu esittelee mahdollisuuden useiden (kaksin-tai kolmoissidosten) kovalenttisiin sidoksiin atomien välillä hapen, typen, hiilidioksidin ja eteenin avulla esimerkkejä. Nämä valitaan, koska ne kaikki on yleisesti määritelty Britannian oppimäärissä 14-16-vuotiaille.
oletan, että olet lukenut kovalenttisen sidoksen esittelevän sivun ja sinulla on pääsy jaksolliseen järjestelmään, jollaisen voit ladata tältä sivustolta.
kaksoissidos hapessa
Jos happi tarkastellaan jaksollisesta järjestelmästä, havaitaan, että sen järjestysluku on 8 – Ja näin neutraalilla atomilla on 8 protonia ja 8 elektronia. Nämä järjestetään 2,6.
näin on kaksi atomia:
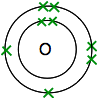
kummallakin on kaksi paritonta elektronia. Maksimaalisen energeettisen vakauden saavuttamiseksi kaikki nämä on yhdistettävä.
näin hapetuksella on kaksi elektroniparia:
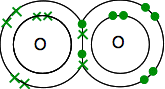
Tämä on paljon helpompi nähdä käyttämällä jaettujen elektronien pareja edustavia viivoja:
![]()
Kolmoisliitos typessä
Jos löydät typpi jaksollisessa järjestelmässä, voit selvittää, että sen elektroninen rakenne on 2,5. Verrattaessa sitä Happeen, sillä on siis yksi elektronipari ja kolme paritonta elektronia ulkoisella tasollaan.
jotta se olisi mahdollisimman energeettisesti stabiili, sen on paritettava nämä kaikki kovalenttisiksi sidoksiksi. Kaksi typpiatomia siis yhtyvät tällä tavalla:
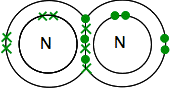
jälleen tämä on paljon helpompi nähdä käyttämällä janoja edustamaan pareittain jaettuja elektroneja:
![]()
kaksoissidos hiilidioksidi
hiilen elektronirakenne on 2,4 ja ulkotasolla 4 paritonta elektronia.
happi on 2,6, jossa on 2 elektroniparia ja 2 paritonta elektronia uloimmalla tasolla.
on päädyttävä siihen, että kaikki elektronit ovat pareittain – ja siihen on vain yksi keino.
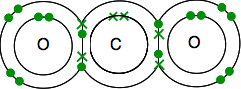
kuten aiemminkin, sidos on helpompi nähdä elektroniparien sidosrivien avulla.
![]()
Jos kahden atomin välillä on kaksi sidoselektroniparia, sitä kutsutaan, ei ihme, kaksoissidokseksi. Jokainen happi on siis liittynyt keskellä olevaan hiiliatomiin kaksoissidoksella.
kaksoissidokset eteenissä, C2H4
Eteenissä ja muissa vastaavissa yhdisteissä, joissa on kaksoissidoksia hiiliatomien välillä, ovat tärkeitä aineita kemiassa. Tapaat heidät tarkemmin myöhemmin kurssilla.
Katso tarkkaan dots-and-crosses-diagrammia ja varmista, että ymmärrät, miten kaikki sopii yhteen. Näin on oltava niin, että sekä hiilien että vetyjen kaikki yksittäiset elektronit ovat sidospareina.
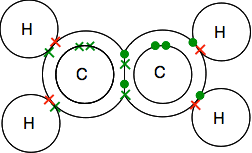
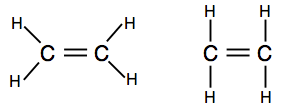
ensimmäinen osoittaa molekyylin todellisen muodon paremmin, mutta myös toinen on täysin hyväksyttävä tällä tasolla.
minne haluaisit nyt mennä?
tämän kohdan seuraavalle sivulle kovalenttisesta sidoksesta . . .
atomirakenne-ja liimausvalikkoon . . .
Kemi 14-16-menuun . . .
Chemguiden päävalikkoon . . .