mikä on ionisidos?
kemiallisia sidoksia muodostuu, kun sidottujen atomien kokonaisenergia on pienempi kuin erillisten atomien kokonaisenergia.Sidoksen saama muoto määräytyy elektronijärjestelyn avulla, joka minimoi energian.
joissakin tapauksissa elektronit jakautuvat atomien kesken – tätä kutsutaan kovalenttiseksi sidokseksi.
toisissa tapauksissa tapahtuu yhden tai useamman elektronin täydellinen siirto atomilta toiselle.Elektroneja kadottavasta atomista tulee positiivisesti varautunut ioni.Elektroneja vastaanottavasta atomista tulee negatiivisesti varautunut ioni.
Tämä johtaa ioniseen sidokseen-positiivisen ja negatiivisen keskinäinen sähköstaattinen vetovoima charges.In sen puhtain muoto, ioninen sidos ei ole suuntaava. Sitä voidaan pitää yksinkertaisena Coulombisena vetovoimana pistelatausten välillä.Tämä eroaa kovalenttisesta sidoksesta, jossa elektronien jakaminen johtaa suuntaaviin sidoksiin.
Elektroninsiirto
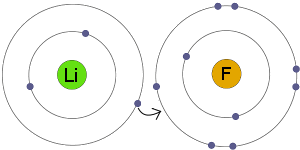
Li siirtää elektronin F: lle.ionit varautuvat sähköisesti ja niillä on täydelliset, vakaat elektronikuoret.
Sähköstaattinen vetovoima
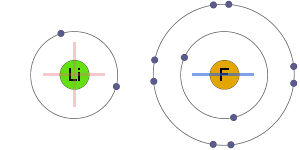
positiiviset ja negatiiviset ionit vetävät elektrostaattisesti puoleensa toisiaan, jolloin syntyy ionisidos.
coulombisella voimalla ei ole ensisijaista suuntaa, minkä vuoksi ioniyhdisteet esiintyvät yleensä toisiinsa pakattujen ionien jättiläismäisinä kidehilarakenteina.
näyte Litiumfluoridin Kidehilasta

elektronegatiivisuus ja ionisidos
kaksi alkuainetta pyrkii sitoutumaan ionisesti, kun ne eroavat toisistaan elektronegatiivisuudessaan suuresti.
elektronegatiivisuuden Jaksollinen järjestelmä
mitä vaaleampi vihreän sävy, sitä korkeampi elektronegatiivisuus. Harmaa tarkoittaa, ettei arvoa tiedetä. (Klikkaa kuvaa saadaksesi suuremman näkymän.)

kovalenttinen Sidosmerkki
ehdottoman puhtaita ionisidoksia ei ole oikeasti olemassa, koska positiivisesti varautunut ioni polarisoi negatiivisen ionin elektronipilven.Tämä on erityisen havaittavissa käsiteltäessä pieniä, voimakkaasti varautuneita metalli-ioneja kuten Al3+, vaikka polarisoiva vaikutus on jossain määrin läsnä kaikissa ioniyhdisteissä.Polarisaatio on käytännössä suuntaava, elektronin jakava vaikutus, joten se tuo ioniyhdisteisiin pienen määrän kovalenssia.
ionisen / kovalenttisen käyttäytymisen osuutta sidoksessa voidaan arvioida hyvin karkeasti elektronegatiivisuuden Pauling-asteikolla.Linus Pauling arvioi, että alkuaineiden välinen elektronegatiivisuusero 1,7 johtaa 50 prosentin ionisoitumiseen.
arvot alle 1 vastaavat kovalenttista sidosta dominoivaa ja arvot yli 2 ionista sidosta dominoivaa.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
c-H-sidos, jonka erotus on 0,35, on kovalenttinen, kun taas NaCl-sidos 2,23: ssa on ioninen.HCl-sidos 0,96: ssa on polaarinen kovalenttinen ja LiI-sidos 1,68: ssa on 50/50 ioninen/kovalenttinen.
suurin elektronegatiivisuusero on 3,19, cesiumin (0,79) ja fluorin (3,98) välillä. Syntyvä sidos on luonteeltaan noin 95-prosenttisesti ioninen.
