oppimistavoitteet
tämän osion loppuun mennessä voit:
- tutkia lämmönsiirtoa.
- laske lopullinen lämpötila lämmönsiirrosta.
tähän mennessä on keskusteltu lämmönsiirron aiheuttamasta lämpötilan muutoksesta. Lämpötilan muutosta ei tapahdu lämmönsiirrosta, jos jää sulaa ja muuttuu nestemäiseksi vedeksi (eli faasimuutoksen aikana). Ajatellaanpa esimerkiksi auringon lämmittämälle katolle sulavista jääpuikoista valuvaa vettä. Vastaavasti vesi jäätyy alempilämpöisen ympäristön jäähdyttämässä jäälautasessa.

kuva 1. Ilman lämpö siirtyy jäähän aiheuttaen sen sulamisen. (luotto: Mike Brand)
kiinteän aineen sulamiseen tarvitaan energiaa, koska kiinteän aineen molekyylien väliset koossapitävät sidokset on katkaistava siten, että nesteessä molekyylit voivat liikkua toisiaan vastaavilla kineettisillä energioilla; näin ollen lämpötila ei nouse. Samoin nesteen höyrystämiseen tarvitaan energiaa, koska nesteessä olevat molekyylit vuorovaikuttavat keskenään houkuttelevien voimien välityksellä. Lämpötilan muutosta ei tapahdu ennen kuin faasimuutos on valmis. Soodakupin lämpötila aluksi 0ºC: ssa pysyy 0ºC: ssa, kunnes kaikki jää on sulanut. Vastaavasti energiaa vapautuu jäätymisen ja tiivistymisen aikana, yleensä lämpöenergiana. Työtä tekevät koossapitävät voimat, kun molekyylit tuodaan yhteen. Vastaava energia on annettava pois (haihtunut), jotta ne pysyvät yhdessä Kuvio 2.
faasimuutokseen liittyvä energia riippuu kahdesta päätekijästä: sidosten tai voimaparien lukumäärästä ja voimakkuudesta. Sidosten lukumäärä on verrannollinen molekyylien määrään ja siten näytteen massaan. Voimien voimakkuus riippuu molekyylityypistä. Massaisen m näytteen faasin muuttamiseen tarvittava lämpö Q saadaan kaavalla
Q = MLF (sulaminen/jäätyminen,
Q = MLV (höyrystyminen/tiivistyminen),
missä fuusiolämpö LF ja latentti höyrystymislämpö LV ovat ainevakioita, jotka määritetään kokeellisesti. KS. (Taulukko 1).

kuva 2. (a) energiaa tarvitaan, jotta kiinteän aineen molekyylien väliset puoleensavetävät voimat voidaan osittain voittaa nesteen muodostamiseksi. Sama energia on poistettava, jotta jäätyminen tapahtuu. (b) molekyylit erotetaan toisistaan suurilla etäisyyksillä siirryttäessä nesteestä höyryyn, mikä vaatii huomattavaa energiaa molekyylien vetovoiman voittamiseksi. Sama energia on poistettava, jotta tiivistyminen tapahtuu. Lämpötilan muutosta ei tapahdu ennen kuin faasimuutos on valmis.
Latenttilämpö mitataan yksikköinä J / kg. Sekä Lf että Lv riippuvat aineesta, erityisesti sen molekyylivoimien vahvuudesta, kuten aiemmin todettiin. Lf: ää ja Lv: tä kutsutaan yhdessä latenttilämpökertoimiksi. Ne ovat piileviä eli piilossa, koska faasimuutoksissa energia tulee systeemiin tai lähtee siitä aiheuttamatta systeemissä lämpötilan muutosta, joten energia on itse asiassa piilossa. Taulukossa 1 luetellaan Lf: n ja Lv: n edustavat arvot sekä sulamis-ja kiehumispisteet.
taulukko osoittaa, että faasimuutoksiin liittyy merkittäviä määriä energiaa. Tarkastelkaamme esimerkiksi sitä, kuinka paljon energiaa tarvitaan sulattamaan kilogramma jäätä 0ºC: ssa tuottaaksemme kilogramma vettä 0°C: ssa.käyttämällä yhtälöä lämpötilan muutokselle ja veden arvolle taulukosta 1 huomaamme, että Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ on kilon jään sulattamiseen tarvittava energia. Tämä on paljon energiaa, koska se edustaa samaa energiamäärää, jota tarvitaan 1 kg nestemäisen veden lämpötilan nostamiseen 0ºC: sta 79,8 ºC: een. Veden höyrystämiseen tarvitaan vielä enemmän energiaa; tarvittaisiin 2256 kJ, jotta 1 kg nestemäistä vettä muuttuisi normaalissa kiehumispisteessä (100ºc ilmanpaineessa) höyryksi (vesihöyryksi). Tämä esimerkki osoittaa, että faasimuutoksen energia on valtava verrattuna energiaan, joka liittyy lämpötilan muutoksiin ilman faasimuutosta.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Otetaan esimerkiksi se, että ilman lämpötila nousee kosteassa ilmastossa harvoin yli 35,0 ºC: n, mikä johtuu siitä, että suurin osa lämmönsiirrosta menee haihduttavaan veteen ilmaan. Vastaavasti kosteassa säässä lämpötila laskee harvoin kastepisteen alapuolelle, koska vesihöyryn tiivistyessä vapautuu valtavasti lämpöä.
tutkimme faasimuutoksen vaikutuksia tarkemmin harkitsemalla lämmön lisäämistä -20ºc: n jäänäytteeseen (kuva 3). Jään lämpötila nousee lineaarisesti, absorboiden lämpöä tasaisella nopeudella 0,50 cal/g º ºC, kunnes se saavuttaa 0ºC: n. Tässä lämpötilassa jää alkaa sulaa, kunnes kaikki jää on sulanut ja imee itseensä 79,8 cal/g lämpöä. Tämän faasimuutoksen aikana lämpötila pysyy vakiona 0ºC: ssa. Kun kaikki jää on sulanut, nestemäisen veden lämpötila nousee, absorboiden lämpöä uudella vakionopeudella 1,00 cal / g º ºC. 100ºc: ssa vesi alkaa kiehua ja lämpötila pysyy jälleen vakiona, kun vesi absorboi 539 cal/g lämpöä tämän faasimuutoksen aikana. Kun kaikki neste on muuttunut höyryksi, lämpötila nousee jälleen ja absorboi lämpöä nopeudella 0,482 cal / g º ºC.
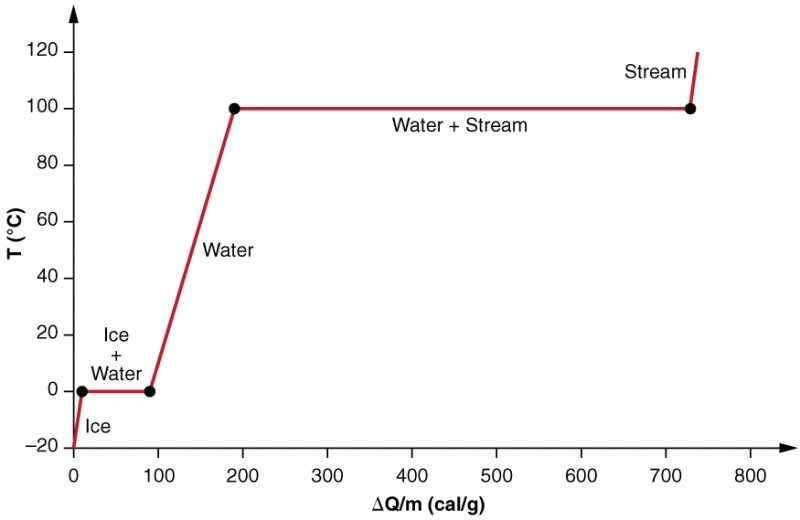
kuva 3. Kaavio lämpötilasta ja lisätystä energiasta. Järjestelmä on rakennettu niin, että mikään höyry ei höyrysty jään lämmetessä nestemäiseksi vedeksi, ja niin, että höyrystymisen tapahtuessa höyry jää systeemiin. Tasaisten lämpötilojen pitkät osuudet 0ºC: ssa ja 100ºC: ssa heijastavat vastaavasti sulamisen ja höyrystymisen suurta latenttilämpöä.
vesi voi haihtua alle kiehumispisteen lämpötiloissa. Tarvitaan enemmän energiaa kuin kiehumispisteessä, koska vesimolekyylien liike-energia alle 100ºC: n lämpötilassa on pienempi kuin 100ºc: n lämpötilassa, joten satunnaisista lämpöliikkeistä saadaan vähemmän energiaa. Otetaanpa esimerkiksi se, että kehon lämpötilassa ihon hikoilu vaatii 2428 kJ/kg lämpöä, joka on noin 10 prosenttia suurempi kuin latentti höyrystymislämpö 100ºC: ssa. Tämä lämpö tulee iholta ja tarjoaa siten tehokkaan viilennysmekanismin kuumalla säällä. Korkea ilmankosteus estää haihtumista, niin että ruumiinlämpö saattaa nousta, jolloin otsallesi ei jää kertynyttä hikeä.
Esimerkki 1. Laske lopullinen lämpötila Faasimuutoksesta: Jäähdytyslimsaa, jossa on jääpaloja
kolme jääkuutiota, käytetään jäähdyttämään sooda 20ºC: ssa massalla msoda = 0,25 kg. Jää on 0ºC ja jokaisen jääkuution massa on 6,0 g. Oletetaan, että sooda pidetään vaahtoastiassa, jotta lämpöhäviö voidaan jättää huomiotta. Oletetaan, että soodalla on sama lämpökapasiteetti kuin vedellä. Etsi lopullinen lämpötila, kun kaikki jää on sulanut.
strategia
jääkuutioiden sulamislämpötila on 0ºC. Lämpö siirretään soodasta jäähän sulamista varten. Jään sulaminen tapahtuu kahdessa vaiheessa: ensin tapahtuu faasimuutos ja kiinteä (jää) muuttuu sulamislämpötilassa nestemäiseksi vedeksi, sitten tämän veden lämpötila nousee. Sulaminen tuottaa vettä 0ºC: ssa, joten soodasta siirtyy enemmän lämpöä tähän veteen, kunnes vesi plus sooda − järjestelmä saavuttaa termisen tasapainon, Qice = – Qsoda.
jäähän siirtyvä lämpö on
Qice = mice LF + micecW(TF−0ºC).
soodan aiheuttama lämpö on qsoda = msodacW(Tf−20ºC). Koska lämpöä ei häviä, qice = −Qsoda, niin että
hiiret Lf + micecW(TF−0ºC) = –msodacW(Tf−20ºC).
tuo kaikki termit, joissa Tf on vasemmalla puolella ja kaikki muut termit oikealla puolella. Ratkaise tuntemattomalle määrälle Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
liuos
- tunnista tunnetut määrät. Jään massa on hiiriä = 3 × 6,0 g = 0,018 kg ja soodan massa msoda = 0,25 kg.
- laske termit osoittajassa: m sodacW(20ºC)=(0,25 kg)(4186 J/kg º ºC)(20ºC) = 20,930 J ja miceLf = (0,018 kg)(334,000 J/kg) = 6012 J.
- laske nimittäjä: (msoda + hiiret)cW = (0,25 kg + 0.018 kg) (4186 K/(kg º ºC) = 1122 J/ºC.
- laske lopullinen lämpötila: \displaystyle{T}_{\text{F}}=\frac{20,930\text{ j}-6012\text{ J}}{1122\text{ j/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Discussion
Tämä esimerkki havainnollistaa vaihemuutoksen aiheuttamat valtavat energiat. Jään massa on noin 7 prosenttia veden massasta, mutta johtaa huomattavaan muutokseen soodan lämpötilassa. Vaikka oletimme jään olevan pakkasen puolella, tämä ei pidä paikkaansa: tyypillinen lämpötila on -6 astetta. Tämä korjaus antaa kuitenkin lopullisen lämpötilan, joka on olennaisesti sama kuin löytämämme tulos. Osaatko selittää miksi?

kuva 4. Tiivistymistä lasilliseen jääteetä. (luotto: Jenny Downing)
olemme nähneet, että höyrystyminen vaatii lämmön siirtymistä ympäristöstä nesteeseen, jolloin energia vapautuu ympäristöstä. Tiivistyminen on käänteinen prosessi, joka nostaa ympäristön lämpötilaa. Lisäys voi tuntua yllättävältä, sillä yhdistämme kondensaation kylmiin esineisiin—esimerkiksi kuvassa olevaan lasiin. Tiivistyvistä molekyyleistä on kuitenkin poistettava energiaa, jotta höyry tiivistyy. Energia on täsmälleen sama kuin mitä tarvitaan faasimuutoksen tekemiseen toiseen suuntaan, nesteestä höyryksi, joten se voidaan laskea Q = mLv.
tiivistymistä muodostuu Kuvassa 4, koska läheisen ilman lämpötila laskee kastepisteen alapuolelle. Ilma ei pysty pidättämään yhtä paljon vettä kuin huoneenlämmössä,joten vesi tiivistyy. Energia vapautuu, kun vesi tiivistyy, mikä nopeuttaa jään sulamista lasissa.
reaalimaailman sovellus
energiaa vapautuu myös nesteen jäätyessä. Floridan hedelmänviljelijät käyttävät tätä ilmiötä appelsiinien suojaamiseen, kun lämpötila on lähellä jäätymispistettä (0ºC). Viljelijät suihkuttavat vettä hedelmätarhojen kasveille niin, että vesi jäätyy ja lämpöä vapautuu puissa kasvaville appelsiineille. Tämä estää appelsiinin sisällä olevaa lämpötilaa putoamasta pakkasen puolelle, mikä vahingoittaisi hedelmää.

kuva 14.11. Näiden puiden jää vapautti jäätyessään suuria määriä energiaa, mikä osaltaan esti puiden lämpötilaa laskemasta alle 0 asteen. Vettä suihkutetaan tahallaan hedelmätarhoille kovien pakkasten ehkäisemiseksi. (luotto: Hermann Hammer)
sublimaatio on siirtymistä kiinteästä höyryfaasiin. Olet ehkä huomannut, että lumi voi kadota ilmaan ilman jälkeäkään nestemäisestä vedestä tai jääpalojen katoaminen pakastimeen. Myös päinvastainen on totta: pakkasta voi muodostua hyvin kylmiin ikkunoihin ilman, että se menee nestevaiheen läpi. Suosittu ilmiö on ”savun” tekeminen kuivajäästä, joka on kiinteää hiilidioksidia. Sublimaatio tapahtuu, koska kiinteiden aineiden tasapainohöyrynpaine ei ole nolla. Tietyt ilmanraikastajat käyttävät kiinteän aineen sublimaatiota ruiskuttaakseen huoneeseen hajuvettä. Koipallot ovat lievästi myrkyllinen esimerkki fenolista (orgaanisesta yhdisteestä), joka sublimoituu, kun taas jotkut kiinteät aineet, kuten osmiumtetroksidi, ovat niin myrkyllisiä, että niitä on pidettävä suljetuissa astioissa, jotta ihmiset eivät altistuisi sublimaation tuottamille höyryille.

kuva 5. Suorat siirtymät kiinteän ja höyryn välillä ovat yleisiä, joskus hyödyllisiä ja jopa kauniita. a) kuivajää sublimoituu suoraan hiilidioksidikaasuksi. Näkyvä höyry koostuu vesipisaroista. (luotto: Windell Oskay) (B) Frost muodostaa kuvioita hyvin kylmään ikkunaan, esimerkkinä kiinteästä, joka on muodostunut suoraan höyrystä. (luotto: Liz West)
kaikkiin faasitransitioihin liittyy lämpöä. Suorissa kiinteän höyryn siirtymissä tarvittava energia saadaan yhtälöstä Q = mLs, jossa Ls on sublimaation lämpö, joka on muutokseen tarvittava energia 1.00 kg ainetta kiinteästä faasista höyryfaasiin. Ls on analoginen Lf: n ja Lv: n kanssa, ja sen arvo riippuu aineesta. Sublimaatio vaatii energiansyöttöä, jolloin kuivajää on tehokas jäähdytysaine, kun taas käänteinen prosessi (eli kuorrutus) vapauttaa energiaa. Sublimaatioon tarvittava energiamäärä on samaa suuruusluokkaa kuin muissakin faasitransitioissa.
tässä ja sitä edeltävässä jaksossa esitetystä materiaalista voidaan laskea mikä tahansa lämpötila-ja faasimuutoksiin liittyvä vaikutus. Kussakin tapauksessa on tarpeen määrittää, missä lämpötilassa ja faasissa tapahtuu muutoksia, ja sitten soveltaa asianmukaista yhtälöä. Muista, että lämmönsiirto ja työ voivat aiheuttaa sekä Lämpötila-että vaihemuutoksia.
Ongelmanratkaisustrategiat lämmönsiirron vaikutuksille
- tarkastelevat tilannetta määrittääkseen, että lämpötilassa tai faasissa on muutos. Siirtyykö lämpö järjestelmään vai siitä pois? Kun faasimuutoksen esiintyminen tai puuttuminen ei ole ilmeistä, haluat ehkä ensin ratkaista ongelman ikään kuin faasimuutoksia ei olisi, ja tutkia saatu lämpötilan muutos. Jos riittää, että pääset yli kiehumis—tai sulamispisteestä, sinun pitäisi sitten palata ja tehdä ongelma vaiheittain-lämpötilan muutos, faasimuutokset, myöhempi lämpötilan muutos ja niin edelleen.
- Tunnista ja luetteloi kaikki kappaleet, jotka muuttavat lämpötilaa ja vaihetta.
- tunnista tarkasti, mitä ongelmassa on selvitettävä (tunnista tuntemattomat). Kirjallinen luettelo on hyödyllinen.
- Tee lista siitä, mitä annetaan tai mitä ongelmasta voidaan päätellä (tunnista knowns).
- ratkaise sopiva yhtälö määritettävälle suureelle (tuntematon). Jos lämpötila muuttuu, siirretty lämpö riippuu ominaislämmöstä (KS.Taulukko 1 kohdassa lämpötilan muutos ja lämpökapasiteetti), kun taas faasimuutoksessa siirretty lämpö riippuu latentista lämmöstä. Katso Taulukko 1.
- korvaa knownit yksikköineen sopivaan yhtälöön ja saadaan numeeriset ratkaisut täydellisinä yksiköinä. Sinun tulee tehdä tämä vaiheittain, jos prosessissa on useampi kuin yksi vaihe (kuten lämpötilan muutos, jota seuraa vaihemuutos).
- tarkista, onko vastaus järkevä: onko siinä järkeä? Esimerkiksi, Varmista, että lämpötilan muutos ei aiheuta myös faasimuutosta, jota et ole ottanut huomioon.
Tarkista ymmärryksesi
miksi lumi jää vuorenrinteille silloinkin, kun päivälämpötilat ovat pakkasasteita korkeampia?
liuos
lumi muodostuu jääkiteistä ja on siten veden kiinteä faasi. Koska faasimuutoksiin tarvitaan valtavasti lämpöä,kestää jonkin verran aikaa, että tämä lämpö kertyy ilmasta, vaikka ilma olisi yli 0ºC. Mitä lämpimämpää ilma on, sitä nopeammin tämä lämmönvaihto tapahtuu ja sitä nopeammin lumi sulaa.
Sektion Yhteenveto
- useimmat aineet voivat esiintyä joko kiinteinä, nestemäisinä ja kaasumaisina, joita kutsutaan ”faaseiksi.”
- Faasimuutoksia tapahtuu määrätyssä lämpötilassa tietylle aineelle tietyssä paineessa, ja näitä lämpötiloja kutsutaan kiehumis-ja jäätymispisteiksi (tai sulamispisteiksi).
- faasimuutosten aikana absorboitunut tai vapautunut lämpö ilmoitetaan seuraavasti: Q = mL, jossa L on latentin lämpökerroin.
käsitteelliset kysymykset
- lämmönsiirto voi aiheuttaa lämpötila-ja faasimuutoksia. Mikä muu voi aiheuttaa nämä muutokset?
- miten veden fuusioitumisen piilevä lämpö auttaa hidastamaan ilman lämpötilan laskua ja kenties estämään lämpötilan laskemisen merkittävästi alle ºC: n suurten vesistöjen läheisyydessä?
- mikä on jään lämpötila heti jäätyneen veden muodostuttua?
- Jos laitat ºC-jäätä ºC-veteen eristetyssä astiassa, mitä tapahtuu? Sulaako osa jäästä, jäätyykö lisää vettä vai jäätyykö kumpaakaan?
- miten jäävesilasiin tiivistyminen vaikuttaa jään sulamisnopeuteen? Nopeuttaako tiivistyminen sulamisprosessia vai hidastaako se sitä?
- hyvin kosteassa ilmastossa, jossa on lukuisia vesistöjä, kuten Floridassa, on epätavallista, että lämpötila nousee yli 35 asteen (95ºF). Aavikoilla lämpötila voi kuitenkin nousta paljon tätä korkeammalle. Selitä, miten veden haihtuminen auttaa rajoittamaan korkeita lämpötiloja kosteassa ilmastossa.
- talvisin San Franciscossa on usein lämpimämpää kuin läheisessä Sacramentossa 150 kilometriä sisämaahan päin. Kesäisin Sacramentossa on lähes aina kuumempaa. Selitä, miten San Franciscoa ympäröivät vesimassat kohtuullistavat sen äärimmäisiä lämpötiloja.
- kannen laittaminen kiehuvan kattilan päälle vähentää huomattavasti lämmönsiirtoa, joka on tarpeen sen pitämiseksi kiehuvana. Selitä miksi.
- pakastekuivattuja elintarvikkeita on kuivattu tyhjiössä. Prosessin aikana ruoka jäätyy ja sitä on kuumennettava nestehukan helpottamiseksi. Selitä sekä miten tyhjiö nopeuttaa kuivumista että miksi ruoka jäätyy sen seurauksena.
- kun tyyni ilma jäähtyy säteilemällä yöllä, on epätavallista, että lämpötila laskee kastepisteen alapuolelle. Selitä miksi.
- fysiikan luokkahuoneen demonstraatiossa ohjaaja paisuttaa ilmapallon suun kautta ja jäähdyttää sen sitten nestemäisessä typessä. Kylmässä kutistuneessa pallossa on pieni määrä vaaleansinistä nestettä sekä joitakin lumimaisia kiteitä. Lämmetessään neste kiehuu, ja osa kiteistä sublimoituu, ja jotkin kiteet viipyvät jonkin aikaa ja tuottavat sitten nestettä. Tunnista sininen neste ja kaksi kiintoainetta kylmässä ilmapallossa. Perustele tunnistamisesi taulukon 1 tietojen avulla.
Problems &harjoitukset
- kuinka paljon lämmönsiirtoa (kilokaloreina) tarvitaan sulattamaan 0,450 kilon paketti pakastevihanneksia alun perin 0ºC: ssa, jos niiden fuusiolämpö on sama kuin veden?
- pussi, jossa on 0ºC jäätä, absorboi energiaa paljon tehokkaammin kuin pussi, jossa on sama määrä 0ºC vettä. (a) kuinka paljon lämmönsiirtoa tarvitaan 0.800 kg: n veden lämpötilan nostamiseksi 0ºC: sta 30.0 ºC: een? (b) kuinka paljon lämmönsiirtoa tarvitaan ensin sulamaan 0.800 kg 0ºC jäätä ja sitten nostaa sen lämpötilaa? C) selitä, miten vastauksesi tukee väitettä, että jää on tehokkaampaa.
- (a) kuinka paljon lämmönsiirtoa tarvitaan nostamaan 2,50 kg vettä sisältävän 0,750 kg: n alumiinipannun lämpötila 30,0 ºC: sta kiehumispisteeseen ja keittämään sitten pois 0,750 kg vettä? b) Kuinka kauan tämä kestää, jos lämmönsiirtonopeus on 500 W 1 watt = 1 joule/sekunti (1 W = 1 J/s)?
- jäätikkövesilasiin muodostuva tiivistyminen saa jään sulamaan nopeammin kuin muuten. Jos 8.00 g tiivistymistä muodostuu lasi sisältää sekä vettä ja 200 g jäätä, kuinka monta grammaa jäätä sulaa seurauksena? Oletetaan, ettei muuta lämmönsiirtoa tapahdu.
- Reissussa huomaa, että 3,50 kilon jääpussi kestää kylmälaukussa keskimäärin vuorokauden. Mikä on keskimääräinen teho watteina, kun jää alkaa 0ºC: sta ja sulaa kokonaan 0ºC: n vedeksi tasan yhden päivän aikana 1 watt = 1 joule/sekunti (1 W = 1 j/s)?
- tiettynä kuivana aurinkoisena päivänä uimahallin lämpötila nousisi 1,50 ºC, ellei haihdutusta olisi. Minkä osan vedestä täytyy haihtua kuljettaakseen pois juuri sen verran energiaa, että lämpötila pysyy vakiona?
- (a) kuinka paljon lämmönsiirtoa tarvitaan 0,200 kg painavan jääkappaleen lämpötilan nostamiseksi -20 ° C: sta 130 ° C: seen, mukaan lukien faasimuutoksiin tarvittava energia? (b) kuinka paljon aikaa tarvitaan kussakin vaiheessa, olettaen vakio 20.0 kJ/s lämmönsiirtonopeus? (C) tee kuvaaja lämpötila vs. aika tämän prosessin.
- vuonna 1986 Rossin jäähyllystä Etelämantereella irtosi jättimäinen jäävuori. Se oli noin 160 kilometriä pitkä suorakulmio, 40.0 km leveä ja 250 m paksu. a) Mikä on tämän jäävuoren massa, kun otetaan huomioon, että jään tiheys on 917 kg/m3? b) kuinka paljon lämmönsiirtoa (jouleina) tarvitaan sen sulattamiseksi? c) kuinka monta vuotta pelkästään auringonvalolta kuluisi näin paksun jään sulattamiseen, jos jää imee itseensä keskimäärin 100 W/m2, 12,00 h päivässä?
- kuinka monta grammaa kahvia on haihdutettava 350 grammasta 100 gramman lasikuppiin, jotta kahvi jäähtyy 95,0 ºC-45,0 ºC: sta? Voidaan olettaa, että kahvilla on samat lämpöominaisuudet kuin vedellä ja että keskimääräinen höyrystymislämpö on 2340 kJ/kg (560 cal/g). (Saatat laiminlyödä kahvin massan muutoksen sen jäähtyessä, jolloin saat hieman oikeaa suuremman vastauksen.)
- (a) raakaöljytankkerin tulipalon sammuttaminen on vaikeaa, koska jokainen litra raakaöljyä vapauttaa palaessaan 2,80 × 107 J energiaa. Tämän vaikeuden havainnollistamiseksi lasketaan niiden vesilitrojen määrä, jotka on kulutettava 1,00 litraa raakaöljyä polttamalla vapautuvan energian absorboimiseksi, jos veden lämpötila on noussut 20,0 ºC: sta 100ºC: een, se kiehuu ja tuloksena oleva höyry nostetaan 300ºc: een. B) keskustellaan lisäkomplikaatioista, jotka johtuvat siitä, että raakaöljyn tiheys on pienempi kuin veden.
- ukkosmyrskyissä tiivistymisestä vapautuva energia voi olla hyvin suuri. Laske ilmakehään vapautuva energia 1 km säteiselle pienelle myrskylle olettaen, että 1,0 cm sadetta sataa tasaisesti tällä alueella.
- hallavaurioiden ehkäisemiseksi hedelmäpuuhun suihkutetaan 4,00 kg 0ºC vettä. a) kuinka paljon lämpöä siirtyy veden jäätyessä? b) kuinka paljon 200-kiloisen puun lämpötila laskisi, jos tämä määrä lämpöä siirtyisi puusta? Ominaislämmön on oltava 3,35 kJ / kg * ºC ja oletettava, että faasimuutoksia ei tapahdu.
- 0,250 kg painava alumiinikulho, jossa on 0,800 kg keittoa 25,0 ºC: ssa, laitetaan pakastimeen. Mikä on lopullinen lämpötila, jos kulhosta ja keitosta siirtyy 377 kJ energiaa olettaen, että keiton lämpöominaisuudet ovat samat kuin veden?
- 0,0500 kg: n jääkuutio -30,0 ºC: ssa asetetaan 0,400 kg: n painoiseen 35,0 ºC: n veteen erittäin hyvin eristetyssä astiassa. Mikä on lopullinen lämpötila?
- jos kaadat 0.0100 kg 20.0 ºC: n vettä 1.20 kg: n painoiseen jäälohkareeseen (joka on aluksi -15.0 ºC: ssa), mikä on lopullinen lämpötila? Voit olettaa, että vesi jäähtyy niin nopeasti, että ympäristövaikutukset ovat mitättömiä.
- alkuperäiskansat kokkaavat joskus vesitiiviissä koreissa laittamalla kuumia kiviä veteen, jotta se kiehuisi. Mikä 500ºc: n kivimassa on sijoitettava 4.00 kg: aan 15.0 ºC: n vettä, jotta sen lämpötila saadaan 100ºc: seen, jos 0.0250 kg vettä karkaa höyrynä alkuperäisestä hellepäivästä? Saatat laiminlyödä ympäristön vaikutukset ja pitää kallioiden keskimääräistä ominaislämpöä graniittina.
- mikä olisi pannun ja veden lopullinen lämpötila laskettaessa lopullista lämpötilaa, kun lämpöä siirretään kahden kappaleen välillä: kaatamalla kylmää vettä kuumalla pannulla, jos pannuun laitettiin 0,260 kg vettä ja 0,0100 kg vettä haihtui välittömästi, jolloin jäljelle jäänyt tulisi yhteiseen lämpötilaan pannun kanssa?
- joissakin maissa maitoautoissa käytetään nestemäistä typpeä mekaanisten jääkaappien sijaan. 3.00 tunnin toimitusmatka vaatii 200 litraa nestemäistä typpeä, jonka tiheys on 808 kg/m3. (A) Laske tämän nestemäisen typen määrän haihduttamiseen tarvittava lämmönsiirto ja nosta sen lämpötila 3,00 ºC: een. (Käytä cp: tä ja oleta, että se on vakio lämpötila-alueella.) Tämä arvo on nestemäisen typen jäähdytyksen määrä. b) mikä on tämä lämmönsiirtonopeus kilowattitunteina? C) vertaa jäähdytyksen määrää, joka saadaan sulattamalla identtinen 0ºC jään massa nestemäisen typen haihduttamiseen.
- jotkut aseharrastajat valmistavat omat luotinsa, joihin kuuluu lyijyluotien sulattaminen ja valaminen. Kuinka paljon lämmönsiirtoa tarvitaan lämpötilan nostamiseen ja 0,500 kg lyijyn sulamiseen alkaen 25,0 ºC: sta?
sanasto
sublimaatiolämpö: energia, joka tarvitaan aineen muuttamiseen kiinteästä faasista höyryfaasiin
latenttilämpökerroin: fysikaalinen vakio, joka vastaa siirtyvän lämmön määrää jokaista aineen 1 kg kohti aineen faasin muutoksen aikana
sublimaatio: siirtyminen kiinteästä faasista höyryfaasiin
valitut ratkaisut ongelmiin & harjoitukset
1. 35, 9 kcal
3. (a) 591 kcal; (b) 4, 94 × 103 S
5. 13, 5 W
7. (a) 148 kcal; (b) 0, 418 s, 3, 34 s, 4, 19 s, 22, 6 S, 0, 456 s
9. 33, 0 g
10. a) 9,67 L; b) raakaöljy on vettä tiheämpää, joten se kelluu veden päällä ja altistaa sen siten ilman hapelle, jota se käyttää palamiseen. Lisäksi, jos vesi on öljyn alla, se absorboi vähemmän tehokkaasti öljyn tuottamaa lämpöä.
12. (A) 319 kcal; b)2, 00 ºC
14. 20, 6 ºC
16. 4, 38 kg
18. (a) 1, 57 × 104 kcal; (b) 18, 3 kW ⋅ h; (c) 1, 29 × 104 kcal
- arvot, jotka on mainittu normaalissa sulamis-ja kiehumislämpötilassa vakioilmanpaineessa (1 atm). ↵
- 37, 0 ºC: ssa (kehon lämpötila) veden höyrystymislämpö LV on 2430 kJ/kg tai 580 kcal/kg ↵
- veden höyrystymislämpö LV on 2430 kJ/kg tai 580 kcal/kg ↵