A Microbial Biorealm page on the genus Enterococcus faecalis
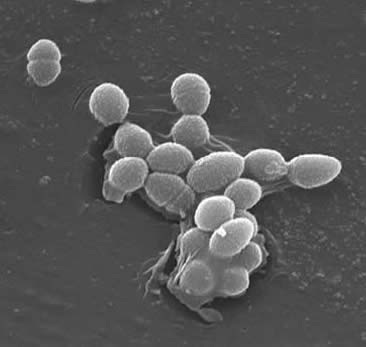
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
laji
Enterococcus faecalis
kuvaus ja merkitys
enterokokit ovat grampositiivisia kokkeja, jotka voivat selvitä luonnon ankarissa olosuhteissa. Niitä voi löytää maaperästä, vedestä ja kasveista. Joitakin kantoja käytetään elintarvikkeiden valmistuksessa, kun taas toiset ovat syynä vakaviin ihmisten ja eläinten infektioihin (esim.niiden tiedetään asuttavan ihmisen maha-ja sukuelimiä). Ne liittyvät sekä yhteisö-että sairaalainfektioihin. Enterokokit voivat kasvaa 10-42°C: n lämpötilassa ja ympäristöissä, joiden pH-arvot ovat laajat. Joidenkin tiedetään olevan liikkumattomia. Enterococcus-suvun lajeja on yli 15, mutta kliinisistä isolaateista 80-90% on E. faecalis (8). Enterokokit muodostavat tyypillisesti lyhyitä ketjuja tai ovat järjestäytyneet pareittain. Tietyissä kasvuolosuhteissa ne kuitenkin venyvät ja näyttävät kokkobasiileilta. Yleensä enterokokit ovat alfa-hemolyyttisiä. Joillakin on D-ryhmän Lancefield-antigeeni, ja ne voidaan havaita monoklonaalisilla vasta-ainepohjaisilla agglutinaatiotesteillä.Enterokokit ovat tyypillisesti katalaasinegatiivisia ja anaerobisia. Ne pystyvät kasvamaan 6,5% NaCl: ssä, voivat hydrolysoida eskuliinia 40%: n sappisuolojen läsnä ollessa ja ovat pyrrolidonyyliaryyliamidaasi ja leusiiniaryyliamidaasi positiivisia (8). Enterokokit ovat osoittautuneet terapeuttiseksi haasteeksi, koska ne ovat vastustuskykyisiä monille mikrobilääkkeille, ”mukaan lukien soluseinän aktiiviset aineet; aminoglykosidit, penisilliini ja ampisilliini ja vankomysiini” (1). Enterokokit pystyvät hankkimaan monenlaisia mikrobilääkeresistenssitekijöitä, jotka aiheuttavat vakavia ongelmia enterokokki-infektiopotilaiden hoidossa (8). Yleensä enterokokki-isolaatit, joiden herkkyys vankomysiinille on alentunut, voidaan luokitella Vana, vanB ja vanC. vana ja vanB ovat suurin uhka, koska ne ovat vastustuskykyisimpiä ja resistenssigeenit kulkeutuvat plasmidiin. Koska resistenssigeenit kulkeutuvat plasmidissa, ne ovat helposti siirrettävissä, E. faecalis voi siirtää näitä plasmideja konjugaatiolla (2). E. faecalis on myös resistentti teikoplaniinille. Vankomysiiniriippuvaisia enterokokkikantoja on löydetty, mutta ne ovat harvinaisia ja harvinaisempia kuin vankomysiinille resistentit kannat (joista käytetään nimitystä ”vankomysiinille resistentit enterokokit” tai ”VRE”) (1).
genomin rakenne

monien kansanterveydellisten vaarojen vuoksi Enterokokkikannan genomisekvenssitiedot olivat välttämättömiä. Genomin DNA-sekvensointiin valittu kanta oli E. faecalis V583, ensimmäinen vankomysiinille vastustuskykyinen isolaatti Yhdysvalloissa. Kannan v583 genomin sekvensoi Institute for Genome Research (TIGR). Enterokokin genomi osoittaa E. faecalis on metabolisesti monipuolinen ja sisältää laajan valikoiman säätelyjärjestelmiä. Kanta V583 sisältää neljä DNA-molekyyliä: 3 218 030 emäsparin bakteerikromosomi ja kolme ympyränmuotoista plasmidia. Kromosomissa on noin 3 500 avointa lukukehystä (ORF), joista noin 1/3: lla ei ole luovutettavaa toimintoa (8). Kolme plasmidia ovat kehämäisiä DNA-molekyylejä, jotka tunnistetaan plasmidi-1: ksi, plasmidi-2: ksi ja plasmidi-3: ksi. Plasmidi-1 sisältää 66 320 bp, plasmidi-2 sisältää 17 963 bp ja plasmidi-3 sisältää 57 660 BP. Plasmidit koodaavat useita geenejä, kuten transposaaseja, monilääkeresistenssiproteiineja ja ppGpp-säädeltyä kasvun estäjää (8). E. faecalis-kromosomin keskimääräinen g + c-koostumus on 37,38%. Koska DNA-molekyyli on niin suuri, tapahtuu alueellisia poikkeamia keskiarvosta. Yksi näistä paikoista on suuri segmentti liittyy ”vankomysiiniresistenssigeenin klusterin sijoitettu lähelle 2.22 Mb,” osoittaa suurta kasvua prosenttia G + C pitoisuus (8). Nämä antibioottiresistenssiin tai virulenssiin liittyvät erot viittasivat vieraslajin geneettisen materiaalin hankkimiseen horisontaalisella siirrolla. Vielä ei tiedetä, johtuvatko siirrot DNA: n rakenteen vaihteluista. E. faecalis V583 auttaa suuresti ymmärtämään, miten organismi on sopeutunut monipuoliseksi ihmisen patogeeniksi. Vertailevan genomiikan avulla eri säätelyelementtien merkitys ymmärretään paremmin siinä, miten ne reagoivat erilaisiin ympäristöjännityksiin ja mahdollisten virulenssitekijöiden ilmentymiseen (8). Lisää tutkimuksia, kuten nämä ehdottaa uusia lääkkeitä bakteeri-infektioiden aiheuttama enterokokit.Genomi sisältää myös 3 Ebp (koodaus endokardiitin biofilmiin liittyvälle pilille) operonia, jotka ovat tärkeitä E. faecaliksen og1rf-kannan biofilmituotannolle. Tämä kanta käyttää näitä operoneja tuottamaan pintapilejä. . Pintapilejä käytetään ”isäntäpintojen kiinnittämiseen ja ne ovat antigeenisiä ihmisillä endokardiitin aikana” (9).
TIGR sisältää täydellisen luettelon E. faecaliksen kromosomien geeneistä.
solujen rakenne ja aineenvaihdunta
solujen aineenvaihdunta
enterokokit elävät ankarissa ympäristöissä, kuten ihmisten ja eläinten suolistoissa. Kasvu näissä vihamielisissä olosuhteissa edellyttää, että E. faecalis on aineenvaihdunta, joka on joustava. E. faecalis kykenevät paitsi käymisen tuottamaan maitohappoa, myös ”katabolisoimaan energianlähteiden spektrin hiilihydraateista, glyserolista, laktaatista, malaatista, sitraatista, diamino-hapoista ja manya-ketohapoista” (3).on osoitettu, että valituissa kasvuolosuhteissa E. faecalis voi parantaa kasvua oksidatiivisen fosforylaation avulla käyttäen protonimotiivista voimaa, joka perustuu elektronikuljetukseen. Seurauksena ”orastava hengitys on voimakkaiden hapettimien tuotantoa” (esim.superoksidi ja vetyperoksidi), oksidatiivista stressiä E. faecalis voi sietää (3). Tämän stressin sietokyky yhdistettynä muihin vaikeisiin kasvuolosuhteisiin mahdollistaa E. faecaliksen kasvun 10-45°C: ssa sappisuoloina sekä erittäin alhaisessa ja korkeassa pHs: ssä. Lisäksi E. faecalis voi vastustaa atsidia, pesuaineita, raskasmetalleja ja etanolia. Koska E. faecalis voi hyödyntää erilaisia sokerilähteitä se voi elää erilaisissa ympäristöissä, erityisesti suolistossa, jossa ravinteita on vähän (2). Suolistossa E. faecalis saa suurimman osan energiastaan imeytymättömien sokerien käymisestä. E. faecalis voi saada energiaa myös hajottamalla mucins, hiilihydraatti, joka on voimakkaasti glykosyloitu ja tuottaa suoliston pikarisolut (2).E. faecalis käyttää ”fosfoenolipyruvaattifosfotransferaasijärjestelmää (PTS) aistiakseen sokerit solun ulkopuolella ja parittaakseen sokerien oton fosforylaatiolla” (2). Näin menetellään vähemmän energiaa (ATP) verrattuna siihen, miten sokeria kertyy ei-PTS-järjestelmiin. E. faecaliksen metaboloimia sokereita ovat muun muassa D-glukoosi, D-fruktoosi, laktoosi, maltoosi (kaikki PTS-substraatteja). Enterokokeissa PTS säätelee myös glyserolin metaboliaa, indusoijien karkottamista ja kataboliittien tukahduttamista (8). E. faecalis on yksi harvoista alhaisen G + C-pitoisuuden grampositiivisista bakteereista, jotka karkottavat sokeria glukoosin kasvun aikana.ilmiö tunnetaan induktorikarkotuksena (8). E. faecalis voi jopa käydä glyserolia aerobisissa ja mikroaerofillisissa olosuhteissa. E. faecalis voi kasvaa myös glyserolissa anaerobisissa olosuhteissa, koska se ”ilmaisee geenin nad+ – linkitetylle anaerobiselle glyserolidehydrogenaasiaktiivisuudelle” (8). Glyseroli voi ylittää solukalvon käyttämällä proteiinia nimeltä glyserolin diffuusiofilitaattori (glpf). GlpF tekee glyserolin pitoisuudesta solun sisä-ja ulkopuolella yhtä suuren, proteiinia estää glykolyysi. E. faecalis pystyvät elämään äärimmäisen emäksisessä pH: ssa ja korkeassa suolapitoisuudessa. Nämä ominaisuudet vaativat kationikuljetuksen, jotta homeostaasille välttämätön sytosolinen ionikoostumus pysyy vakiona. Kaikki solut on karkottaa liikaa natriumia ylläpitää sytosolipitoisuudet alueella, joka suosii homeostaasin. E. faecalis ilmaisee sekä Na + / H + antiporteria että vacuolar-tyyppistä Atpaasia (2). Kalium on merkittävä solunsisäinen kationi. Kaliumpitoisuus sisällä E. faecalis 0,4 – 0,6 M on välttämätöntä normaalin solun aineenvaihduntaa, se ”neutraloi solunsisäisiä anioneja, aktivoi erilaisia entsyymejä, ja säätelee sytosolinen pH” (8). E. faecalis ilmaisee vähintään kaksi kaliumin kuljettajaa, ktri ja Ktri, sekä Kep-järjestelmän k+ – ekstruusiota varten (8). Vaikka tiedetään, että ktri ja Ktri ovat k+ – kertymäjärjestelmiä (ne ovat K+/H+ symporttereita), proteiineista tiedetään vain vähän enemmän.
solurakenne
enterokokit ovat grampositiivisia kokkeja, jotka tyypillisesti muodostavat lyhyitä ketjuja tai ovat järjestyneet pareiksi (3). Tietyissä kasvuolosuhteissa ne voivat venyä ja näyttää kokkobakteereilta. E. faecaliksen soluseinä on 20-38% kuivasolun painosta (eksponentiaalisissa ja stationäärifaasisoluissa). Koska E. faecalis on grampositiivinen bakteeri on kolme pääkomponenttia, jotka muodostavat sen soluseinä: peptidoglykaani, teikhappo ja polysakkaridi. Soluseinästä 40% koostuu peptidoglykaanista ja loput soluseinästä ”ramnoosia sisältävästä polysakkaridista ja ribitolia sisältävästä teikhoehaposta” (3). Peptidioglykaani toimii (kuten useimmissa Grampositiivisissa soluissa) vastustamaan suuren sytoplasmamaisen osmoottisen paineen aiheuttamaa halkeamista. E. faecalista pidetään yleensä kapseloimattomana organismina, mikä ilmenee ”havaittavan limaisen fenotyypin puuttumisesta” (3). E. faecalis-isolaattien osajoukoilla on kuitenkin kapsulaarinen polysakkaridi. E. faecalis voi vaihtaa geneettistä materiaalia (plasmideja) pienten peptidiferomonien (2) indusoimilla konjugaatioprosesseilla. Pintaproteiini ”aggregaatioaineet, jotka tunnistavat tietyn ligandin vastaanottajasoluissa” takaavat onnistuneet konjugaatiokytkennät (2).E. faecaliksella on myös kyky tehdä pintapilejä, jotka voivat johtaa biofilmin muodostumiseen. Endokardiittia aiheuttavat E. faecalis-kannat sisältävät suuria määriä näitä pilejä. Pili mahdollistaa kiinnittymisen isäntäpintoihin (esim.sydänkudokseen). E. faecalis jotka aiheuttavat endokardiitti tuottaa ”biofilm huomattavasti useammin ja myös suuremmassa määrin kuin ei-endokardiitti isolaatit” (9).
ekologia
E. faecalis on hyvin monimuotoinen Enterokokkilaji. Se on vuorovaikutuksessa monien muiden eliöiden kanssa ja vaikuttaa ympäristöön. Enterokokit kuuluvat ihmisen paksusuolessa elävään bakteerikuntaan. Ne ovat luonnollinen osa suolistoflooraa myös useimmilla muilla nisäkkäillä ja linnuilla (8). Enterokokkeja on myös maaperässä, kasveissa ja vedessä. Kun niitä löytyy vedestä, se johtuu tyypillisesti siitä, että vesi oli saastunut ulosteesta. Vaikka E. faecalis ei esiinny liian usein kasveissa, muita Enterokokkikantoja on löydetty kasveista ja niitä esiintyy todennäköisimmin saastuneessa vesilähteessä (8).Antibioottiresistenssin ja virulenssin geeninsiirron ekologiaa ympäristössä ei vielä tunneta kovin hyvin. Lahoavassa orgaanisessa aineksessa kehittyvät hyönteiset, kuten huonekärpäset (HF), voivat siirtää antibiooteille vastustuskykyisiä bakteereja eläinten lannasta ja muista lahoavista orgaanisista alustoista asuinympäristöihin (7). HF ovat täydellisiä lähettäjiä, koska elävät mikrobiyhteisöt esiintyvät elinympäristöissä, joissa ne kehittyvät (esim.ulosteet). Hyviä siirtoominaisuuksia lisää tapa, jolla HF ruokkii poikasiaan (regurgitaatio) ja niiden vetovoima ihmisravintoon. Koska HF voi lentää pitkiä matkoja, tämä hyönteinen on erittäin hyvä levittämään ulosteperäisiä bakteereja, mukaan lukien ihmisten ja eläinten taudinaiheuttajia ja mahdollisesti antibiooteille vastustuskykyisiä enterokokkeja (7). Tuoreessa tutkimuksessa seulottiin antibioottiresistenssiä ja Virulenssigeenejä HF: n Enterokokeista kanasasin pikaruokaravintoloissa. Tämä tutkimus osoitti, että” ruoan käsittely-ja tarjoilupaikoissa olevat huonekärpäset voivat kantaa antibiooteille vastustuskykyisiä ja mahdollisesti virulentteja enterokokkeja, joilla on kyky siirtää antibioottiresistenssigeenejä horisontaalisesti muihin bakteereihin ” (7).Vaikutukset, jotka E. faecalis on ympäristöön yleensä enemmän kielteisiä. Ne saastuttavat tyypillisesti vesivarastoja, jotka voivat johtaa tartunnan saaneisiin kasveihin sekä ihmisten infektioihin (8). Antibioottitekijöitä voivat kuljettaa myös erilaiset hyönteiset (esim.huonekärpäset) ja eläimet, jolloin virulentin E. faecalis-bakteerin määrä kasvaa.
patologia
enterokokit ovat nousseet merkittäväksi sairaalainfektioiden aiheuttajaksi, ja tässä ryhmässä Enterococcus faecalis aiheuttaa suurimman osan ihmisen enterokokki-infektioista. Nämä infektiot voivat olla paikallisia tai systemaattisia ja sisältävät virtsateiden ja vatsan infektiot, haavainfektiot, bakteremia, ja endokardiitti (2). Koska E. faecalis pystyvät selviytymään lukuisista ympäristöhaasteista (kuten äärimmäisistä lämpötiloista ja sappisuolojen esiintymisestä) ja koska ne voivat hankkia vastustuskyvyn useille antibiooteille, näistä bakteereista on tullut merkittävä terveysongelma. Kansallisen Nosocomial Infection Surveillance-järjestelmän (Nnis) mukaan vankomysiinille resistenttien enterokokkien (VRE) aiheuttamat infektiot ovat lisääntyneet vuodesta 1989 (1). Tämä voi tarkoittaa vakavia terveysongelmia, joihin kuuluu VRE-infektioihin käytettävissä olevan antibioottihoidon puute, koska useimmat VRE-kannat ovat vastustuskykyisiä vankomysiinin lisäksi useille antibiooteille (esim.aminoglyskoidit ja ampisilliini). Vanokmysiinille resistenttien geenien siirtyminen VRE: stä muihin grampositiivisiin patogeeneihin on vakava kansanterveydellinen huolenaihe. Yleisin tapa, että E. faecalis aiheuttaa infektion tapahtuu sairaalassa/pitkäaikaishoidon laitos on tartunnan E. faecalis potilaiden välillä (8). Enterokokkeja voidaan kuljettaa terveydenhuollon työntekijöiden käsissä ja niitä voidaan kuljettaa (siirtää) potilaalta toiselle. On osoitettu, että VRE käsissä voi kestää jopa 60 minuuttia (8). Siirto terveydenhuollon työntekijän käsistä potilaaseen voisi tapahtua, kun potilas joutuu kosketuksiin suonensisäisten tai virtsakatetrien kanssa. Peräsuolen lämpömittarit, joita ei ole puhdistettu kunnolla käytön jälkeen, voivat siirtää VRE: tä myös potilaalta toiselle. Joskus siirto voi johtaa potilaan ruoansulatuskanavan kolonisaatioon hankitun kannan kanssa. Uudesta kannasta tulee osa potilaan endogeenistä kasvistoa (8). Hankittu kanta, joka kantaa antibioottiresistenssigeenejä, pystyy elämään ruuansulatuskanavassa. Infektioita syntyy sitten näistä vastikään hankituista E. faecalis-kannoista.E. faecalis voi aiheuttaa monia infektioita ihmiskehossa. Yleisin enterokokkien aiheuttama infektio on virtsatieinfektio. E. faecalis voi aiheuttaa alempien virtsateiden infektioita (UTI), kuten kystistä, eturauhastulehdusta ja lisäkivestulehdusta (8). E. faecalis löytyy myös vatsa -, lantio -, ja pehmytkudostulehduksia. E. faecalis voi aiheuttaa bakteremiaa. Lähde bakteremia on useimmiten virtsateiden, esiintyy tartunnan laskimoon katetri. Endokardiitti on vakavin enterokokki-infektio, sillä se aiheuttaa sydänläppätulehduksen. Monissa tapauksissa endokardiitti, antibioottihoito epäonnistuu ja leikkaus poistaa tartunnan venttiili on tarpeen (8). Harvinaisempia E. faecaliksen aiheuttamia infektioita ovat aivokalvontulehdus, hematogeeninen, osteomyeliitti, septinen niveltulehdus ja (hyvin harvoin) keuhkokuume. Koska enterokokit ovat vastustuskykyisiä monille antibiooteille, näiden infektioiden hoito on vaikeaa.
soveltaminen bioteknologiaan
enterokokkeja on tutkittu mahdollista käyttöä probioottina (ravintolisä, joka sisältää eläviä ei-virulentteja mikrobisoluja, joiden nautittuna uskotaan vaikuttavan hyödyllisesti suoliston mikrobiston koostumukseen). E. faecalis-kannan antamisen on osoitettu vähentävän ripulia. E. faecalis probiootteja käytetään kana / sika / karjan rehun vähentää ripulia eläimillä (8).
E. faecaliksen runsaasti sairautta aiheuttavien ominaisuuksien vuoksi E. faecaliksen virulenssin pysäyttämistä on tutkittu paljon enemmän kuin E. faecaliksen hyödyllistä käyttöä.
nykytutkimus
1.) Toivo Enterococcus faecalis – bakteerin aiheuttamista infektioista (4)
tiedetään, että vankomysiinille vastustuskykyiset bakteerit (esim.faecalis) aiheuttavat yhteiskunnalle monia ongelmia ja aiheuttavat ihmisissä vaikeasti hoidettavia bakteeri-infektioita. Enterokokki-infektiot ovat haastavia, koska eliöillä on kyky hankkia ja levittää nopeasti resistenssigeenejä. Keftobiprolia (BPR) käytettiin kefalosporiinitutkimuksessa grampositiivista Coccia vastaan. BPR on laajakirjoinen parenteraalinen kefalosporiini, jolla on suuret affiniteetit grampositiivisista ja Gramnegatiivisista penisilliiniä sitovista proteiineista. Se on myös stabiili β-laktamaasien hydrolyysiä vastaan.Tässä tutkimuksessa tarkasteltiin BRP: n vaikutusta suureen E. faecalis-kokoelmaan ja tarkasteltiin BPR: n bakterisidista vaikutusta vankomysiinille resistentteihin isolaatteihin. Tutkimuksessa havaittiin, että vankomysiiniresistenssi tai β-laktamaasin tuotanto ei vaikuta E. faecaliksen BPR: ään. E. faecaliksen kannoissa, joilla oli joko vankomysiiniresistenssi (vana-ja VanB-fenotyypit) tai ampiciliiniresistenssi, BPR oli bakterisidinen. Tutkijat osoittivat, että BPR: llä oli bakterisidinen vaikutus E. faecalista vastaan 750 mg: n annoksella estäen 100% E. faecaliksen aktiivisuudesta. Vaikka β-laktamaasientsyymin esiintyminen E. faecaliksessa on harvinaista, sen esiintyminen vaarantaa tehokkaimpien enterokokkilaktaamien (esim.ampisilliini) käytön. BPR on huono β-laktamaasientsyymin substraatti, mikä selittää sen erinomaisen aktiivisuuden β-laktamaasia tuottavaa E. faecalista vastaan.Tämä tutkimus osoitti, että BPR on voimakas aktiivisuus vastaan hyvin suuri kokoelma E. faecalis. Vankomysiiniresistenssi tai β-laktamaasin tuotanto eivät vaikuttaneet BPR: n aktiivisuuteen. Siksi BPR on toiveikas aine käytettäväksi β-laktamaasia tuottavien ja vankomysiinille resistenttien E. faecalis-infektioiden hoitoon ihmisillä.
2.) Tutkittaessa, miten Enterococcus faecalis tulee resistentiksi linetsolid-lääkkeelle (5)
, kun antibiootteja käytetään bakteeri-infektion hoidossa, niillä voi olla vaikutusta suolistoflooraan. Hoidon aikana voidaan valita resistenttejä bakteereja, kuten enterokokkeja, ja ne ovat mahdollisesti patogeenisiä. Resistenssin syntyminen on uusien antibioottien ongelma, koska se voi vaarantaa antibioottien käyttökelpoisuuden.Tutkimuksessa selvitettiin E. faecaliksen antibioottiresistenssin syntymistä. Tarkemmin tutkijat tarkastelivat vastustuskykyä linetsolidille (ensimmäinen uudesta antibioottiluokasta, joka tunnetaan nimellä ”oksatsolidinonit”). Linetsolidia voidaan käyttää monilääkeresistenttiä Grampositiivista Coccia, myös VRE: tä, vastaan. Se estää bakteerien proteiinisynteesiä sitoutumalla nimenomaan 50s-ribosomaalisen alayksikön domeeniin, eikä muihin antibiootteihin vaikuttavat resistenssimekanismit vaikuta siihen. Tässä tutkimuksessa tarkasteltiin linetsolidille resistenttien E. faecalis-mutanttien ilmaantumisnopeutta gnotobioottisten hiirten ruoansulatuskanavassa. Linetsolidin pitoisuudet syötettiin vedessä annoksilla, jotka vaihtelivat välillä 0,5, 0,005-0,005 g/L.mutantit olivat kaikki riippuvaisia annetusta linetsolidista, resistenssitasot kasvoivat altistuksen keston myötä. Yhtään mutanttia ei eristetty linetsolidin puuttuessa, mikä viittaa siihen, että De novo-resistenssi linetsolidille oli harvinaista Enterokokissa.Tutkimuksessa havaittiin, että mutaatio yhdessä 23S rRNA-geenissä oli kriittinen vaihe linetsolidiresistenssin synnyssä. Hiirillä havaittiin ensisijainen kolonisaatio yhden mutaation mutanteilla jo 5 päivän kuluttua hoidon aloittamisesta.Nämä hiirillä tehdyt kokeet auttavat selittämään linetsolidiresistenssin kehittymistä kliinisissä isolaateissa. Tutkimusryhmä osoitti, että annos on kriittinen resistenssin dynamiikalle. Näiden löydösten pitäisi auttaa määrittelemään parhaat terapeuttiset strategiat resistenssin synnyn minimoimiseksi kliinisessä ympäristössä, mikä mahdollisesti säästää monia ihmishenkiä.
3.) Enterococcus faecaliksen Ser / Thr-kinaasin on todettu välittävän mikrobilääkeresistenssiä (6)
Enterococcus faecalis aiheuttaa sairaaloissa monia antibiooteille vastustuskykyisiä infektioita, mikä johtuu sen luontaisesta vastustuskyvystä tietyille antibiooteille ja sen kyvystä selviytyä ja lisääntyä suolistossa.E. faecalis ei ole hyvin tunnettu, tämä tutkimus yrittää selvittää syytä resistenssin. Tutkijat osoittivat, että prkc, yksikomponenttinen signalointiproteiini, joka sisältää eukaryoottisen ser / Thr-kinaasi domeenin, mahdollisti E. faecaliksen luontaisen mikrobilääkeresistenssin ja suoliston pysyvyyden. He havaitsivat, että E. faecalis-mutantti, jolta puuttui PrkC, kasvoi villiä vauhtia mikrobilääkestressin puuttuessa, mutta osoitti lisääntynyttä herkkyyttä solujen kuoreen vaikuttaville yhdisteille, mukaan lukien antibiootit, jotka kohdistivat soluseinän biogeneesiin ja sappipesuaineisiin.PrkC säätelee E. faecaliksen fysiologisia prosesseja, jotka ovat avainasemassa sen menestymisessä sairaalapatogeeninä. Tutkijoiden ennustama prkc: n rakenne oli sytoplasmakinaasidomeeni, jota erotti transmembraanijaosto, jonka ajateltiin sitovan ristisidonnaista peptidoglykaania. Tämä viittasi siihen, että PrkC oli transmembraanireseptori, joka tarkkailee E. faecaliksen soluseinän eheyttä ja välittää adaptiivisia vasteita tämän intergriteetin ylläpitämiseksi. PrKC on tärkeä E: lle. faecalis aiheuttaa nosocomial infektioita, mikä viittaa siihen, että signalointi proteiini on tavoite kehittää hoitoja estämään infektioita antibiooteille resistenttien enterokokit.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. ”Liikkuvan DNA: n rooli vankomysiinille vastustuskykyisen Enterococcus faecaliksen evoluutiossa.” Tiede. Maaliskuuta 2003. Vol. 299, nro 5615. p. 2071-2074
2.) Murrary BE. Toukokuuta 1998. ”Monilääkeresistenttien enterokokkien monimuotoisuus.”Uudet Tartuntataudit. Vol. 4, nro 1. s. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo ja Janet T. Shigei. Color Atlas of Medical Bakteriology. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. ”Time-Kill and Synergism Studies of Keftobiprole against Enterococcus faecalis, Including ß-Lactamase Producing and Vankomycin resistent Isolates.”Mikrobilääkkeet ja kemoterapia. Kesäkuuta 2007. Vol. 51, nro 6. vuosina 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. ”Annosriippuvuus of Emergence of Resistance to Linezolid in Enterococcus faecalis In Vivo.”The Journal of Infectious Diseases. 2007. Vol. 195. 1480-1488.
6.) Kristich C., Wells C., Dunny G. ”Eukaryoottityypin ser / Thr-kinaasi Enterococcus faecaliksessa välittää mikrobilääkeresistenssiä ja suoliston pysyvyyttä.”Proceedings of the National Academy of Sciences of the United States of America. Helmikuuta 2007. Vol. 104, nro 9. 3508-3513.
7.) Macovei, L., Zurek, L. ” Ecology of Antibiotic Resistance Genes: Characterization of enterokokit from Houseflies Collected in Food Settings.”Applied and Environmental Microbiology. Kesäkuuta 2006. Vol. 72, nro 6. s. 4028-4035.
8. Gilmore, Michael. Enterokokit: patogeneesi, molekyylibiologia ja antibioottiresistenssi. Washington, DC: American Society for Microbiology Press, 2002.
9.)Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. ”Endokardiitti ja biofilmiin liittyvä Enterococcus faecaliksen pili.”Journal of Clinical Investigation. Lokakuuta 2006. Nro 116. 2799-2807.
toimitti Richard A. Martinez UC San Diegosta, Rachel Larsenin oppilas.