Antiaromaattiset yhdisteet ovat epätavallisen epästabiileja
mitkä ovat avaintekijät, jotka määrittävät onko molekyyli antiaromaattinen?
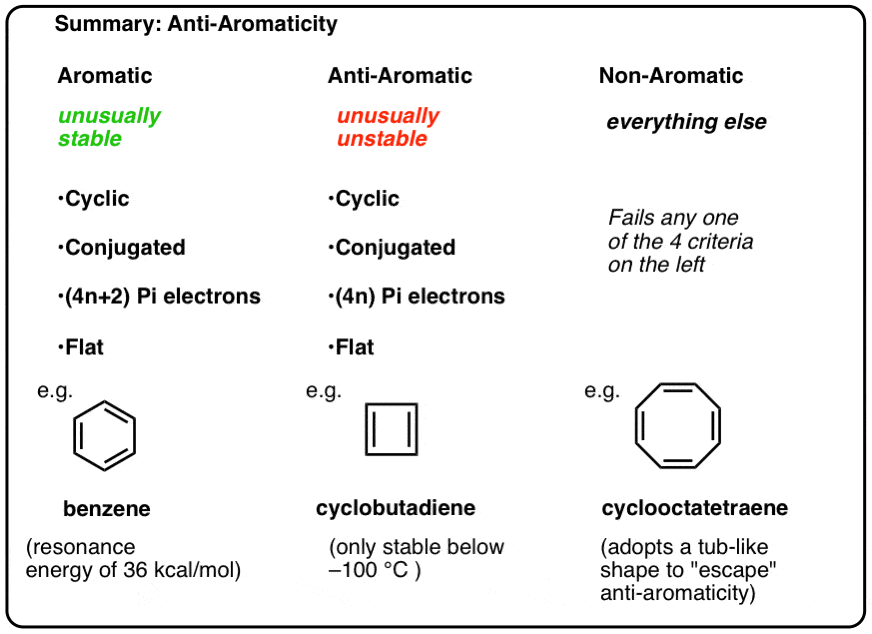
aiemmissa artikkeleissamme aromaticity-sarjassa näimme, että aromaattiset molekyylit ovat epätavallisen stabiileja. Niillä on erityisen suuret resonanssienergiat, niillä on taipumus käydä substituutioreaktioiden sijaan läpi ja niillä on delokalisoituneita pi-elektroneja (esimerkiksi bentseenin kaikki C-C-sidoksen pituudet ovat yhtä suuret).
ollakseen aromaattinen molekyylillä on oltava seuraavat neljä rakenteellista ominaisuutta:
- syklinen
- konjugoitunut ympäri rengasta
- on pi-elektroneja
- Tasainen (tasomainen)
Jos nämä neljä ehtoa täyttyvät, molekyyli on aromaattinen.
Jos se floppaa yhdenkin kysymyksen kokeessa, se on aromaattinen.
se näyttää olevan aika selvää. Vai onko?
tämän kysymyksen muotoilutavasta voisi arvata, että vastaus on ”ei ihan”. : – )
Sisällysluettelo
- jotkut molekyylit ovat niin näyttävästi ja epätavallisen epästabiileja ja vaikeasti Eristettäviä, että ne ansaitsevat oman kategoriansa:Antiaromaattinen
- Syklopentadienyylikationi: ”Resonanssistabiloitu” Karbokationi, joka ei ole stabiili
- Antiaromaattinen kolmijäseninen rengas: Oksireeni, 1h-Atsireeni, Tiireeni
- Syklobutadieeni on Antiaromaattinen
- 8 pi-elektronin esimerkki antiaromaattisesta yhdisteestä: Pentaleeni
- mikä tekee molekyylistä Antiaromaattisen?
- syklo-Oktatetraeeni ”pakenee” Antiaromaattisuutta kiertämällä tasaisuutta
- johtopäätös: Antiaromaattiset yhdisteet
- toteaa
- Advanced: referenssit ja Jatkoluku
1. Spektaakkelimaisen epästabiileja molekyylejä, jotka muodostavat itselleen kategorian:”Antiaromaattinen”
tässä on se juttu. On olemassa pieni määrä molekyylejä, jotka reputtavat aromaattisuuden testin, jotka eivät ole vain ei-aromaattisia.: heillä on se ominaisuus, että he ovat niin näyttävästi ja epätavallisen epävakaita ja vaikeasti eristettäviä, että he ansaitsevat toisen nimen.
kutsumme näitä molekyylejä ”antiaromaattisiksi”.
mielenkiintoista on se, että monissa tapauksissa itse molekyylit eivät näytä olevan erityisen epävakaita ensimmäisistä periaatteista käsin, toisin kuin vaikkapa Kuuban. Hauskaa riittää, voit ostaa cubane (enemmän tai vähemmän) Aldrich, mutta useimmat anti-aromaattiset molekyylit käsittelemme alla ovat vakaita vain erittäin alhaisissa lämpötiloissa – jos ne voidaan eristää ollenkaan!
2. Syklopentadienyylikationi: ”Resonanssi-stabiloitu” Karbokationi, joka ei ole vakaa
aloitetaan matkamme kaninkoloon yksinkertaisella esimerkillä, jonka pitäisi tuntua tutulta ensimmäisen lukukauden orgaanisesta kemiasta.
Muistatko SN1-reaktion? Kissa, joka lähtee mukavasta tuolista ensin?
pikakatsaus: Aloita alkyylihalidilla. Jättäen ryhmä lähtee, muodostaen carbocation. Nukleofiilihyökkäykset. Sitä kutsutaan SN1 koska nopeus määräävä vaihe (karbokationin muodostuminen) on unimolekulaarinen. Mitä vakaampi karbokationi, sitä nopeammin reaktio etenee. Siten alkyylihalidien reaktionopeus on tertiäärinen > sekundaarinen > primaarinen, ja karbokationi saa erityisiä bonuspisteitä, jos se stabiloituu resonanssilla.
Katso näitä kahta SN1-reaktiota. Kumman luulet tapahtuvan nopeammin – SN1-reaktion, joka kulkee sekundaarisen karbokationin (A) läpi, vai SN1-reaktion, joka kulkee sekundaarisen karbokationin läpi ja voi muodostaa useita resonanssimuotoja (B)?
kaikesta tähän mennessä oppimastasi luulisi vastauksen olevan B).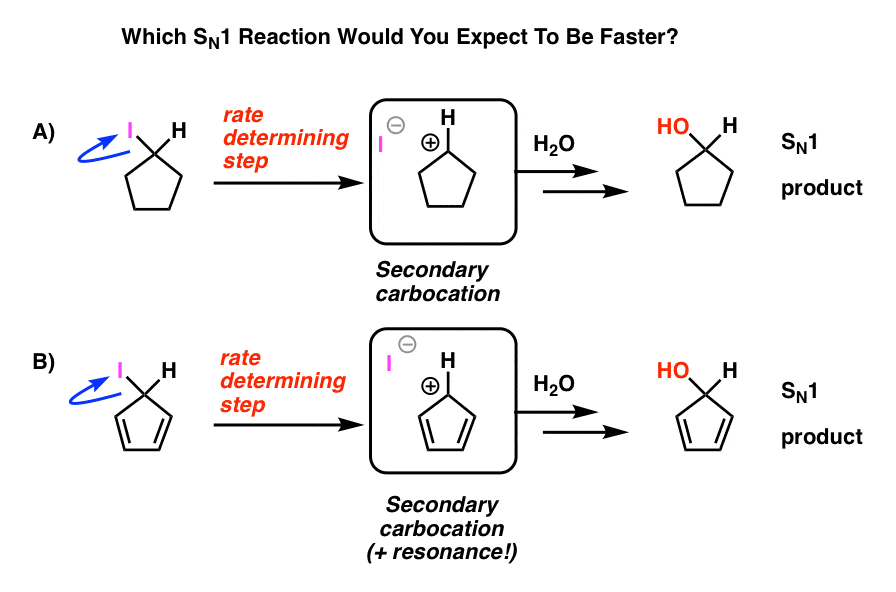
se ei ole.
vastaus on, että reaktio a) tapahtuu nopeammin. B-reaktiota ei tapahdu lainkaan.
tämän pitäisi tuntua sinusta syvästi oudolta.
se on!
miten tämä oletettavasti resonanssistabiloitunut karbokationi on vähemmän stabiili kuin sekundaarinen karbokationi?
kuinka monta kertaa päähän porataan, että resonanssi stabiloi molekyylejä, erityisesti karbokationeja?
mutta täällä se tuntuu horjuvan. Se on … se on …

mutta epästabiili se on! Syklopentadienyylikationi on uskomattoman epävakaa ja vaikea tehdä – eikä se ole yrittämisen puutetta. Syklopentadienyylikationin rakenteessa on jotain hyvin outoa, mikä aiheuttaa sille epätavallista epävakautta.

syklinen, konjugoitu, Tasainen…. ja sillä on 4 pi-elektronia. Mielenkiintoista!
3. Antiaromaattiset Kolmijäseniset renkaat: Oksireeni, 1h-Atsireeni, Tiireeni
toinen ”vaikeasti havaittavien” molekyylien luokka on kolmijäsenisten renkaiden perhe. Org 1: stä voi muistaa, että epoksideja on helppo valmistaa alkeeneista m-CPBA: n kaltaisella hapettimella.
Mietitkö koskaan, miksi emme koskaan käsitelleet samaa reaktiota alkyyneille?
no, se ei johdu yrittämisen puutteesta. Kemistit ovat kokeilleet kaikenlaisia menetelmiä alkyynien epoksisointiin. Reaktio ei vain toimi.
esimerkiksi asetyleenin epoksidaatio antaisi alla olevan molekyylin (oksireenin).
itse Oksireenia ei ole koskaan havaittu, vaikka sen ohikiitävästä olemassaolosta on ärsyttäviä jälkiä. Eikä myöskään typpianalogi, 1H-atsireeni eikä tiireeni.
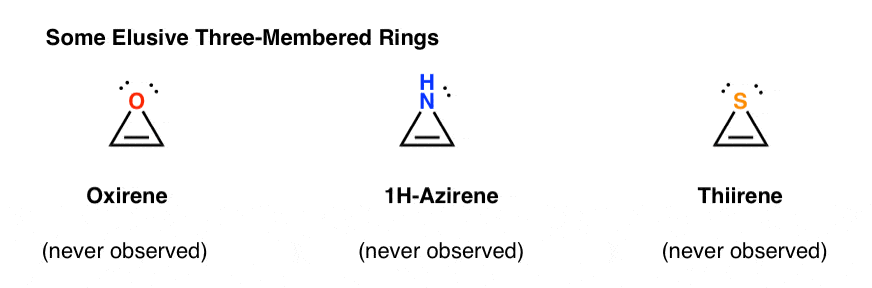
miksi ei? Mitä erikoista näissä jutuissa on?
saatat huomata, että syklopentadienyylikationin tavoin nämä molekyylit ovat syklisiä, konjugoituneita, litteitä ja niillä on 4 pi-elektronia (kaksi pi-sidoksessa ja kaksi yksinäisestä parista).
OK. Mikä muu voisi olla syklinen, konjugoitu, tasainen, ja on 4 pi elektroneja?
4. Syklobutadieeni on Antiaromaattinen
Syklobutadieeni näyttää riittävän yksinkertaiselta molekyyliltä, mutta varsinaisesti se syntetisoitiin vasta vuonna 1965. Silloinkin todettiin, ettei se ole stabiili yli 35 kelvinin lämpötilassa.
kysymys kuuluu, miksi?

toki, se on nelijäseninen rengas, ja kyllä siinä on paljon rengasjännitystä, mutta on tehty enemmän jännittyneitä molekyylejä, jotka ovat oikeasti stabiileja huoneenlämmössä.
voi myös huomata, että edellä mainittujen esimerkkien tavoin syklobutadieeni on toinen esimerkki molekyylistä, joka on syklinen, konjugoitunut, jolla on 4 pi-elektronia ja joka on litteä.
vielä mielenkiintoisempaa on se, mitä syklobutadieenin geometriasta opittiin. Sen sijaan, että syklobutadieeni olisi molekyyli, jolla olisi identtiset sidoksen pituudet (kuten bentseenillä), sillä havaittiin olevan suorakulmainen muoto, mikä osoittaa, että elektronit eivät olleet delokalisoituneet.
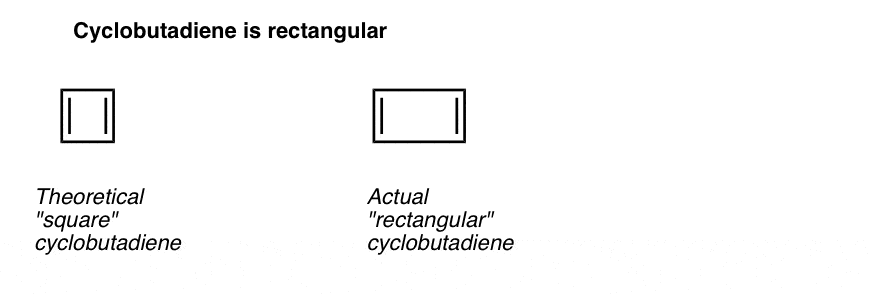
Tämä kertoo siitä, että vaikka molekyyli täyttää kaikki ehdot (syklinen, konjugoitunut, tasainen, 4 pi-elektronia), symmetrinen geometria on erityisen epävakaa. . Erittäin mielenkiintoista!
8 Pi-elektronin esimerkki Antiaromaattisesta yhdisteestä: Pentaleenilla
toistaiseksi kaikilla näkemillämme esimerkeillä oli 4 pi-elektronia. Saatat ihmetellä: onko olemassa esimerkkejä antiaromaattisista molekyyleistä, joissa on yli 4 pi-elektronia? Kyllä.
alla olevaa molekyyliä kutsutaan ”Pentaleeniksi”. Se on syntetisoitu, mutta on stabiili vain alle -100 °C. tämän lämpötilan yläpuolella se yhdistyy toiseen molekyyliin itseensä (viite). Toinen esimerkki upeasta epävakaudesta.

Pentaleenilla on 8 pi-elektronia. Tämä saattaa herättää hälytyskelloja. Muista, miten pi-elektronien määrä aromaattisissa molekyyleissä seurasi sekvenssiä (2, 6, 10, 14….) ?
Tämä esimerkki viittaa siihen, että Pi-elektronien määrä antiaromaattisissa molekyyleissä seuraa järjestystä (4, 8, 12…)
mikä tekee molekyylistä Antiaromaattisen?
Mitä yhteistä kaikilla näillä konnien gallerian molekyyleillä on?
jokainen niistä on syklinen, konjugoitunut ja tasainen – ja kun lasketaan pi-elektronien lukumäärä, se on kerrannainen 4. Vaikka aromaattisilla molekyyleillä on siis (4n+2) pi-elektroneja, antiaromaattisten molekyylien ”sääntö” on (4n). (toinen tapa tarkastella sitä: pi-elektronien määrä on kaksi kertaa parillinen luku).
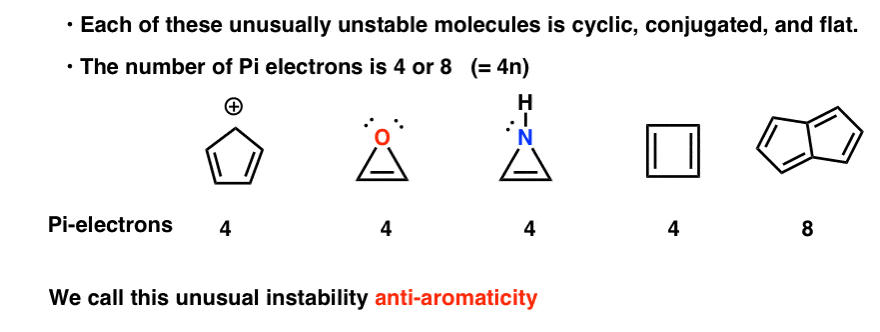
tätä epätavallista epästabiilisuutta kutsutaan ”antiaromaattisuudeksi”.
tämä tarkoittaa sitä, että molekyyleille voidaan nyt laatia kolme kategoriaa seuraavien kriteerien mukaan:
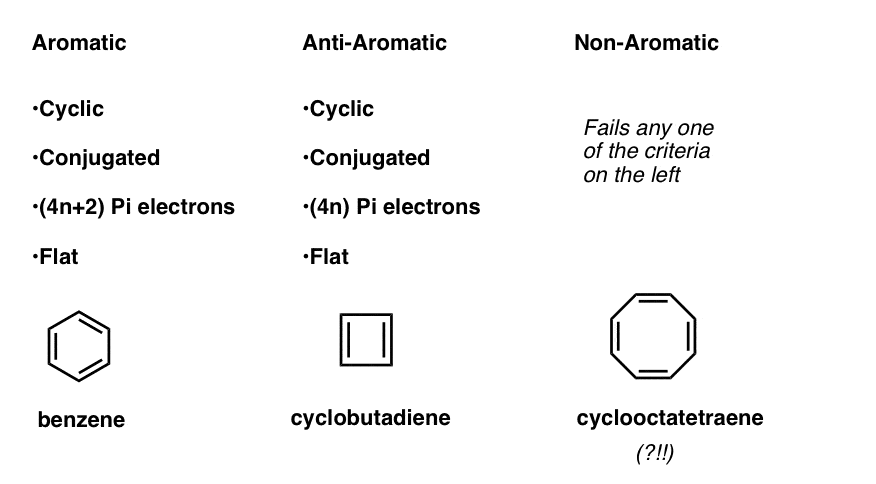
- aromaattiset molekyylit ovat syklisiä, konjugoituneita, niillä on (4n+2) pi-elektroneja ja ne ovat litteitä.
- antiaromaattiset molekyylit ovat syklisiä, konjugoituneita, niillä on (4n) pi-elektroneja ja ne ovat litteitä.
- ei-aromaattisia molekyylejä ovat kaikki muut molekyylit, jotka eivät täytä yhtä näistä ehdoista.
odota hetki – saatat ihmetellä, miksi syklo-oktatetraeeni luokitellaan ”ei-aromaattiseksi”. Kun 8 pi-elektronia (kaksi kertaa parillinen määrä), eikö sen pitäisi olla ”antiaromaattinen”?
syklo-Oktatetraeeni ”pakenee” Antiaromaattisuutta kiertämällä tasaisuudesta
ajattele ”antiaromaattisuuden” ehtojen täyttämistä vähän kuin olisi oikeutettu erittäin ankaraan tuloveroon. Jos sinulla olisi mahdollisuus löytää porsaanreikä verosta ulos pääsemiseksi, tekisitkö sen? Luultavasti.
syklo-Oktatetraeeni on aromaattinen vain, jos se on litteä. Syklo-oktatetraeenin suhteellisen ”levykkeinen” rakenne mahdollistaa kuitenkin jonkin verran joustavuutta. Sidokset voivat pyöriä pois tasaisuudesta siten, että molekyyli omaksuu ”ammemaisen” muodon, jolloin vältetään 18 12 kcal/mol: n ”antiaromaattisuusvero”, joka maksettaisiin, jos kaikki molekyylin p-orbitaalit konjugoituisivat keskenään.
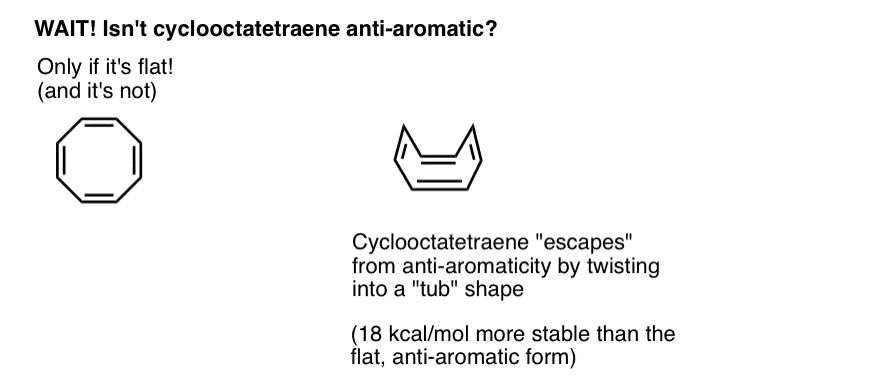
käy ilmi, että syklo-oktatetraeeni on syntetisoitu, on stabiili (voit ostaa sitä esimerkiksi täältä) ja käyttäytyy ”normaalin” alkeenin tavoin käyden additioreaktioissa, hydrauksessa ja niin edelleen.
Pentaleenilla (yllä), jolla on myös 8 pi-elektronia, on hyvin jäykkä bisyklinen rakenne, joka estää sidoksen kiertymisen pois tasaisuudesta. Siksi se on juuttunut antiaromaattiseen konformaatioonsa.
Antiaromaattisuus molekyyleille, joilla on yli 8 pi-elektronia, tunnetaan, mutta hyvin poikkeuksellisena. (Tässä hauska esimerkki toisesta” paosta ” aromaattisuudesta molekyylille, jolla on 18 pi-elektronia.)
johtopäätös: Antiaromaattiset yhdisteet
toistaiseksi aromatiikan ja antiaromaattisuuden käsittelymme on ollut puhtaasti Deskriptiivistä ja empiiristä. Olemme näyttäneet paljon esimerkkejä ja antaneet paljon sääntöjä, mutta keskustelusta on puuttunut syvällinen selitys ”miksi”.
mikä bentseenirenkaassa on niin erikoista, että se on niin stabiili? Miksi se on vakaa?
mikä syklobutadieenijärjestelmässä on niin erikoista, että se on niin epävakaa. Miksi se on epävakaa?
vastataksemme näihin syvempiin kysymyksiin, meidän on peräännyttävä ja tutkittava näiden kahden molekyylin molekyyliorbitaaleja, ja sitten tultava syvempään ymmärrykseen aromaattisuudesta ja antiaromaattisuudesta.
näin tehdään seuraavassa viestissämme.
Kiitos Matthew Knowelle avusta tämän viran valmistelussa.
huomautukset
alaviite 1. Yksinkertaisuuden vuoksi pääartikkelissa esitetty kuva käsittelee todellisia reaktio-olosuhteita. Todelliset koeolosuhteet on esitetty alla. Liuottimena on propionihappo, ja Lewis-happoa hopeaperkloraattia lisätään auttamaan jodin pois vetämisessä. .
näissäkään olosuhteissa syklopentadienyylikarbokationia ei muodostu, mikä on osoitus sen äärimmäisestä epävakaudesta.
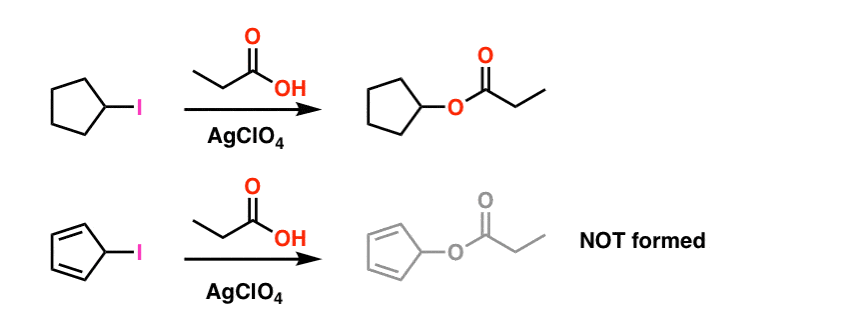
alaviite 2. Epoksidaatio on eteeni (aka etyleeni) tehdään vireessä 15 miljoonaa tonnia, vuosittain. Asetyleenin epoksidoitumista oksireeniksi ei tunneta.
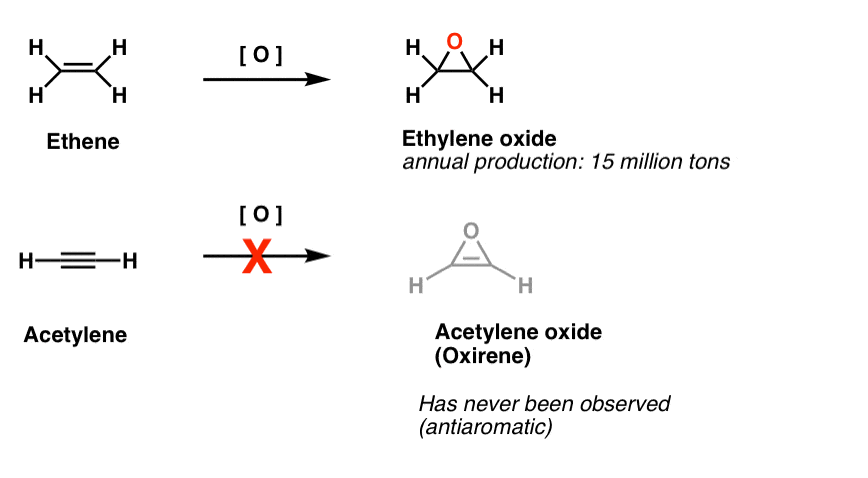
ohikiitäviä todisteita oksireenien olemassaolosta on löydetty. Isotooppien merkintätutkimuksista on saatu hyviä todisteita siitä, että oksireenit ovat ohikiitäviä välituotteita tietyissä Wolff-uudelleenjärjestelyissä. On myös kaksi esimerkkiä oksireeneista, jotka ovat jääneet loukkuun erittäin alhaiseen lämpötilaan, mutta hajoaneet yli 35 Kelvinin.
1h-atsiriinin ohikiitävän olemassaolon on arveltu johtuvan nitreenin lisäämisestä asetyleeniin, joka järjestyy nopeasti uudelleen (stabiiliksi) 2h-atsireeniksi (alla).
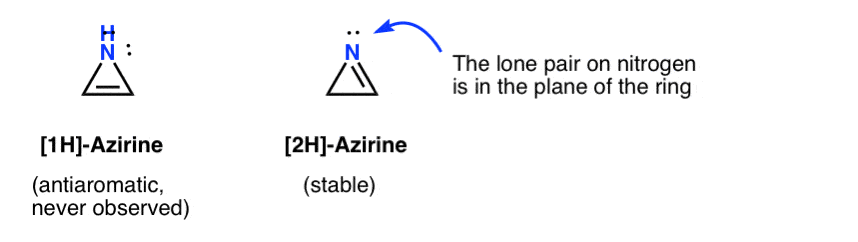
huomaa, että 2h-atsireenissa typen yksinäinen pari on suorassa kulmassa pii-järjestelmään nähden, joten tämä systeemi on ei-aromaattinen toisin kuin antiaromaattinen.
aiheesta lisää Marchin teoksessa Advanced Organic Chemistry. 5. painos, sivut 62-63.
. Alaviite 3. Erittäin nokkelassa kokeessa todettiin, että 1,2-dideuterosyklobutadieenilla on kaksi isomeeriä, ei yhtä (KS.alla). Tämä osoittaa, että syklobutadieenin kaksoissidokset eivät delokalisoidu kuten bentseenissä, vaan muistuttavat enemmän kaksoissidoksia tavanomaisessa dieenissä.
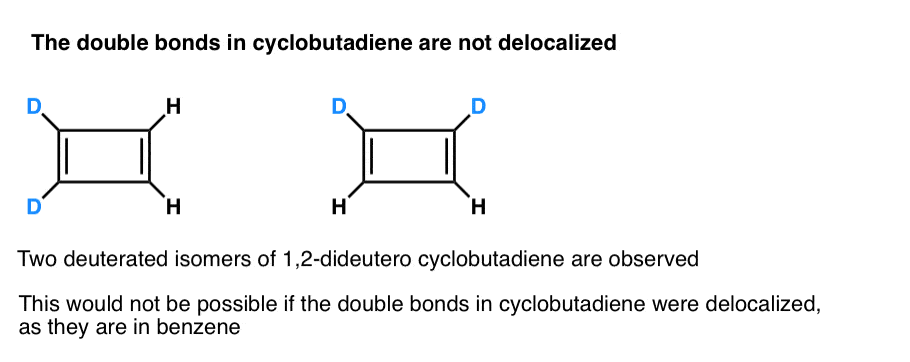
Syklobutadieeni reagoi itsensä kanssa 35 K: n lämpötilassa muodostaen ”dimeerin”, esimerkkinä Diels-Alder-reaktio.
alaviite 4. Kyllä, on totta, että yksinäinen pari azirene voidaan laittaa SP3 Hybridi orbital (alla). Tämä todennäköisesti vähentää antiaromaattista ”rangaistusta” jonkin verran, mutta molekyyli on silti uskomattoman epävakaa. Antiaromaattisuus on yksinkertaisin tapa selittää tämä.

alaviite 5. Suorakulmainen geometria johtuu Jahn-Teller-efektinä tunnetusta ilmiöstä. Muistatko Paulin poissulkuperiaatteen, jossa elektroneilla ei voi olla samaa kvanttilukua? Kuten näemme, kun katsomme syklobutadieenin molekyyliorbitaalikaaviota,” neliöllä ” syklobutadieenilla on kaksi ”degeneroitunutta” elektronia, eli niillä on samat energiat ja kvanttiluvut. Tämä johtaa ”Pauli repulsion” – nimellä tunnettuun ilmiöön, jossa sidosten venymät tapahtuvat, kunnes kahden elektronin energiatasot erilaistuvat. Ehdottomasti edistynyt aihe.
(Advanced) References and Further Reading
- syklo-Oktatetraeenin Siirtymätilaspektroskopia
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
tiede, 1996, 272, 1456-1459.
DOI: 10.1126 / tiede.272.5267.1456
Tämä tutkimus on perustana väitteelle, jonka mukaan syklo-oktatetraeenin ei-aromaattinen maatila on 12 kcal/mol alle ”antiaromaattisen” konformaation. - Syklobutadieenin kesyttäminen
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Toim. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
tässä nobelisti professori Donald J. Cramin (UCLA) artikkelissa kuvataan syklobutadieenin ensimmäinen spektroskooppinen Luonnehdinta. Tämä saadaan aikaan sulkemalla esiaste hemikarserandiin (häkkikompleksi) ja säteilyttämällä se sitten UV-valolla, jolloin syntyy syklobutadieenia, joka ei voi tehdä mitään, koska se on loukussa. - Syklobutadieeni
Thomas Bally, Satoru Masamune
Tetrahedron 1980, 36 (3), 343-370
Doi: 1016/0040-4020(80)87003-7
tämä tutkielma vuodelta 1980 tarkastelee syklobutadieenin parissa siihen mennessä tehtyä työtä. Tämä on jaettu 2 osaan-kokeelliset synteettiset ponnistelut ja teoreettiset laskelmat. - Tetraedraani ja Syklobutadieeni
Günther Maier
Chem. Int. Toim. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
tässä asiakirjassa tarkastellaan synteettisiä pyrkimyksiä tetraedriin ja syklobutadieeniin – molempien molekyylien kaava on c4h4. Ainoastaan substituoidut (tetra-t-butyyli ja tetra-trimetyylisilyyli)tetraedraanit on onnistuttu syntetisoimaan ja eristämään tähän mennessä. - Syklobutadieeni – ja Bentsosyklobutadieeni-Rautatrikarbonyylikompleksit
F. Emerson, L. Watts ja R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
Doi: 10.1021/ja01079a032 - Syklobutadieneiron Trikarbonyyli. Uusi aromaattinen järjestelmä
D. Fitzpatrick, L. Watts, G. F. Emerson ja R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
bonusaihe: syklobutadieeni voidaan stabiloida metalleilla – organometallikompleksi syklobutadieeni rautatrikarbonyyli on vakaa, kiteinen kiinteä aine. Kuten kirjoittajat mainitsevat, on epätodennäköistä, että synteesissä syntyisi vapaata syklobutadieenia. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
antipsykoottinen olantsapiini ottaa syklo-oktatetraeenin kaltaisen ”perhosmuodon antiaromaattisten vaikutusten välttämiseksi. Tämä on ilmeisesti kriittistä sen toiminnan kannalta. - Antiaromaattisuus
Ronald Breslow
Accounts of Chemical Research 1973, 6 (12), 393-398
DOI: 1021 / ar50072a001
mielenkiintoista, professori Breslow (Columbia) toteaa tässä kertomuksessaan, että hän oli henkilö, joka ensimmäisenä ehdotti termiä ”antiaromaattinen” erityisesti epävakaille syklisille yhdisteille, joilla on 4N p elektroneja. Hän mainitsee myös muita Prof. M. J. S. Dewarin töitä, joissa syklobutadieenin antiaromaattisen epävakauden lasketaan olevan välillä 18-33 kcal/mol suhteessa lineaariseen butadieeniin. - Experimental Determination of the Antiaromaticity of Cyclobutadiene
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Science 1999, 286 (5442), 1119-1122
DOI: 1126/science.286.5442.1119
Tämä on hyvin tiukka paperi, joka käyttää uusia spektroskooppisia tekniikoita syklobutadieenin antiaromaattisen epävakauden määrittämiseen. Hypoteettiseen, konjugoitumattomaan dieenivertaukseen verrattuna syklobutadieenia stabiloi yhteensä 87 kcal/mol, josta 32 kcal/mol voidaan katsoa johtuvan rengaskannasta ja 55 kcal/mol antiaromaattisuudesta (verrattuna bentseenin aromaattiseen stabilointiin 21 kcal / mol). - Unsubstituted cyclopentadienyl kation, a ground-state triplet
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ’ Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
Doi: 10.1021 / ja00790a049
syklopentadienyylikationia voidaan valmistaa vain vaivoin, kuten tässä asiakirjassa kuvaillaan. Kun se on muodostettu, sillä on triplettinen elektroninen maatila (jossa on 2 paritonta elektronia), ja sille voidaan määrittää EPR (electron paramagneettinen resonanssi) – spektroskopia. - Oxirenes
Errol G. Lewars
Chemical Reviews 1983, 83 (5), 519-534
Doi: 10.1021 / cr00057a002