vedyn lisäämistä hiili-hiili-kaksoissidokseen kutsutaan vedytykseksi. Tällaisen yhteenlaskun kokonaisvaikutus on kaksoissidoksen funktionaalisen ryhmän reduktiivinen poisto. Regioselektiivisyys ei ole ongelma, sillä sama ryhmä (vetyatomi) on sitoutunut jokaiseen kaksoissidoshiileen. Yksinkertaisin kahden vetyatomin lähde on molekyylivety (H2), mutta alkeenien sekoittaminen vetyyn ei johda mihinkään havaittavaan reaktioon. Vaikka yleinen hydrausreaktio on eksoterminen, suuri aktivointienergia estää sen tapahtumisen normaaliolosuhteissa. Tätä rajoitusta voidaan kiertää käyttämällä katalyyttiä, kuten seuraavassa kaaviossa esitetään.
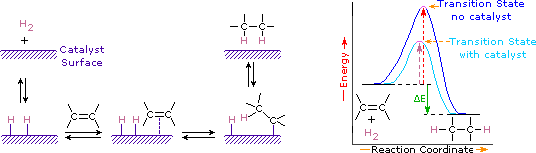
katalyytit ovat aineita, jotka muuttavat kemiallisen reaktion nopeutta (nopeutta) kuluttamatta tai esiintymättä tuotteen osana. Katalyytit toimivat alentamalla reaktioiden aktivaatioenergiaa, mutta ne eivät muuta reaktanttien ja tuotteiden suhteellista potentiaalienergiaa. Hienojakoiset metallit, kuten platina, palladium ja nikkeli, ovat yleisimmin käytettyjä hydrauskatalyyttejä. Katalyyttinen vedytys tapahtuu vähintään kahdessa vaiheessa, kuten kuvassa esitetään. Ensin alkeeni on adsorboitava katalyytin pinnalle yhdessä osan vedystä kanssa. Seuraavaksi kaksi vetyä siirtyy metallipinnalta kaksoissidoksen hiiliin, ja tuloksena syntyvä tyydyttynyt hiilivety, joka on heikommin adsorboitunut, poistuu katalyytin pinnalta. Viimeisten tapahtumien tarkkaa luonnetta ja ajoitusta ei tarkkaan tunneta.
kuten energiakaaviossa on esitetty, alkeenien vedytys on eksotermistä ja lämpöä vapautuu vastaa diagrammin ΔE (värillinen vihreä). Tällä reaktiokuumennuksella voidaan arvioida niiden alkeenien termodynaamista stabiilisuutta, joilla on kaksoissidoksessa eri määrä alkyylisubstituentteja. Esimerkiksi seuraavassa taulukossa on lueteltu vedytyksen lämmöt kolmelle C5H10-alkeenille, joista saadaan sama alkaanituote (2-metyylibutaani). Koska suuri reaktiolämpö ilmaisee suurienergistä reaktanttia, nämä kuumenemiset ovat kääntäen verrannollisia alkeeni-isomeerien stabiilisuuteen. Karkean likiarvon perusteella näemme, että jokainen kaksoissidoksen alkyylisubstituentti stabiloi tätä funktionaalista ryhmää hieman yli 1 kcal/mooli.
| alkeenin isomeeri | (CH3)2CHCH=CH2 3-metyyli-1-buteeni |
CH2=C(CH3)ch2ch3 2-metyyli-1-buteeni |
(CH3)2C=chch3 2-metyyli-2-buteeni |
|---|---|---|---|
| reaktion kuumuus ( δhº ) |
-30, 3 kcal/mooli | -28, 5 kcal/mooli | -26, 9 kcal/mooli |
tässä esitetystä mekanismista voisi olettaa, että vedyn lisäys tapahtuisi syn-STEREOSELEKTIIVISYYDELLÄ. Tämä pitää usein paikkansa, mutta vedytyskatalyytit voivat myös aiheuttaa kaksoissidoksen isomeroitumisen ennen vedyn additiota, jolloin stereoselektiivisyys voi olla epävarmaa.
siirtymämetallikompleksien muodostuminen alkeenien kanssa on osoitettu vakuuttavasti eristämällä stabiileja platinakomplekseja, kuten Zeisen suola, K. H2O, ja etyleenibis(trifenyylifosfiini)platina, 2Pt(H2C=CH2). Jälkimmäisessä platina on kolmikoordinaatisto ja nollavalentti, kun taas Zeisen suola on platinan(II) johdannainen. Mallia Zeisen suolasta ja keskustelua tällaisten kompleksien epätavallisesta sitoutumisesta voi tarkastella klikkaamalla tästä. Samanlaisia komplekseja on raportoitu nikkelille ja palladiumille, metalleille, jotka toimivat myös alkeenin hydrauksessa katalyytteinä.
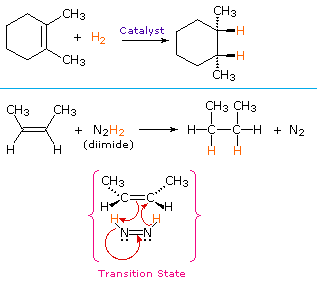
ei-katalyyttisessä vedyn syn-additiomenetelmässä käytetään epästabiilia yhdistettä di-imidi, N2H2. Tätä reagenssia täytyy tuottaa reaktiojärjestelmässä juuri, yleensä hapettamalla hydratsiinia, ja voimakkaasti eksotermistä reaktiota suosii typpikaasun (hyvin stabiili yhdiste) eliminointi. Di-imidi voi esiintyä cis-trans-isomeereina; pelkistimenä toimii vain CIS-isomeeri. Alla on esimerkkejä alkeenin vähennyksistä molemmilla menetelmillä.
avustajat
- William Reusch, emeritusprofessori (Michiganin osavaltion U.), orgaanisen kemian virtuaalinen oppikirja