jaksolliset trendit ja liuotinvaikutukset nukleofiilisuudessa
nukleofiilisuudessa on ennustettavia jaksollisia suuntauksia. Nukleofiilisuustrendi liikkuu vaakasuunnassa taulukon toisella rivillä ja yhtyy basaalisuustrendiin:
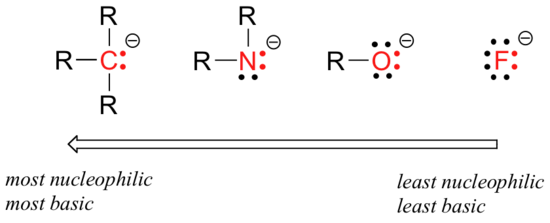
horisontaalisen nukleofiilisuustrendin perustelut ovat samat kuin basaalisuustrendin perustelut: elektronegatiivisemmat alkuaineet pitävät elektroninsa tiukemmin, eivätkä kykene luovuttamaan niitä uuden sidoksen muodostamiseksi.
tämä horisontaalinen suuntaus kertoo myös siitä, että amiinit ovat nukleofiilisempia kuin Alkoholit, vaikka molemmat ryhmät toimivat nukleofiileina sekä laboratorio-että biokemiallisissa reaktioissa.
muistuttaa, että atomien basisiteetti vähenee, kun liikumme jaksollisen järjestelmän saraketta pystysuunnassa alaspäin: tiolaatti-ionit ovat vähemmän emäksisiä kuin esimerkiksi alkoksidi-ionit ja bromidi-ioni on vähemmän emäksinen kuin kloridi-ioni, joka puolestaan on vähemmän emäksinen kuin fluoridi-ioni. Muista myös, että tämä suuntaus voidaan selittää ottamalla huomioon suurempien ionien ympärillä olevan ”elektronipilven” kasvava koko: negatiiviseen varaukseen luonnostaan kuuluva elektronitiheys leviää laajemmalle alueelle, mikä pyrkii lisäämään stabiilisuutta (ja siten vähentämään emäksisyyttä).
nukleofiilisuuden pystysuuntainen jaksollinen suuntaus on jonkin verran monimutkaisempi kuin basisiteetin: riippuen liuottimesta, jossa reaktio tapahtuu, nukleofiilisuustrendi voi mennä kumpaan suuntaan tahansa. Otetaan yksinkertainen esimerkki SN2-reaktiosta alla:
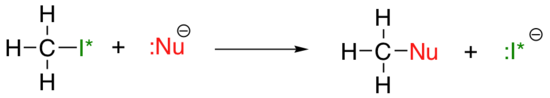
. . .missä Nu-on yksi halidi-ioneista: fluoridi, kloridi, bromidi tai jodidi, ja lähtevä ryhmä I* on jodin radioaktiivinen isotooppi (jonka avulla voidaan erottaa lähtevä ryhmä nukleofiilista siinä tapauksessa, että molemmat ovat jodidia). Jos tämä reaktio tapahtuu proottisessa liuottimessa (eli liuottimessa, jossa vety on sitoutunut happi – tai typpivetyyn-vesi, metanoli ja etanoli ovat tärkeimmät esimerkit), reaktio menee nopeimmin jodidin ollessa nukleofiili ja hitaimmin fluoridin ollessa nukleofiili, mikä heijastaa nukleofiilin suhteellista vahvuutta.

suhteellinen nukleofiilisuus proottisessa liuottimessa
Tämä on tietenkin päinvastainen kuin basisiteetin pystysuuntaisessa jaksollisessa trendissä, jossa jodidi on vähiten emäksinen. Mitä täällä tapahtuu? Eikö vahvempi emäs ja sen reaktiivisemmat valenssielektronit olisi myös vahvempi nukleofiili?
kuten edellä mainittiin, kaikki liittyy liuottimeen. Muista, että puhumme nyt reaktiosta, joka kulkee etanolin kaltaisessa proottisessa liuottimessa. Proottiset liuotinmolekyylit muodostavat erittäin voimakkaita ioni-dipoli-interaktioita negatiivisesti varautuneen nukleofiilin kanssa ja luovat olennaisesti nukleofiilin ympärille”liuotinhäkin”:

jotta nukleofiili hyökkäisi elektrofiilin kimppuun, sen täytyy murtautua ainakin osittain irti liuotinhäkistään. Suuremman, vähemmän emäksisen jodidi – ionin yksinäiset elektroniparit vuorovaikuttavat vähemmän tiukasti proottisten liuotinmolekyylien protonien kanssa-näin jodidinukleofiili pystyy paremmin irtautumaan liuotinhäkistään verrattuna pienempään, emäksisempään fluoridi-ioniin, jonka yksinäiset elektroniparit sitoutuvat tiukemmin häkin protoneihin.
kuva muuttuu, jos siirrytään polaariseen aproottiseen liuottimeen, kuten asetoniin, jossa on molekyylidipoli mutta ei Happeen tai typpeen sitoutuneita vetyjä. Fluoridi on paras nukleofiili ja jodidi heikoin.
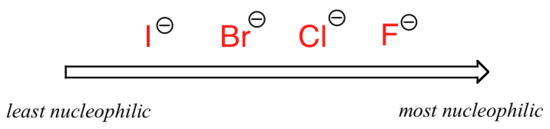
suhteellinen nukleofiilisyys polaarisessa aproottisessa liuottimessa
kääntymisen syy on se, että aproottisen liuottimen kanssa ionidipoli-yhteisvaikutukset liuottimen ja nukleofiilit ovat paljon heikompia: liuottimen dipolin positiivinen pää on piilossa molekyylin sisäosissa, ja näin se on suojattu nukleofiilin negatiiviselta varaukselta.
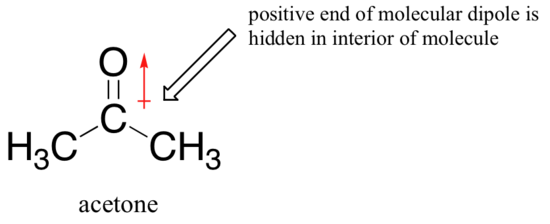
heikompi liuotin-nukleofiili-vuorovaikutus tarkoittaa heikompaa liuotinhäkkiä nukleofiilin murtumiselle, joten liuotinvaikutus on paljon vähäisempi, ja mitä emäksisempi fluoridi-ioni on myös sitä parempi nukleofiili.
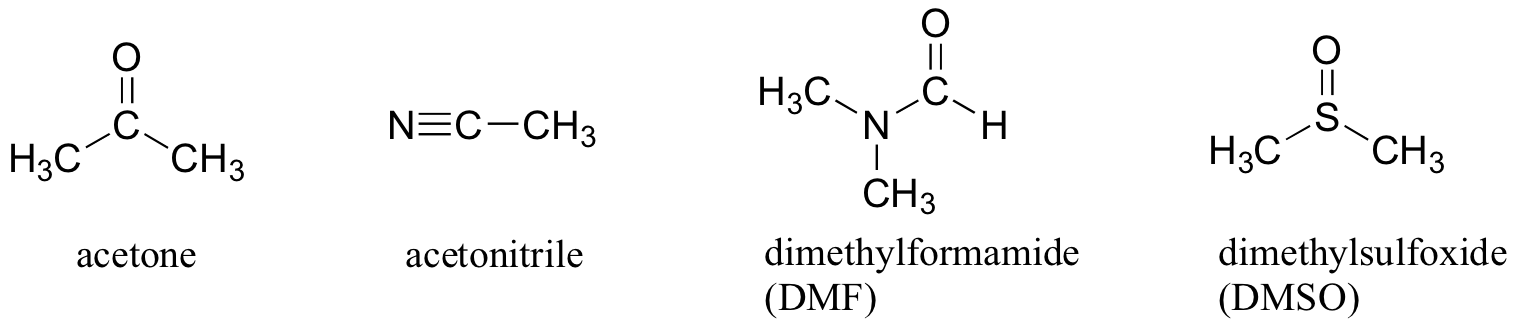
Miksi tähän reaktioon ei käytetä täysin ei-polaarista liuotinta, kuten heksaania, niin että liuotinkehikko poistuu kokonaan? Vastaus tähän on yksinkertainen – nukleofiilin on oltava liuoksessa reagoidakseen tuntuvalla nopeudella elektrofiilin kanssa, eikä heksaanin kaltainen liuotin solvaa a-varautunutta (tai erittäin polaarista) nukleofiilia lainkaan. Siksi kemistit käyttävät laboratoriossa nukleofiilisiin substituutioreaktioihin polaarisia aproottisia liuottimia: ne ovat niin polaarisia, että ne liuottavat nukleofiilin, mutta eivät niin polaarisia, että lukitsisivat sen läpitunkemattomaan liuotinhäkkiin. Asetonin lisäksi kolme muuta yleisesti käytettyä polaarista aproottista liuotinta ovat asetonitriili, dimetyyliformamidi (DMF) ja dimetyylisulfoksidi (DMSO).
biologisessa kemiassa, jossa liuotin on proottinen (vesi), nukleofiilisuuden jaksollisten kehityssuuntien tärkein seuraus on, että tiolit ovat voimakkaampia nukleofiileja kuin Alkoholit. Esimerkiksi kysteiiniaminohapon tioliryhmä on voimakas nukleofiili ja toimii usein nukleofiilina entsymaattisissa reaktioissa, ja tietysti negatiivisesti varautuneet tiolaatit (RS -) ovat vielä nukleofiilisempia. Tämä ei tarkoita sitä, etteivätkö seriinin, treoniinin ja tyrosiinin hydroksyyliryhmät toimisi myös nukleofiileina – ne toimivat.