tavoitteet
- metalli-ionien tunnetut ja tuntemattomat liuokset \(\ce{AG)^{+}}\), \(\ ce{Fe^{3+}}\), \(\ce {Co^{2+}}\), \(\ce{cu^{2+}}\) ja \(\ce{Hg^{2+}}\) analysoidaan paperikromatografialla.
- tuntematon liuos, joka sisältää joitakin näistä kationeista, tunnistetaan vertaamalla tunnettujen liuosten värjäytyneiden pisteiden Rf-arvoja ja värejä.
useimpien kemistien ja monien muiden tutkijoiden on rutiininomaisesti eroteltava seokset ja tunnistettava niiden komponentit. Kyky tunnistaa näytteestä löydetyt aineet laadullisesti voi olla kriittinen. Esimerkiksi ympäristökemisti, joka tutkii näytteitä saastuneesta pohjavedestä, haluaa tietää, mitä myrkyllisiä ioneja näytteessä saattaa olla.
kromatografia on ensimmäisiä tällaisissa tilanteissa käytettyjä työkaluja. Tässä tekniikassa monentyyppisiä seoksia voidaan erottaa ainesosaksi puhtaita aineita; vakionäytteeseen verrattuna jokainen aineosa voidaan myös alustavasti tunnistaa.
on olemassa monia kromatografialajikkeita, joista jokainen on suunniteltu erottamaan tietyntyyppiset seokset. Yhteistä jokaiselle kromatografiatyypille on, että liikkuva faasi (neste tai kaasu) työntyy stationäärifaasin (kiinteä) läpi. Taulukossa 1 luetellaan useita kromatografialajikkeita ja faasien tyypillisiä identiteettejä. Kokeessa käytetään paperikromatografiaa.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
kolonnikromatografian esimerkki (kuva 1) osoittaa tämän analyysimenetelmän tyypilliset ominaisuudet. Kaaviossa esitetään koe, jossa kaksikomponenttiseokselle tehdään kolonnikromatografia. Kolonni on pakattu kiinteään aineeseen, jota kutsutaan stationäärifaasiksi. Kolonniin kaadetaan nestemäinen liuotin tai elutointiliuos, joka kastelee kiinteän pakkausmateriaalin kokonaan. Tämän jälkeen seos lastataan märän kolonnin päälle ja lisätään eluenttia. Painovoima vetää liikkuvan faasin alas stationäärifaasin läpi ja seoksen komponentit alkavat liikkua kolonnin läpi eri nopeudella. Kaaviossa komponentti A liikkuu nopeammin kuin komponentti B; siten komponentti B säilyy kolonnissa pidempään kuin komponentti A. yleensä tämä johtuu näiden kahden yhdisteen liukoisuuserosta liuottimessa ja/tai erosta kiinteiden pakkausmateriaalien vetovoimassa. Kun sarakkeen yläosaan lisätään enemmän eluenttia, komponentit poistuvat lopulta sarakkeesta erikseen. Kolonnista poistumiseen kuluva aika, jota kutsutaan retentioajaksi, on toistettavissa kullekin komponentille asetetuissa olosuhteissa—liikkuvan ja stationäärifaasin identiteetit, lämpötila ja kolonnin leveys. Kun komponentit poistuvat kolonnista, liuotin voidaan poistaa haihduttamalla ja puhtaat komponentit voidaan analysoida tai tunnistaa.
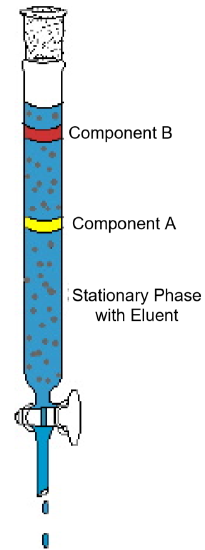
kuva 1: tyypillinen kolonnikromatografiakoe osoittaa kaksikomponenttiseoksen erottamisen.
aineosat voidaan alustavasti tunnistaa vertaamalla tuntematonta seosta huolellisesti valmisteltuun tunnettuun seokseen: jos tunnetulla aineosalla on samoissa olosuhteissa sama retentioaika kuin tuntemattomalla aineosalla, on todennäköistä—mutta ei varmaa—että aineosat ovat samat. Lisäanalyysi voi olla tarpeen tämän hypoteesin vahvistamiseksi. Jos tunnetulla ja tuntemattomalla on eri retentioajat, ei ole todennäköistä, että nämä kaksi komponenttia ovat identtisiä.
muissa kromatografian muunnelmissa käytetään kapillaaritoimintaa—nesteen vetämistä kiinteään pintaan—liuottimen vetämiseksi kiinteän aineen läpi. Paperikromatografian epävirallinen versio voidaan havaita, kun musteella kirjoitettu sivu joutuu kosketuksiin veden tai muiden nesteiden kanssa. Muste kulkee ja useita värejä erotetaan muste viirussa.
alla olevassa kaaviossa (kuva 2) esitetään ohutkerroskromatografiakokeen tulos. Kaksi mustaa mustetäplää kiinteällä pinnalla on saanut liuottimen kulkemaan niiden läpi. Liuotin on vettä tai muuta nestettä, joka vedetään stationäärifaasin läpi kapillaarivaikutuksella. Tässä esimerkissä stationäärifaasina käytetään muovinpalaa, joka on päällystetty jauhemaisella kiinteällä aineella. Vaihtoehtoisesti stationäärifaasina voidaan käyttää suodatinpaperia. Koe osoittaa, että musta muste on seos, joka sisältää useita erivärisiä aineita. Jokaisella komponentilla on hieman erilainen liukoisuus liikkuvassa faasissa, joten kun neste vedetään stationäärifaasin läpi, jokainen komponentti liikkuu eri nopeudella erottaen musteen erivärisiksi täpliksi.

kuva 2: mustan musteen ohutkerroskromatografia kehityksen jälkeen. Tämä kuva osoittaa yleisen ongelman, jossa täplät laajenevat, kun ne liikkuvat levyä ylöspäin ja lopulta sulautuvat levyn yläosaan.
tässä kokeessa käytetään samanlaisia periaatteita useiden metallikationien erottamiseen paperikromatografian avulla. Metalli-ionit – \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\),\(\ce {Co^{2+}}\), \(\ce{cu^{2+}}\), ja \(\ce{Hg^{2+}}\)—niillä on erilainen liukoisuus liikkuvassa faasissa—vesiliukoinen \(\ce{HCl}\) etyyli-ja butyylialkoholin kanssa-ja ne liikkuvat eri nopeudella paperia ylöspäin. Erilaiset metalli-ioniliukoisuudet johtuvat todennäköisesti siitä, että kloridi-ionin kanssa muodostuu erilaisia yhdisteitä ja niiden liukenemiskyky orgaaniseen liuottimeen vaihtelee.
alla on kaavio paperin valmistuksesta. Kutakin näistä ioneista sisältävät standardiliuokset täplitetään paperille kapillaariputken avulla, yhdessä kaikki viisi Ionia sisältävän standardiliuoksen kanssa. Tuntematon bongataan myös paperille. Kun paperi on valmis, sitä kehitetään sijoittamalla paperi eluenttiin. 75-90 minuutin kuluttua paperi visualisoidaan kostuttamalla se vesiliuoksella, joka sisältää kaliumjodidia \(\ce{KI}\) ja kaliumferrosyanidia \(\ce{K4}\). Kullekin Ionille havaittu ainutlaatuinen väri syntyy kemiallisella reaktiolla visualisointiliuoksella. Tämä on yksi hyödyllinen tapa tunnistaa, mitä ioneja esiintyy tuntemattomassa seoksessa.
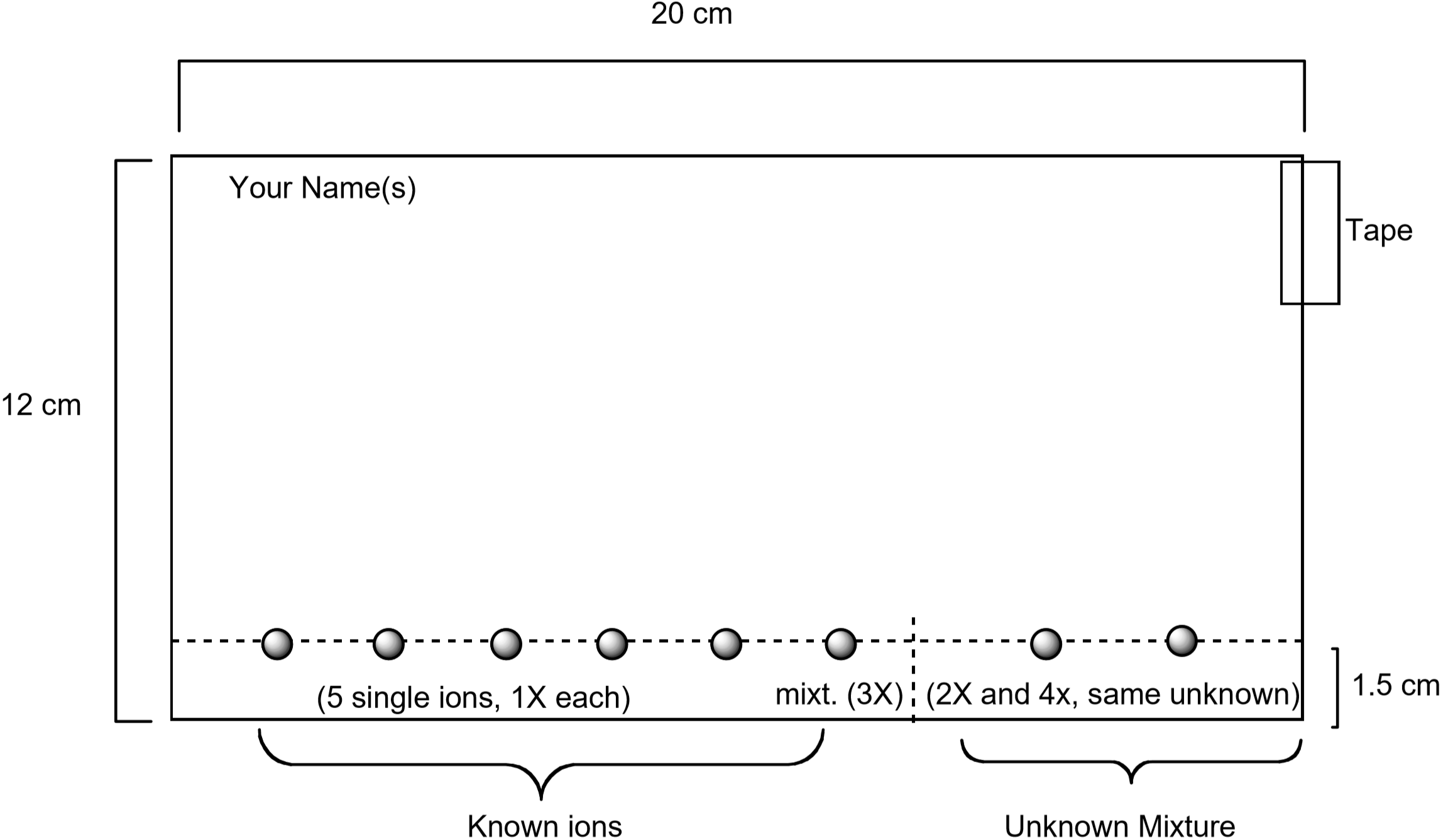
kuva 3: Diagrammi, joka näyttää, miten paperi valmistetaan kromatografiakoetta varten
voidaan käyttää myös ionin tunnistamiseen. Koska opiskelijat kuitenkin kehittävät kromatografiakokeitaan eri aikaa ja hieman eri olosuhteissa, jokaisella oppilaalla on jonkin ionin mitattu etäisyys jonkin verran erilainen. Ionin liikuttaman etäisyyden (\(D\)) ja liuottimen liikuttaman etäisyyden (\(F\), solvent front) suhde on tyypillinen ja sen pitäisi olla lähes sama kaikille opiskelijoille. Tätä suhdetta kutsutaan RF: ksi eli ”retentiokertoimeksi.”
\
menettely
materiaalit ja laitteet
Kemikaalit: 0.\(\Ce{AgNO3}\), \(\ce{HG(NO3)2}\), \(\ce{Fe(No3)3}\), \(\ce{Co(No3)2}\) ja \(\ce{Cu(no3)2}\)\) vesiliuokset, joissa kussakin on oma kapillaariputki; elutointiliuos (vesiliuos \(\ce{HCl}\) etyyli-ja butyylialkoholin kanssa); visualisointiliuos (vesiliuos \(\ce{KI}\) ja \(\CE{K4}\)).
laitteet: puhdas kromatografiapaperi; kertakäyttöiset lateksikäsineet (nitriilikäsineitä voi säilyttää varastossa Lateksiallergisille); 600 mL: n dekantterilasi; muovikelmu; pihdit tai dekantterilasipihdit; viivain *
* varastosta
turvallisuus
Vältä kosketusta metalli-ioniliuoksiin, elutoivaan liuottimeen ja visualisoivaan liuokseen. Käytä kertakäyttökäsineitä kromatogrammin koskettamiseen eluoinnin jälkeen ja kokeen loppuosan ajan. Elutoivan liuottimen tai visualisoivan liuoksen höyryjä ei saa hengittää. Aseta märkäkromatogrammi paperipyyhkeelle, ei suoraan laboratoriopenkille. Käytä visualisointiratkaisua vain opettajasi tarjoamassa tilassa. Hävitä käsineet ja kromatogrammi määrättyyn jäteastiaan kokeen päätyttyä. Pese kätesi huolellisesti, kun olet kosketellut kaikkia tässä laboratoriossa käytettäviä liuoksia.
paperin valmistaminen kromatografiaa varten
- jokaisen opiskelijaparin tulee hankkia suodatinpaperi, jonka mitat on esitetty kuvassa 3. Varmista, että paperi on puhdas ja ilman repeämiä tai taittumia. Käytä kynää—ei kynää-ja viivoitinta piirtääksesi paperin poikki yhden cm: n päähän paperin pitkästä reunasta. Näet metalli-ioniliuokset tällä linjalla. Kirjoita nimesi lyijykynällä paperin vasempaan yläkulmaan.
- harjoittele veden ja / tai ioniliuosten tiputtamista suodatinpaperiliuskalle, jotta osaat luoda oikeankokoisia täpliä. Käytä lasisia kapillaariputkia havaitaksesi ionit paperille. Liuos levitetään kevyesti ja nopeasti koskettamalla kapillaariputkea, jossa liuos on, paperille piirtämääsi viivaan. Täplien tulee olla halkaisijaltaan 5-8 mm. Tätä suuremmat täplät leviävät liikaa kokeen aikana ja tekevät analysoinnista vaikeaa.
- tiedossa 0.\(\Ce{AgNO3}\), \(\ce{HG(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) ja \(\ce{Cu(NO3)2}\) vesiliuoksia on 1 M koeputkissa, joissa kussakin on kaksi tai kolme kapillaariputkea. Merkitse jokaisen kohdan alla olevan ionin tunnistetiedot lyijykynällä vasemmalta alkaen; kiinnitä sitten jokainen tunnettu ioni huolellisesti viivalle. Varo saastuttamasta kapillaariputkea muilla ioneilla ja vaihda kapillaariputket takaisin oikeaan koeputkeen. Koeputkessa, jossa on kaikkien viiden ionin tunnettu seos, on myös joukko kapillaariputkia. Spot tämä seos päälle linjan samoin. Koska tämä liuos on laimeampaa kuin tunnetut yhden ionin liuokset, käytetään tunnettua seosta kolme kertaa ja annetaan pisteen kuivua jokaisen käyttökerran välillä. Lämpölamppu auttaa kuivaamaan kohdan nopeammin.
- koeputkissa on kapillaariputkien ohella myös useita tuntemattomia aineita. Ohjaaja kertoo, mitä tuntematonta kannattaa käyttää. Tuntemattomat aineet sisältävät yhdestä neljään kationia ja ovat laimeampia kuin tunnetut yhden ionin liuokset. Tuntematon on myös sovellettava kaksi ja neljä kertaa kaksi koetta, kerroit paikalla kuivua välillä kunkin hakemuksen. Virheen sattuessa tuntematon kannattaa bongata kahdesta kohdasta viivaa pitkin niin, että kaksi koetta on analysoitavissa.
Kromatografiapaperin kehittäminen
- Aseta teipinpala oikeaan yläreunaan Kuvan 3 mukaisesti. Muodosta sitten sylinteri liittämällä paperin kaksi lyhyttä reunaa nauhaan. Varmista, että reunat eivät kosketa. Paperin pitäisi näyttää samalta kuin kuvassa 4.
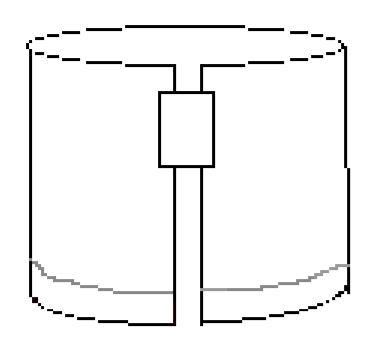
kuva 4: taitetun paperin pitäisi näyttää tältä ennen kokeen kehittämistä.
- saadaan 15 mL elutointiliuosta. Kaada osa tästä liuottimesta varovasti 600 mL: n dekantterilasiin ja pyörittele varovasti pari sekuntia. Varoitus: Älä hengitä höyryjä tästä liuoksesta! Varmista, että nesteen taso on paperin pisteviivan alapuolella, kun paperi on asetettu kehityskammioon.
- Aseta paperisylinteri dekantterilasiin, jonka merkitty reuna on alaspäin. Täplien tulee olla liuotinta suurempia. Paperi ei saa koskettaa dekantterin sivuja. Peitä dekantterilasi huolellisesti muovikelmulla ja aseta se konepeltiin 75-90 minuutiksi. Liuotin alkaa liikkua paperia ylöspäin. Kun dekantterilasi on peitetty, varmista, että se on tasolla, äläkä häiritse sitä kehityskauden aikana. Opettajallasi voi olla sinulle tehtävä, jota voit työstää odottaessasi.
paperin visualisointi ja analysointi
- kun kehityskausi on ohi, käytä kertakäyttökäsineitä ja poista paperi dekantterilasista. Lateksikäsineitä on saatavilla laboratoriossa ja nitriilikäsineitä varastossa Lateksiallergikoille. Anna mahdollisen liuottimen valua takaisin dekantterilasiin ja poista teippi. Aseta kromatografiapaperi paperipyyhkeelle ja merkitse liuotinrintama heti lyijykynällä. Kaada käytetty eluointiliuotin mukana toimitettuun jäteastiaan. Kuivaa paperi liesituulettimessa olevan lämpölampun alla. Varoitus: Älä hengitä höyryjä! Varo polttamasta paperia lampun alla.
- kun paperi on kuivunut, tuo se talouspaperin päällä olevalle visualisointiasemalle. Kasta paperi hetkeksi visualisoivaan liuokseen, joka sijaitsee matalassa astiassa liesituulettimessa. Nosta paperi välittömästi pois liuoksesta ja anna mahdollisen ylimääräisen tippua pois asemalla. Aseta märkä paperi kuivalle paperipyyhkeelle ja kuivaa se lämpölampun alla välittömästi ja vie se sitten penkkiin analysoitavaksi.
- etsi ensin jokainen tunnettu single-ioni ja tallenna havaitsemasi värit. Jotkin kohdat saattavat haalistua ajan myötä, joten tallenna värit paperin ollessa vielä märkä. Mittaa etäisyys kunkin pisteen siirretty, D, viivoittimella. Mittaa jokaisen kohdan keskelle. Tallenna tietosi datataulukkoon.
- mittaa etäisyys liuotinrintamaan, F. F: n arvon tulee olla suunnilleen sama koko paperilla. Näiden arvojen avulla lasketaan kunkin ionin Rf. Tee mittaukset Kuvan 5 mukaisesti. Jokaisella havaitulla paikalla on oma Rf-arvonsa. Kirjaa tuloksesi datataulukkoon.
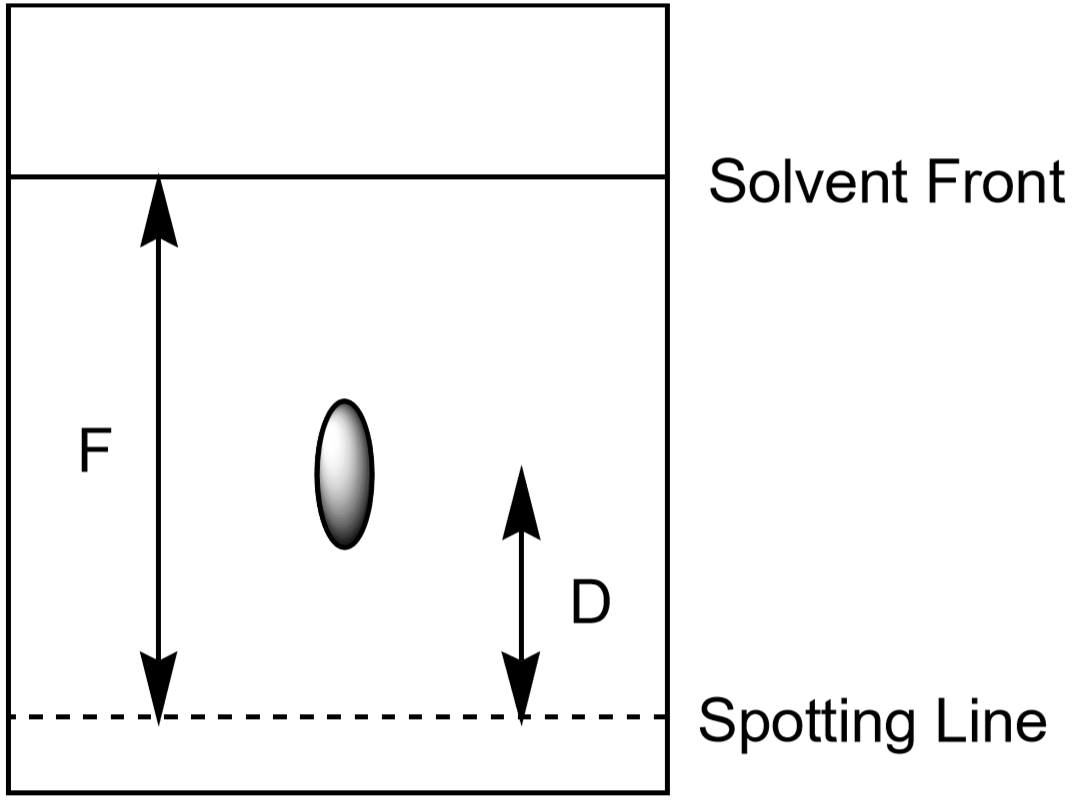
kuva 5: Pisteen Rf-arvon laskennassa käytettyjen etäisyyksien mittaaminen.
- etsi seoksen sisältävältä kaistalta jokainen ioni ja kirjaa muistiin kunkin ionin liikuttama matka. Laske Rf kunkin ionin tällä kaistalla. Arvojen tulisi vastata tarkasti yhden ionin knowneissa havaittuja arvoja.
- paikantaa tuntemattomat paikat sisältävällä kaistalla jokaisen havaitun pisteen keskipiste ja kirjaa muistiin sen etäisyys ja laske Rf-arvot. Käytä kaistaa, jolla on selkeimmät paikat. Tuntemattomien pisteiden väri-ja Rf-arvojen pitäisi vastata läheisesti joitakin tunnettuja ioneja. Sinun pitäisi nyt pystyä tunnistamaan, mitä Ionia tai ioneja löytyy tuntemattomasta. Tallenna tietosi vastaavaan taulukkoon.
- tee kromatogrammista luonnos laboratorion raporttilomakkeessa ilmoitettuun tilaan, jossa ilmoitat jokaisen kohdan sijainnin ja likimääräisen koon ja muodon paperille. Hävitä paperi nimettyyn jäteastiaan.
siivous
Aseta kromatografiapaperi ja käytetyt käsineet mukana toimitettuun jäteastiaan. Käytetty eluointiliuos olisi pitänyt jo laittaa toiseen jäteastiaan. Huomaa, että kaksi eri jäteastiat ovat tarjota tätä kokeilua niin muista lukea etiketit niin käytät oikea! Muista pestä kätesi huolellisesti ennen laboratoriosta poistumista.
Esilaboratoriotehtävä: Paperikromatografia
- kaksikomponenttiseos analysoidaan paperikromatografialla. Komponentti A liukenee liikkuvaan faasiin paremmin kuin komponentti B. saadaan seuraava tulos. Lasketaan kunkin komponentin Rf-arvo ja merkitään kunkin pisteen tunnistetiedot.
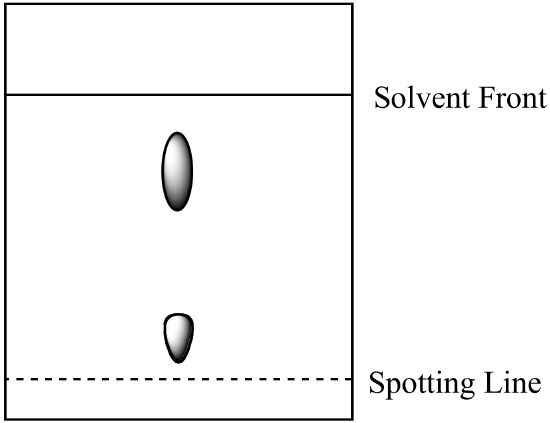
- edellä olevan kysymyksen 1 seos analysoidaan kolonnikromatografialla käyttäen samaa liikkuvaa faasia ja silikageeli-stationäärifaasia. Mikä komponentti on lyhyempi retentioaika? Selitä vastauksesi. (Oletetaan, että komponenttien ja stationäärifaasin väliset sidosvoimat ovat samantyyppisiä sekä paperikromatografiassa että kolonnikromatografiassa.)
- tuntematon nestenäyte analysoidaan paperikromatografialla käyttäen liikkuvana faasina liuotin X: ää. Yksi piste havaitaan sen jälkeen, kun levy on kehitetty ja visualisoitu. Sama tuntematon aine analysoidaan uudelleen liuottimella Y kuin liikkuva faasi. Tällä kertaa kolme täplää havaitaan sen jälkeen, kun levy on kehitetty ja visualisoitu.
- onko tuntematon näyte Puhdas aine vai seos? Selitä vastauksesi, mukaan lukien mahdollinen syy näiden kahden kokeen erilaisiin havaintoihin.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| tuntematon ID-koodi | ionit tunnistettu |
|---|---|
kysymykset ja johtopäätökset
- millä kriteereillä tunnistettiin tuntemattoman ioni(t)? Selitä vastauksesi ainakin kolmella lauseella. Sisältävät kaikki vaikeudet tunnistaa ioneja.