oppimistavoitteet
tämän osion loppuun mennessä pystyt:
- selittämään mikroskooppisten ja makroskooppisten suureiden väliset suhteet kaasussa
- ratkovat kaasuseoksiin liittyviä ongelmia
- ratkovat ongelmia, jotka liittyvät kaasumolekyylin törmäysten väliseen etäisyyteen ja aikaan
olemme tutkineet painetta ja lämpötilaa niiden makroskooppisten määritelmien perusteella. Paine on voima jaettuna alueella, johon voima kohdistuu, ja lämpötila mitataan lämpömittarilla. Voimme saada paremman käsityksen paineen ja lämpötilan kineettisestä kaasujen teoriasta, teoriasta, joka liittyy kaasujen makroskooppisiin ominaisuuksiin niiden molekyylien liikkeeseen, joista ne koostuvat. Ensin tehdään kaksi oletusta ideaalikaasun molekyyleistä.
- on olemassa hyvin suuri määrä n molekyylejä, jotka kaikki ovat samanlaisia ja jokaisella on massa m.
- molekyylit noudattavat Newtonin lakeja ja ovat jatkuvassa liikkeessä, joka on satunnaista ja isotrooppista eli sama kaikkiin suuntiin.
johtaaksemme ideaalikaasulain ja yhteyden mikroskooppisten suureiden, kuten tyypillisen molekyylin energian ja makroskooppisten suureiden, kuten lämpötilan, välillä analysoimme ideaalikaasun näytteen jäykässä säiliössä, josta teemme kaksi muuta oletusta:
- molekyylit ovat paljon pienempiä kuin niiden välinen keskimääräinen etäisyys, joten niiden kokonaistilavuus on paljon pienempi kuin niiden säiliön (jonka tilavuus on v). Toisin sanoen otamme van der Waalsin vakion b, kaasumolekyylien moolin tilavuuden, olemattomaksi verrattuna säiliössä olevan kaasun moolin tilavuuteen.
- molekyylit tekevät täydellisen elastisia törmäyksiä säiliön seinämiin ja toisiinsa. Muut niihin kohdistuvat voimat, kuten painovoima ja van der Waalsin vakion a edustamat vetovoimat, ovat mitättömiä (mikä on välttämätöntä isotropian oletukselle).
molekyylien väliset törmäykset eivät esiinny ideaalikaasulain derivoinnissa. Ne eivät myöskään häiritse derivointia, sillä satunnaisnopeuksilla liikkuvien molekyylien törmäykset antavat uusia satunnaisnopeuksia. Lisäksi jos kaasumolekyylien nopeudet säiliössä eivät aluksi ole satunnaisia ja isotrooppisia, molekyylitörmäykset tekevät niistä satunnaisia ja isotrooppisia.
teemme vielä lisäoletuksia, jotka yksinkertaistavat laskelmia, mutta eivät vaikuta tulokseen. Ensin annamme säiliön olla suorakulmainen laatikko. Toiseksi tarkastelemme aluksi yksiatomisia kaasuja, sellaisia, joiden molekyylit koostuvat yksittäisistä atomeista, kuten heliumista. Silloin voidaan olettaa, että atomeilla ei ole muuta energiaa kuin niiden translationaalinen kineettinen energia; esimerkiksi niillä ei ole rotaatio-eikä värähtelyenergiaa. (Myöhemmin keskustelemme tämän oletuksen pätevyydestä todellisille yksiatomisille kaasuille ja luovumme siitä diatomisten ja polyatomisten kaasujen tarkastelemiseksi.)
kuva \(\PageIndex{1}\) esittää kaasumolekyylin törmäyksen säiliön seinään siten, että se kohdistaa seinään voiman (Newtonin kolmannen lain mukaan). Nämä törmäykset ovat kaasun paineen lähde. Molekyylien määrän kasvaessa törmäysten määrä ja sitä kautta paine kasvaa. Vastaavasti jos molekyylien keskinopeus on suurempi, kaasun paine on suurempi.
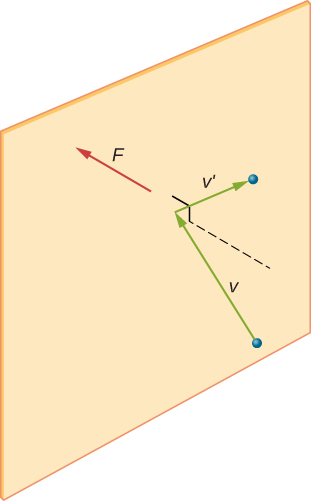
säiliössä olevassa kaasunäytteessä molekyyliliikkeen satunnaisuus aiheuttaa sen, että molekyylien törmäysten määrä jonkin seinän osan kanssa tietyssä ajassa vaihtelee. Koska valtava määrä molekyylejä kuitenkin törmää seinään lyhyessä ajassa, mittaamiemme ajan ja avaruuden asteikkojen törmäysten määrä vaihtelee vain pienen pienen, tavallisesti havaitsemattoman murto-osan keskiarvosta. Voimme verrata tätä tilannetta kasino, jossa tulokset vedot ovat satunnaisia ja kasinon ottoja vaihtelevat minuutti ja tunti. Pitkinä aikoina, kuten vuodessa, kasinon otteet ovat kuitenkin hyvin lähellä kertoimista odotettuja keskiarvoja. Bensatankissa on valtavasti enemmän molekyylejä kuin kasinolla on vedonlyöjiä vuodessa, ja molekyylit tekevät valtavasti enemmän törmäyksiä sekunnissa kuin kasinolla on vetoja.
laskemalla molekyylien laatikon seinämiin kohdistama keskimääräinen voima päästään ideaalikaasulakiin ja lämpötilan ja molekyylien liike-energian väliseen yhteyteen. (Itse asiassa otamme kaksi keskiarvoa: yksi ajan saat keskimääräinen voima kohdistetaan yhden molekyylin tietyn nopeuden, ja sitten toinen keskiarvo yli molekyylien eri nopeudet.) Tämän lähestymistavan kehitti Daniel Bernoulli (1700-1782), joka tunnetaan fysiikassa parhaiten työstään fluidivirtauksen (Hydrodynamiikka) parissa. Merkillistä, Bernoulli teki tätä työtä ennen Dalton perustettu näkemys asia koostuu atomeja.
Kuvassa \(\PageIndex{2}\) näkyy kaasusäiliö täynnä kaasua ja laajennettu näkymä kaasumolekyylin kimmoisesta törmäyksestä säiliön seinään, joka on jaettu osiin. Olemme olettaneet, että molekyyli on pieni verrattuna molekyylien erottumiseen kaasussa, ja että sen vuorovaikutus muiden molekyylien kanssa voidaan jättää huomiotta. Näissä olosuhteissa ideaalikaasulaki on kokeellisesti Pätevä. Koska olemme myös olettaneet, että seinä on jäykkä ja hiukkaset ovat pisteitä, törmäys on joustava (energian säästämisen ansiosta-hiukkasen liike-energia ei pääse minnekään). Siksi molekyylin liike-energia pysyy vakiona, ja näin ollen myös sen nopeus ja liikemäärän suuruus pysyvät vakiona. Tämä oletus ei aina pidä paikkaansa, mutta tämän moduulin loppuosan tulokset saadaan myös malleissa, joiden avulla molekyylit vaihtavat energiaa ja liikemäärää seinän kanssa.
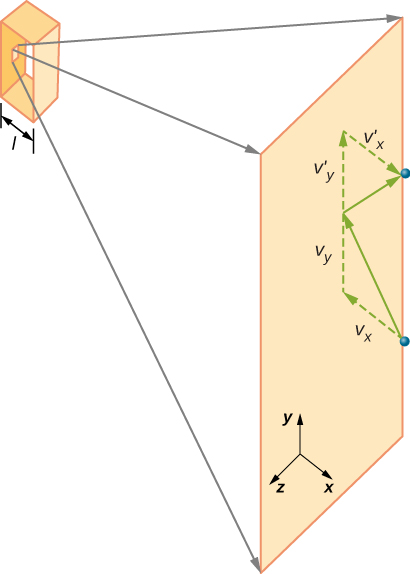
Jos molekyylin nopeus muuttuu x-suunnassa, sen liikemäärä muuttuu \(-m_x\) \(+mv_x\). Siten sen liikemäärän muutos on \(\Delta mv = +mv_x- (- mv_x) = 2mv_x\). Lineaarimomenttia ja törmäyksiä käsittelevässä luvussa annetun impulssi-liikemomentti-lauseen mukaan I: n molekyyliin kohdistuva voima, jossa I merkitsee molekyylit 1: stä N: ään, saadaan \
(pelkästään tässä yhtälössä p edustaa liikemomenttia, ei painetta.) Seinän ja molekyylin välillä ei ole voimaa paitsi silloin, kun molekyyli koskettaa seinää. Lyhyen törmäysajan aikana molekyylin ja seinän välinen voima on suhteellisen suuri, mutta se ei ole etsimämme voima. Etsimme keskimääräistä voimaa, joten otamme \(\Delta t\) olevan keskimääräinen aika tietyn molekyylin törmäysten välillä tämän seinän kanssa, mikä on aika, jolloin odotamme löytävämme yhden törmäyksen. Olkoon l edustamaan laatikon pituutta x-suunnassa. Silloin \(\Delta T\) on aika, jonka molekyyli veisi mennä laatikon yli ja takaisin, etäisyys 2l, nopeudella \(v_x\). Näin \(\delta t = 2L/v_x\), ja voiman lausekkeeksi tulee
\
Tämä voima johtuu yhdestä molekyylistä. Löytääksemme seinän kokonaisvoiman, F, meidän on lisättävä kaikkien n-molekyylien osuus.:
\
käytämme nyt keskiarvon määritelmää, jonka merkitsemme tangolla, löytääksemme voiman:
\
haluamme voiman nopeuden v suhteen, emmekä nopeuden X-komponenttia. Huomaa, että kokonaisnopeuden neliö on sen komponenttien neliöiden summa siten, että
\
oikean puolen kolme keskiarvoa ovat yhtä suuret, joten
\
korvaamalla tämä lausekkeeksi F antaa
\
paine on F/A, joten saamme
\ missä käytimme \(V = Al\) tilavuudelle. Näin saadaan tärkeä tulos
yhdistämällä tämä yhtälö\(pV = Nk_BT\), saadaan
\
saadaan molekyylin keskimääräinen liike-energia\(\frac{1}{2}m\overline{v}^2\) yhtälön vasemmalta puolelta jakamalla N ja kertomalla 3/2.
keskimääräinen kineettinen energia molekyyliä kohti
molekyylin keskimääräinen kineettinen energia on suoraan verrannollinen sen absoluuttiseen lämpötilaan:
\
yhtälö \(\overline{k} = \frac{3}{2} k_BT\) on keskimääräinen kineettinen energia molekyyliä kohti. Huomaa erityisesti, että mikään tässä yhtälössä ei riipu kaasun molekyylimassasta (tai muusta ominaisuudesta), paineesta tai muusta kuin lämpötilasta. Jos helium-ja ksenonkaasun näytteet, joiden molekyylimassat ovat hyvin erilaiset, ovat samassa lämpötilassa, molekyyleillä on sama keskimääräinen liike-energia.
termodynaamisen systeemin sisäenergia on kaikkien siinä olevien molekyylien mekaanisten energioiden summa. Voimme nyt antaa yhtälön yksikatomisen ideaalikaasun sisäenergialle. Tällaisessa kaasussa molekyylien ainoa energia on niiden translationaalinen kineettinen energia. Näin ollen ilmaisemalla sisäenergiaa \(e_{int}\) meillä on yksinkertaisesti \(e_{int} = n\overline{k}\), tai
\
usein haluaisimme käyttää tätä yhtälöä mooleina:
\
voimme ratkaista \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_bt\) tyypilliselle molekyylin nopeudelle Ideaalikaasussa lämpötilan suhteen, jotta voidaan määrittää niin sanottu molekyylin Root-Mean-Square (RMS) – nopeus.
molekyylin RMS-nopeus
molekyylin neliöjuuri tai nopeuden \(\overline{v}^2\) neliöjuuri on
\
RMS-nopeus ei ole molekyylien keskimääräinen tai todennäköisin nopeus, kuten näemme molekyylin nopeuksien jakautumisesta, mutta se antaa helposti laskettavan arvion molekyylien nopeudesta, joka on liittyvät niiden liike-energiaan. Jälleen voimme kirjoittaa tämän yhtälön kannalta kaasun vakio R ja moolimassa M kg / mol:
\
poikkeamme hetkeksi vastaamaan kysymykseen, joka on saattanut tulla mieleesi: kun sovellamme mallia atomeihin teoreettisten pistehiukkasten sijaan, muuttaako rotaatiokineettinen energia tuloksiamme? Voidaksemme vastata tähän kysymykseen meidän on vedottava kvanttimekaniikkaan. Kvanttimekaniikassa rotaatiokineettinen energia ei voi ottaa mitä tahansa arvoa; se rajoittuu diskreettiin arvojoukkoon, ja pienin arvo on kääntäen verrannollinen rotaatio-inertiaan. Atomin pyörimisinertia on pieni, koska lähes kaikki sen massa on ytimessä, jonka säde on tyypillisesti alle \(10^{-14} m\). Atomin pienin pyörimisenergia on siis paljon enemmän kuin \(\frac{1}{2}k_BT\) missä tahansa saavutettavissa olevassa lämpötilassa, eikä käytettävissä oleva energia riitä atomin pyörimiseen. Palaamme tähän kohtaan käsitellessämme diatomisia ja polyatomisia kaasuja seuraavassa jaksossa.
esimerkki \(\PageIndex{1}\): Lasketaan Kaasumolekyylin liike-energia ja nopeus
- mikä on kaasumolekyylin keskimääräinen liike-energia \(20,0^oc\) (huoneenlämpötilassa)?
- Etsi typpimolekyylin RMS-nopeus (\(n_2\)) tässä lämpötilassa.
strategia
(a) keskimääräisen kineettisen energian yhtälössä tunnettu on lämpötila:
\
ennen arvojen korvaamista tähän yhtälöön on muunnettava annettu lämpötila kelviniksi: \(t = (20.0 + 273)\, K = 293\, K\). Typpimolekyylin RMS-nopeus voidaan löytää yhtälön
\
avulla, mutta ensin on löydettävä typpimolekyylin massa. Saadessamme typen moolimassan \(N_2\) jaksollisesta järjestelmästä huomaamme
\
ratkaisu
- pelkkä lämpötila riittää keskimääräisen translationaalisen kineettisen energian löytämiseen. Lämpötilan korvaaminen translationaalisessa kineettisen energian yhtälössä antaa \
- tämän massan ja \(k_B\) arvon korvaamisella \(v_{RMS}\) yhtälölle \
merkitsevyys
huomaa, että molekyylin keskimääräinen kineettinen energia on riippumaton molekyylin tyypistä. Keskimääräinen translationaalinen liike-energia riippuu vain absoluuttisesta lämpötilasta. Liike-energia on hyvin pieni verrattuna makroskooppisiin energioihin, joten emme tunne, kun ilmamolekyyli osuu ihoomme. Toisaalta se on paljon suurempi kuin tyypillinen gravitaatiopotentiaalienergian ero, kun molekyyli liikkuu vaikkapa huoneen ylhäältä alas, joten gravitaation laiminlyönti on perusteltua tyypillisissä reaalimaailman tilanteissa. Typpimolekyylin RMS-nopeus on yllättävän suuri. Nämä suuret molekyylinopeudet eivät tuota ilman makroskooppista liikettä, koska molekyylit liikkuvat kaikkiin suuntiin yhtä suurella todennäköisyydellä. Keskimääräinen vapaa polku (etäisyys molekyyli liikkuu keskimäärin välillä törmäykset, käsitellään hieman myöhemmin tässä jaksossa) molekyylien ilmassa on hyvin pieni, joten molekyylit liikkuvat nopeasti, mutta eivät pääse kovin pitkälle sekunnissa. Rms-nopeuden suuri arvo näkyy äänen nopeudessa, joka on huoneenlämmössä noin 340 m/s. Mitä suurempi ilmamolekyylien RMS-nopeus on, sitä nopeammin äänivärähtelyt voivat siirtyä ilman läpi. Äänen nopeus kasvaa lämpötilan myötä ja on suurempi kaasuilla, joilla on pienet molekyylimassat, kuten heliumilla (KS.Kuva \(\PageIndex{3}\)).
Example \(\PageIndex{2}\): Calculating Temperature: Escape Velocity of Helium Atoms
paetakseen maan painovoimaa, atmosfäärin huipun lähellä (100 km: n korkeudessa) olevan kappaleen on kuljettava pois maasta nopeudella 11,1 km / s. tätä nopeutta kutsutaan pakonopeudeksi. Missä lämpötilassa heliumatomien RMS-nopeus olisi yhtä suuri kuin pakonopeus?
strategia
tunnista tuntemattomat ja tuntemattomat ja määritä, mitä yhtälöitä käytetään ongelman ratkaisemiseksi.
Solution
- Identify the knowns: v on pakonopeus, 11,1 km/s.
- Identify the unknowns: We need to solve for temperature, T. We also need to solve for the mass m of the helium atom.
- määritä, mitä yhtälöitä tarvitaan.
- saadaksemme heliumatomin massan m, Voimme käyttää tietoa jaksollisesta järjestelmästä: \
- ratkaistaksemme lämpötilan T, voimme järjestää \ saadaksemme \
- korvata tunnetut arvot yhtälöihin ja ratkaista tuntemattomat, \ ja \
merkitys
Tämä lämpötila on paljon korkeampi kuin ilmakehän lämpötila, joka on noin 250 K (\(-25^oC\) tai \(-10^of\)) korkealla korkeudessa. Hyvin vähän heliumatomeja on jäljellä ilmakehässä, mutta monia oli läsnä, kun ilmakehä muodostui, ja lisää syntyy aina radioaktiivisen hajoamisen seurauksena (KS.ydinfysiikkaa käsittelevä luku). Syynä heliumatomien häviämiseen on se, että pienellä määrällä heliumatomeja on maan pakonopeutta suuremmat nopeudet myös normaalilämpötiloissa. Heliumatomin nopeus muuttuu törmäyksestä toiseen niin, että minä hetkenä hyvänsä on pieni mutta ei-Zero mahdollisuus, että atomin nopeus on suurempi kuin pakonopeus. Mahdollisuus on niin suuri, että maan eliniän aikana lähes kaikki ilmakehässä olleet heliumatomit ovat saavuttaneet pakonopeuden korkealla ja paenneet maan vetovoimasta. Raskaammilla molekyyleillä, kuten hapella, typellä ja vedellä, on pienemmät rms-nopeudet, joten on paljon epätodennäköisempää, että yhdelläkään niistä olisi suurempi nopeus kuin poistumisnopeus. Todennäköisyys on itse asiassa niin pieni, että tarvitaan miljardeja vuosia merkittävien raskaampien molekyylien menettämiseen ilmakehästä. Kuva \(\PageIndex{4}\) näyttää ilmakehän puutteen vaikutuksen Kuuhun. Koska kuun vetovoima on paljon heikompi, se on menettänyt lähes koko ilmakehänsä. Maan ja muiden kappaleiden ilmakehiä verrataan tämän luvun harjoituksissa.

Exercise \(\PageIndex{2}\)
Jos ajatellaan hyvin pientä kohdetta, kuten siitepölyhiukkasta, kaasussa, niin myös sen pintaan iskeytyvien molekyylien määrä olisi suhteellisen pieni. Odottaisitko siitepölyhiukkasen kokevan paineen vaihteluja, jotka johtuvat siihen törmäävien kaasumolekyylien lukumäärän tilastollisista vaihteluista tietyssä ajassa?
vastaus
Kyllä. Tällaisia vaihteluita esiintyy todellisuudessa minkä tahansa kokoiselle kappaleelle kaasussa, mutta koska molekyylien määrä on valtava makroskooppisille kappaleille, vaihtelut ovat pieni prosentti törmäysten määrästä, ja tässä jaksossa mainitut keskiarvot vaihtelevat huomaamattomasti. Karkeasti ottaen vaihtelut ovat kääntäen verrannollisia törmäysten määrän neliöjuureen, joten pienille kappaleille niistä voi tulla merkittäviä. Tämä havaittiin itse asiassa yhdeksännellätoista vuosisadalla siitepölyhiukkasten vedessä ja se tunnetaan Brownin liike.
Höyrynpaine, osapaine ja Daltonin laki
painetta, jonka kaasu synnyttäisi, jos se miehittäisi käytettävissä olevan kokonaistilavuuden, kutsutaan kaasun osapaineeksi. Jos kaksi tai useampia kaasuja sekoittuu, ne tulevat termiseen tasapainoon molekyylien välisten törmäysten seurauksena; prosessi on analoginen lämmönjohtumisen kanssa, kuten kuvataan luvussa lämpötila ja lämpö. Kuten olemme nähneet kineettisestä teoriasta, kun kaasuilla on sama lämpötila, niiden molekyyleillä on sama keskimääräinen kineettinen energia. Siten jokainen kaasu noudattaa ideaalikaasulakia erikseen ja kohdistaa säiliön seinämiin saman paineen kuin yksin ollessaan. Kaasuseoksessa kokonaispaine on siis komponenttikaasujen osapaineiden summa olettaen ideaalikaasujen käyttäytymistä eikä komponenttien välillä ole kemiallisia reaktioita. Tämä laki tunnetaan Daltonin osapainelakina englantilaisen tiedemiehen John Daltonin (1766-1844) ehdottaman mukaan. Daltonin laki on yhtäpitävä sen kanssa, että paineet lisääntyvät Pascalin periaatteen mukaisesti.
ideaalikaasujen seoksessa termisessä tasapainossa kunkin kaasun molekyylien lukumäärä on verrannollinen sen osapaineeseen. Tämä tulos seuraa ideaalikaasulain soveltamisesta jokaiseen muodossa \(p/n = RT / V\). Koska oikeanpuoleinen puoli on sama mille tahansa kaasulle tietyssä lämpötilassa tietyn tilavuuden astiassa, myös vasen puoli on sama.
- osapaine on paine, jonka kaasu loisi, jos se olisi olemassa yksin.
- Daltonin lain mukaan kokonaispaine on kaikkien läsnä olevien kaasujen osapaineiden summa.
- mille tahansa kahdelle kaasulle (merkitty 1 ja 2), jotka ovat tasapainossa säiliössä, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
tärkeä osapaineen sovellus on se, että kemiassa se toimii kaasun konsentraationa määritettäessä reaktionopeutta. Tässä mainitsemme vain sen, että hapen osapaine ihmisen keuhkoissa on elintärkeä elämälle ja terveydelle. Hengitysilma, jonka hapen osapaine on alle 0,16 atm, voi heikentää koordinaatiota ja arvostelukykyä erityisesti ihmisillä, jotka eivät ole sopeutuneet korkeaan korkeuteen. \(O_2\): n pienemmillä osapaineilla on vakavampia vaikutuksia; alle 0,06 atm: n osapaineet voivat olla nopeasti kohtalokkaita, ja pysyvät vauriot ovat todennäköisiä, vaikka henkilö pelastettaisiin. Tunne siitä, että on tarpeen hengittää, kuten hengityksen pidättäminen, johtuu kuitenkin paljon enemmän veren suurista hiilidioksidipitoisuuksista kuin alhaisista happipitoisuuksista. Jos siis pieni huone tai Komero on täynnä ilmaa, jossa on alhainen happipitoisuus, ehkä siksi, että siellä on varastoituna vuotava sylinteri paineistettua kaasua, ihminen ei tunne mitään ”tukehtumisen” tunnetta, ja hän voi kouristella tai menettää tajuntansa huomaamatta mitään väärää. Turvallisuusinsinöörit kiinnittävät paljon huomiota tähän vaaraan.
toinen tärkeä osapaineen sovellus on höyrynpaine, joka on sellaisen höyryn osapaine, jossa se on tasapainossa saman aineen nestemäisen (tai kiinteän sublimaation tapauksessa) faasin kanssa. Missään lämpötilassa ilman veden osapaine ei voi ylittää veden höyrynpainetta kyseisessä lämpötilassa, koska aina kun osapaine saavuttaa höyrynpaineen, vesi tiivistyy ilmasta. Kaste on esimerkki tästä tiivistymisestä. Lämpötilaa, jossa ilmanäyte tiivistyy, kutsutaan kastepisteeksi. Se mitataan helposti jäähdyttämällä metallipalloa hitaasti; kastepiste on lämpötila, jossa tiivistyminen näkyy pallossa ensimmäisen kerran.
veden höyrynpaineet joissakin meteorologian kannalta merkittävissä lämpötiloissa on esitetty taulukossa\(\PageIndex{1}\).
| T(\(^oc\)) | Höyrynpaine (Pa) |
|---|---|
| 0 | 610,5 |
| 3 | 757,9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) lämpötilassa T määritellään
\
suhteellinen kosteus \(100\%\) tarkoittaa, että veden osapaine on yhtä suuri kuin höyrynpaine; toisin sanoen ilma on kylläinen vedellä.
esimerkki \(\PageIndex{3}\): lasketaan suhteellinen kosteus
mikä on suhteellinen kosteus, kun ilman lämpötila on \(25^oC\) ja kastepiste on \(15^oC\)?
strategia
me yksinkertaisesti katsomme ylös höyrynpaineen tietyssä lämpötilassa ja kastepisteessä ja löydämme suhteen.
ratkaisu
\
merkitys
R. H. on tärkeä mukavuudellemme. Arvo \(53.8\%\) on alueella \(40\%\) \(60\%\) suositellaan mukavuutta sisätiloissa.
kuten lämpötilaa ja lämpöä käsittelevässä luvussa todetaan, lämpötila laskee harvoin kastepisteen alapuolelle, koska kun se saavuttaa kastepisteen tai pakkaspisteen, vesi tiivistyy ja vapauttaa suhteellisen paljon latenttia höyrystymislämpöä.
Mean Free Path and Mean Free Time
we now considered törmäykset eksplisiittisesti. Tavallinen ensimmäinen askel (joka on kaikki mitä otamme) on laskea keskimääräinen vapaa polku, \(\lambda\), keskimääräinen etäisyys molekyyli kulkee välillä törmäykset muiden molekyylien, ja keskimääräinen vapaa aika \(\tau\), keskimääräinen aika välillä törmäykset molekyylin. Jos oletamme, että kaikki molekyylit ovat palloja, joiden säde on \(r\), molekyyli törmää toiseen, jos niiden keskukset ovat etäisyydellä 2R toisistaan. Tietylle hiukkaselle sanomme, että ympyrän pinta-ala, jonka säde on \(4\pi r^2\), on” poikkileikkaus ” törmäyksille. Kun hiukkanen liikkuu, se jäljittää sylinterin, jolla on poikkipinta-ala. Keskimääräinen vapaa polku on pituus \(\lambda\) siten, että odotettu määrä muita molekyylejä sylinterissä pituus \(\lambda\) ja poikkileikkaus \(4\pi r^2\) on 1. Jos sivuutamme väliaikaisesti muiden molekyylien liikkeen kuin tarkasteltavan, odotettu luku on molekyylien lukumäärätiheys, N/V, kertaa tilavuus, ja tilavuus on \(4\pi r^2 \lambda\), joten meillä on \((n/V)4\pi r^2 \lambda = 1\), tai
\
\
kaikkien molekyylien liikkeen huomioiminen tekee laskemisesta paljon vaikeampaa, mutta ainoa muutos on tekijä \(\sqrt{2}\). Tuloksena on
\
ideaalikaasussa voidaan \(V/n = k_BT/p\) saada
\
keskimääräinen vapaa-aika \(\tau\) on yksinkertaisesti keskimääräinen vapaa polku jaettuna tyypillisellä nopeudella, ja tavallinen valinta on rms-nopeus. Sitten
laskettaessa keskimääräistä vapaa-aikaa
Etsi argonatomien keskimääräinen vapaa-aika (\(m = 39.9\, g / mol\)) lämpötilassa\ (0^oc\) ja paineessa 1,00 atm. Oletetaan, että argonatomin säde on \(1,70 \kertaa 10^{-10} \ space m\).
ratkaisu
- tunnista tietäjät ja muuntaa SI-yksiköiksi. Moolimassa on 0.0399 kg/mol, lämpötila on 273 K, paine on \(1,01 \kertaa 10^5 \, Pa\) ja säde on \(1,70 \kertaa 10^{-10}\, m\).
- Etsi RMS-nopeus: \(v_{rms} = \sqrt{\frac{3RT}{M}} = 413 \, m / s\).
- korvaa yhtälössä keskimääräisen vapaa-ajan: \
merkitys
emme voi verrata tätä tulosta intuitioomme kaasumolekyyleistä, mutta se antaa meille kuvan molekyylien törmäyksestä erittäin suurella taajuudella.
liikunta \(\PageIndex{4}\)
kummalla on pidempi keskimääräinen vapaa polku, nestemäisellä vedellä tai vesihöyryllä ilmassa?
vastaus
nesteessä molekyylit ovat hyvin lähellä toisiaan törmäten jatkuvasti toisiinsa. Jotta kaasu olisi lähes ihanteellinen, koska ilma on tavallisissa olosuhteissa, molekyylien täytyy olla hyvin kaukana toisistaan. Siksi keskimääräinen vapaa tie on paljon kauemmin ilmassa.
Contributors and Attributions
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) ja Bill Moebs, joilla on monia myötävaikuttaneita kirjoittajia. Tämä teos on lisensoitu OpenStax University Physics Creative Commons Attribution-lisenssillä (4.0).