Allyylikarbokationin Molekyyliorbitaalit
propeenin karbokationin stabiilisuus johtuu konjugoituneesta π-elektronisysteemistä. ”Kaksoissidosta” ei oikeastaan ole olemassa. Sen sijaan se on ryhmä 3 vierekkäiset, päällekkäiset, ei-hybridisoituneet p-orbitaalit kutsumme konjugoitu π elektronijärjestelmä. Näet selvästi kaikkien kolmen P-orbitaalin väliset vuorovaikutukset kolmesta hiilestä, mikä johtaa todella vakaaseen kationiin. Kaikki riippuu elektronipuutteisen hiilen sijainnista.
Molekyyliorbitaalien kuvaukset voivat selittää allyylisen stabiilisuuden vielä toisella tavalla käyttämällä 2-propenyyliä. Kuva.6
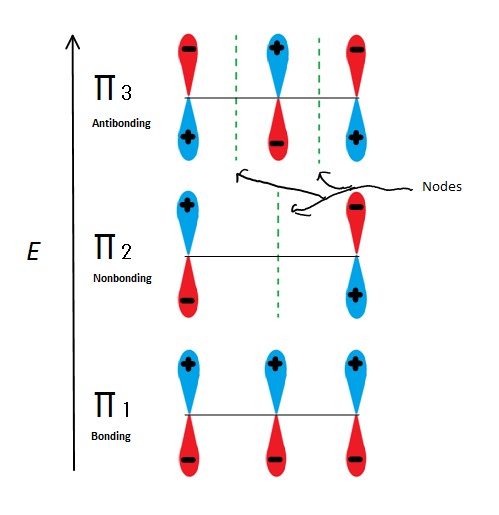
Fig.6 näyttää 3 mahdollista 2-propenyylin Molekyyliorbitaalia
jos otamme vain π-molekyyliorbitaalin eikä mitään S: stä, saamme niistä kolme. π1 on sidos ilman solmuja, π2 on nonbonding (toisin sanoen sama energia kuin säännöllinen p-orbitaali) solmun kanssa, ja π3 on antibonding kanssa 2 solmua (yksikään orbitaalit ovat vuorovaikutuksessa). Kaksi ensimmäistä elektronia menevät π1-molekyyliorbitaalille riippumatta siitä, onko kyseessä kationi, radikaali vai anioni. Jos se on radikaali tai anioni, seuraava elektroni menee π2-molekyyliorbitaalille. Viimeinen anionielektroni menee myös nonbonding orbitaalille. Joten riippumatta siitä, millainen hiilikeskus on olemassa, yksikään elektroni ei koskaan mene antibonding orbitaalille.
Sidosorbitaalit ovat pienienergiaisimmat orbitaalit ja ovat suotuisat, minkä vuoksi ne täytetään ensin. Vaikka sitoutumattomat orbitaalit voidaan täyttää, systeemin kokonaisenergia on silti pienempi ja vakaampi täytettyjen sidosmolekyyliorbitaalien vuoksi.
tämä luku osoittaa myös, että π2 on ainoa molekyyliorbitaali, jossa elektroni eroaa, ja myös siinä yksi solmu kulkee keskikohdan läpi. Tämän vuoksi molekyylin varaukset ovat pääasiassa kahdessa terminaalisessa hiilessä eikä keskimmäisessä hiilessä.
tämä molekyyliorbitaalien kuvaus voi havainnollistaa myös allyylisten hiilikeskusten stabiilisuutta kuvassa 7.
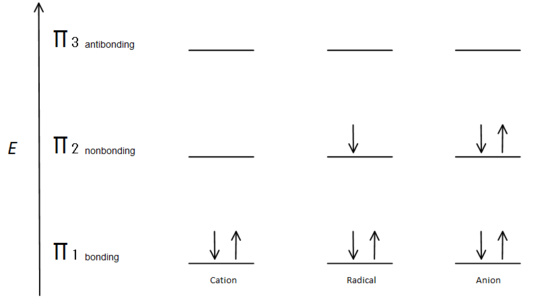
Fig.7 kaavio, joka osoittaa, miten elektronit täyttyvät Aufbau-periaatteen mukaisesti.
π: n sidosorbitaalin energia on pienempi kuin bonding-orbitaalin. Koska jokaisessa esitetyssä hiilikeskuksessa on kaksi elektronia alemmalla energialla, sidosenergialla π-orbitaaleilla, kunkin systeemin energia alenee kokonaisuudessaan (ja siten vakaammaksi) kationista, radikaalista tai anionista riippumatta.