Find kilder: “Single bond” – nyheder · aviser · bøger · scholar · JSTOR (August 2012) (Lær hvordan og hvornår denne skabelonmeddelelse skal fjernes)
i kemi er en enkelt binding en kemisk binding mellem to atomer, der involverer to valenselektroner. Det vil sige, atomerne deler et par elektroner, hvor bindingen dannes. Derfor er en enkeltbinding en type kovalent binding. Når de deles, er hver af de to involverede elektroner ikke længere i den eneste besiddelse af den orbital, hvori den stammer fra. Snarere bruger begge de to elektroner tid i en af orbitalerne, der overlapper hinanden i bindingsprocessen. En enkelt binding betegnes som en enkeltbinding eller A-A, for hvilken A repræsenterer et element (Moore, Stanitskiog Jurs 329). I den første gengivelse repræsenterer hver prik en delt elektron, og i den anden gengivelse repræsenterer stangen begge de elektroner, der deles i enkeltbindingen.

en kovalent binding kan også være en dobbeltbinding eller en tredobbelt binding. En enkeltbinding er svagere end enten en dobbeltbinding eller en tredobbelt binding. Denne forskel i styrke kan forklares ved at undersøge de komponentbindinger, som hver af disse typer kovalente bindinger består af (Moore, Stanitski og Jurs 393).
normalt er en enkelt binding en sigma-binding. En undtagelse er obligationen i diboron, som er en pi-obligation. I modsætning hertil består dobbeltbindingen af en sigma-obligation og en pi-obligation, og en tredobbelt obligation består af en sigma-obligation og to pi-obligationer (Moore, Stanitskiog Jurs 396). Antallet af komponentbindinger er det, der bestemmer styrkeforskellen. Det er grunden til, at enkeltbindingen er den svageste af de tre, fordi den kun består af en sigma-binding, og dobbeltbindingen eller tredobbelt binding består ikke kun af denne type komponentbinding, men også mindst en yderligere binding.
enkeltbindingen har kapacitet til rotation, en egenskab, der ikke besiddes af dobbeltbindingen eller den tredobbelte binding. Strukturen af pi-obligationer tillader ikke rotation (i det mindste ikke ved 298 K), så dobbeltbindingen og den tredobbelte binding, der indeholder pi-obligationer, holdes på grund af denne egenskab. Sigma-bindingen er ikke så restriktiv, og enkeltbindingen er i stand til at rotere ved hjælp af sigma-bindingen som rotationsakse (Moore, Stanitskiog Jurs 396-397).
en anden egenskabssammenligning kan foretages i obligationslængde. Enkeltbindinger er den længste af de tre typer kovalente bindinger, da interatomisk tiltrækning er større i de to andre typer, dobbelt og tredobbelt. Stigningen i komponentbindinger er årsagen til denne tiltrækningsforøgelse, da flere elektroner deles mellem de bundne atomer (Moore, Stanitski og Jurs 343).
enkeltbindinger ses ofte i diatomiske molekyler. Eksempler på denne anvendelse af enkeltbindinger inkluderer H2, F2og HCl.
enkeltbindinger ses også i molekyler, der består af mere end to atomer. Eksempler på denne anvendelse af enkeltbindinger inkluderer:
- begge bindinger i H2O
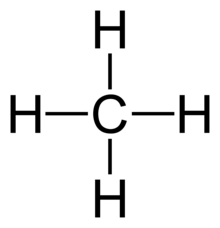
- Alle 4 bindinger i CH4
enkeltbinding forekommer endda i molekyler så komplekse som carbonhydrider større end methan. Typen af kovalent binding i carbonhydrider er ekstremt vigtig i nomenklaturen for disse molekyler. Carbonhydrider, der kun indeholder enkeltbindinger, betegnes som alkaner (Moore, Stanitski og Jurs 334). Navnene på specifikke molekyler, der hører til denne gruppe, slutter med suffikset-ane. Eksempler inkluderer Ethan, 2-methylbutanog cyclopentan (Moore, Stanitskiog Jurs 335).