Levis-diagrammet for mange et molekyle er imidlertid ikke i overensstemmelse med molekylets observerede egenskaber.
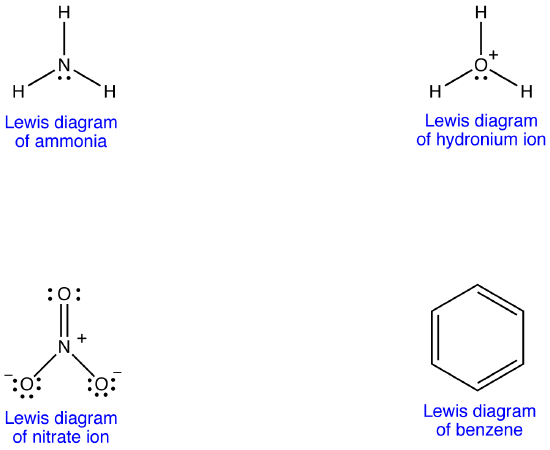
eksempel 1: Nitration
nitrationsdiagrammet har to typer nitrogen-iltbindinger, en dobbeltbinding og to enkeltbindinger, hvilket antyder, at en nitrogen-iltbinding i nitrationsdiagrammet er kortere og stærkere end hver af de to andre. Desuden indebærer strukturen, med hensyn til formel ladning, at der er to typer iltatomer i nitrationen, en formelt neutral og hver af de to andre bærer en formel ladning på -1. Eksperimentelt har de tre nitrogen-iltbindinger i nitritet imidlertid den samme bindingslængde og den samme bindingsenergi, og de tre iltatomer kan ikke skelnes. Det er ikke muligt at forklare strukturen og bindingen af nitritet på tilfredsstillende måde.
der kan tegnes to yderligere diagrammer for nitrationen.
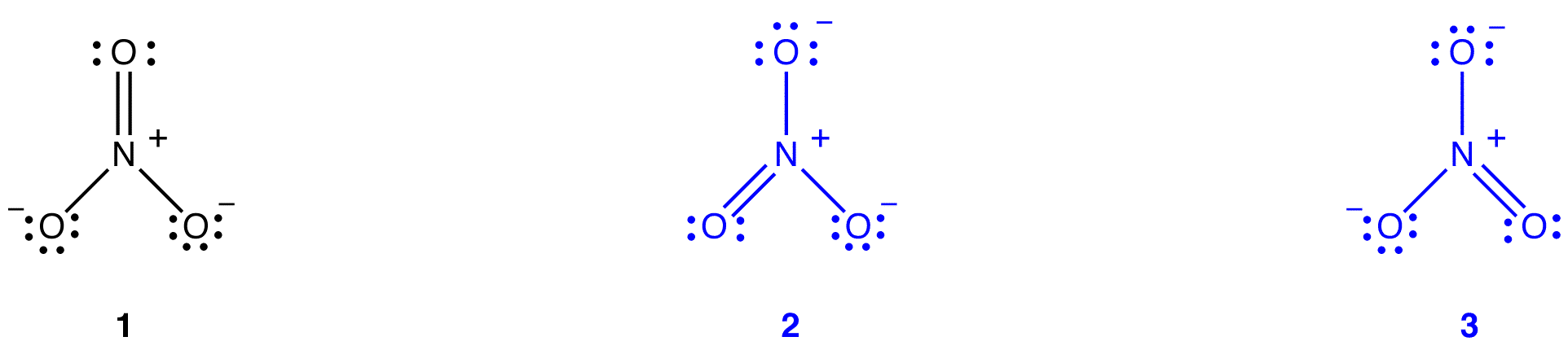
ingen af dem er imidlertid i overensstemmelse med nitrationets observerede egenskaber og viser derfor ikke korrekt nitration.
eksempel 2: Der er to typer carbon-carbon-bindinger, tre dobbeltbindinger og tre enkeltbindinger, hvilket tyder på, at hver af tre carbon-carbon-bindinger i bensene er kortere og stærkere end hver af de andre tre. De seks carbon-carbon-bindinger har samme bindingslængde og samme bindingsenergi. Det er ikke muligt at finde ud af, om der er nogen grund til at tro, at der ikke er nogen grund til at tro, at der ikke er nogen grund til det.
en egenskab af molekyler, hvoraf det klassiske Luvisdiagram ikke er i overensstemmelse med de observerede egenskaber, er, at andre gyldige Luvisdiagrammer kan genereres for dem. Der kan tegnes et yderligere diagram for bensene.

ingen af dem er imidlertid i overensstemmelse med de observerede egenskaber af bensene og viser derfor ikke bensene korrekt.Resonansteori er et forsøg på at forklare strukturen af en art, som f.eks. Den største fordel ved resonansteori er, at selvom det er baseret på streng matematisk analyse, kan resonansteori anvendes med succes med at påberåbe sig lidt eller ingen matematik. Resonansteori forklares nedenfor ved hjælp af nitration som eksempel.
i henhold til resonansteori er strukturen af nitrationen ikke 1 eller 2 eller 3, men gennemsnittet af alle tre af dem, vægtet af stabilitet. Diagrammer 1, 2 og 3 kaldes resonansformer, resonansstrukturer eller resonansbidragere af nitritet. Strukturen af nitration siges at være en resonanshybrid eller simpelthen hybrid af resonansformer 1, 2 og 3. Når det er nødvendigt at vise nitratets struktur, tegnes resonansformer 1, 2 og 3, forbundet med en dobbelthovedpile.
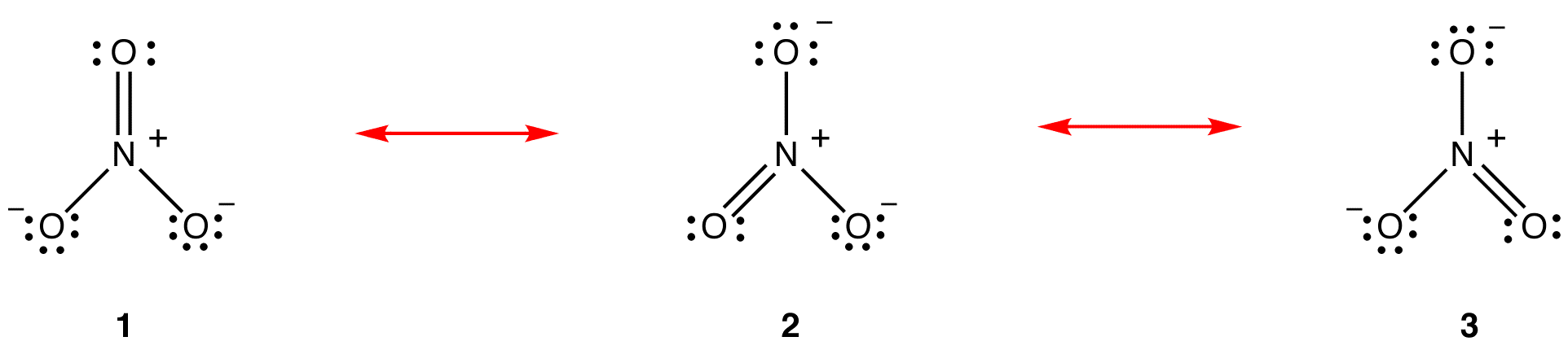
de tre resonansformer af nitrationen, 1, 2 og 3, er identiske, så de har den samme stabilitet og bidrager derfor ligeligt til hybriden. Da det nøjagtige omfang, i hvilket hver resonansform af nitrationen bidrager til hybriden, er kendt, kan bindingsrækkefølgen for hver nitrogen-iltbinding såvel som den formelle ladning på hvert iltatom i hybriden let bestemmes:
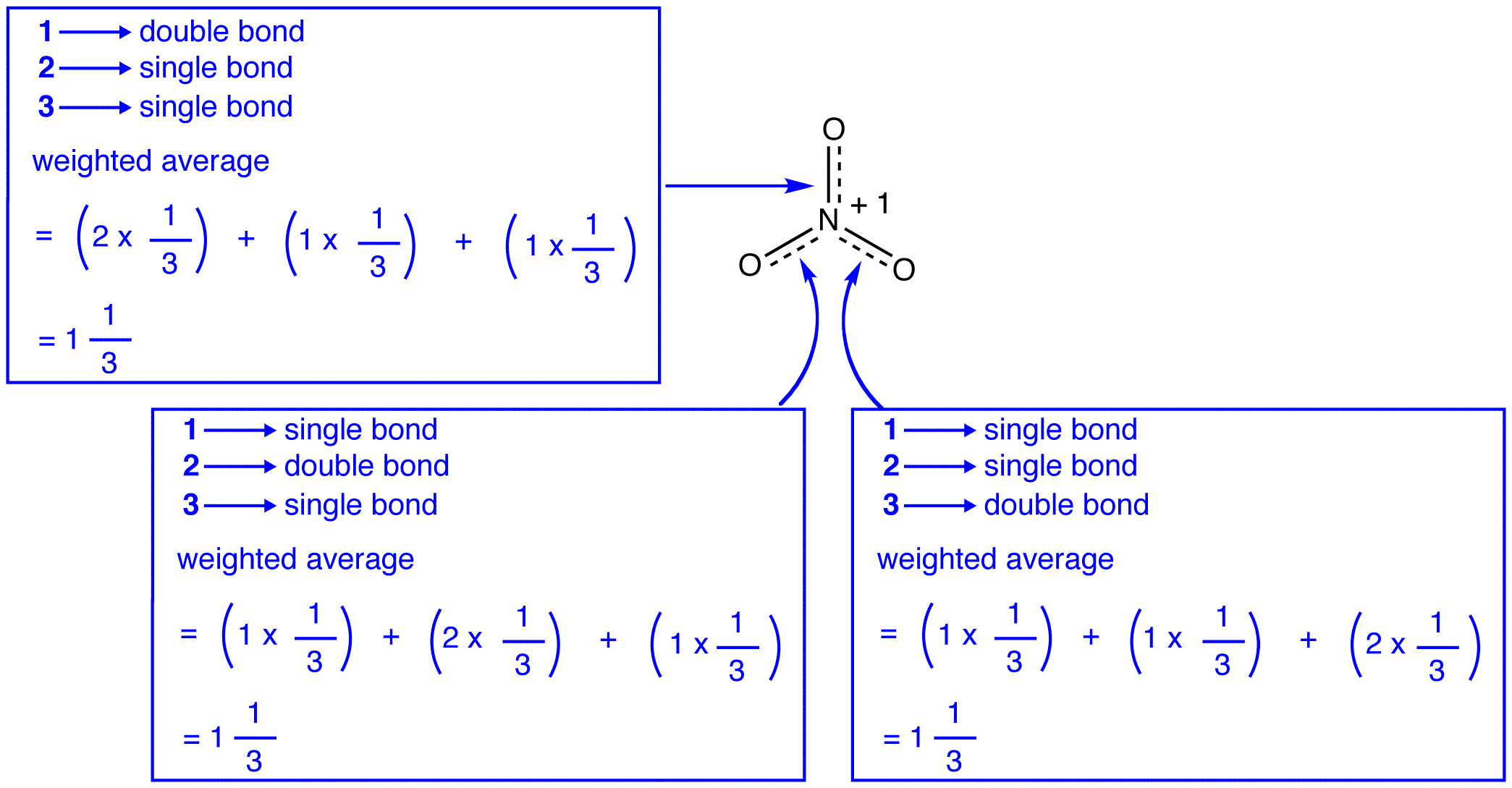
ifølge resonansteori er hver binding i nitritet en og en tredjedel af en binding, hvilket er i overensstemmelse med observationen om, at de tre bindinger i nitritet har den samme bindingslængde og den samme bindingsenergi.
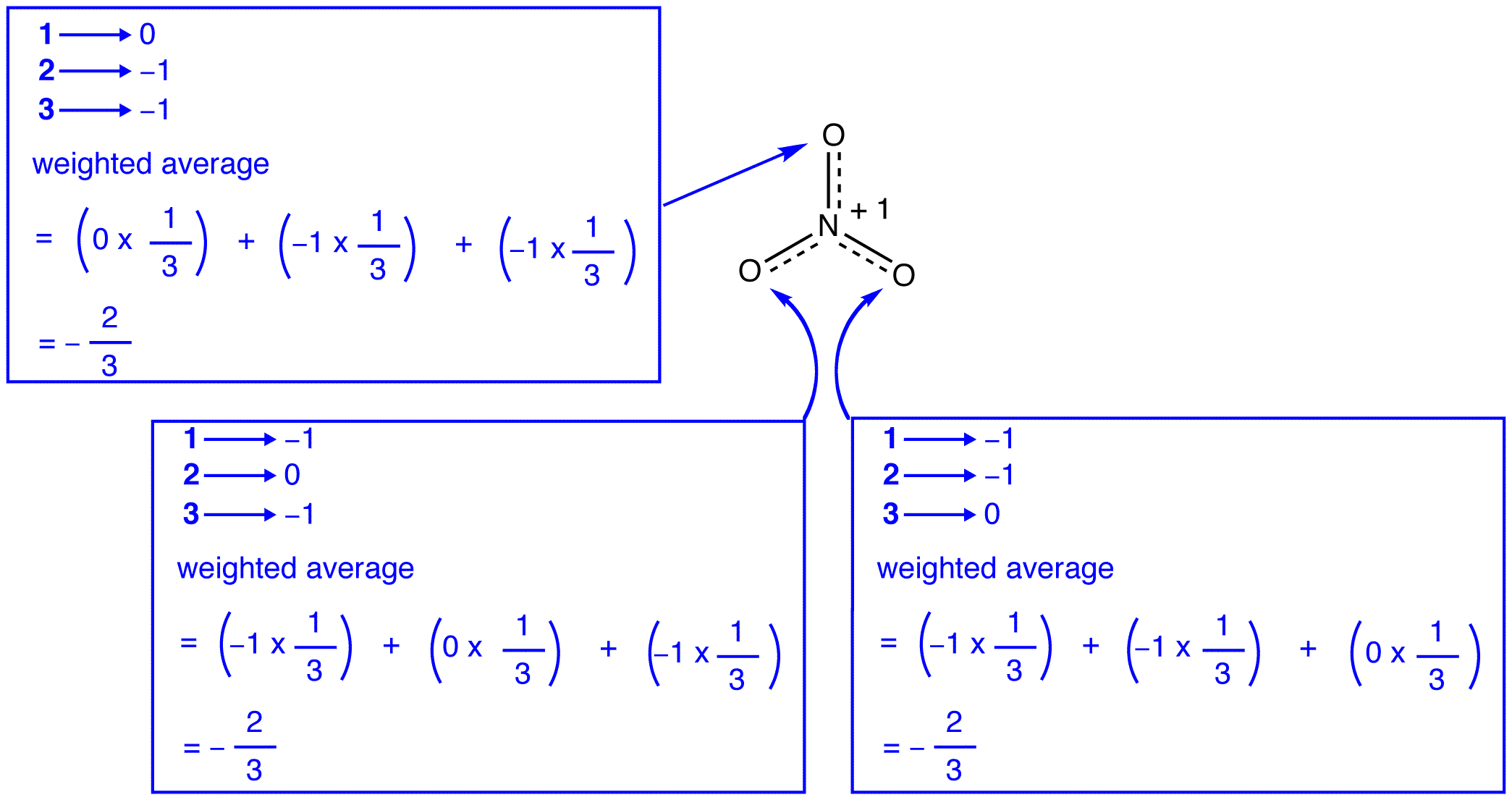
ifølge resonansteori har hvert iltatom i nitritet en formel ladning på -2/3, hvilket i forbindelse med det faktum, at de tre nitrogen-iltbindinger er identiske, er i overensstemmelse med observationen om, at de tre iltatomer i nitritet ikke kan skelnes.
i hver resonansform af nitrationen er der to pi-elektroner, og de deles kun af to atomer. En elektron, der kun deles af to atomer, siges at være lokaliseret. Således lokaliseres de to pi-elektroner i hver resonansform af nitrationen. Nitrationen, som repræsenteret af hybriden, har to pi-elektroner:
# elektroner i en pi-binding = 2
# elektroner i en tredjedel af en pi-binding = 2/3
# elektroner i tre af dem = 3 2/3 = 2
de to pi-elektroner i nitrationen deles af i alt fire atomer, et nitrogenatom og tre iltatomer. En elektron, der deles af mere end to atomer, siges at være delokaliseret. Således delokaliseres de to pi-elektroner i nitrationen. Delokalisering af pi-elektroner i nitrationen kræver, at de fire atomer er på samme plan, hvilket tillader lateral overlapning af p-orbitalerne på dem.

Hvis nitritionenergien var det vægtede gennemsnit af energierne i dens tre resonansformer, ligesom nitritionstrukturen er det vægtede gennemsnit af strukturerne i dens tre resonansformer, skal den være lig med energien i en af de tre identiske resonansformer, og den skal være lig med energien i en af de tre identiske resonansformer:

Hvis hybridens energi var lig med en resonansform, da alle kemiske enheder (elementære partikler, atomer, molekyler osv.) naturligvis har tendens til at være i den lavest mulige energitilstand, ville der ikke være nogen fordel for nitrationen at eksistere som hybrid; det kunne simpelthen eksistere som en resonansform. Da nitrationen eksisterer som hybrid, ikke som en resonansform, kan det udledes, at hybridens energi er lavere end for nogen af resonansformerne.

ifølge resonansteori er energien af et molekyle lavere end den for den laveste energiresonansform. Da nitrationen har lavere energi og derfor er mere stabil end nogen af dens resonansformer, siges nitritet at være resonanstabiliseret.
der er to misforståelser om resonansteori blandt begyndende studerende, sandsynligvis på grund af bogstavelig fortolkning af ordet resonans. De er beskrevet nedenfor ved hjælp af nitration som eksempel.
misforståelse 1: Nitrationen eksisterer som resonansform 1 et øjeblik og ændres derefter enten til resonansform 2 eller til resonansform 3, som interkonverterer eller vender tilbage til 1.

strukturen af nitrationen er ikke 1 eller 2 eller 3, men hybriden og ændres ikke med tiden, medmindre den gennemgår en reaktion.
misforståelse 2: i en prøve af nitritioner findes på et givet tidspunkt en tredjedel af ionerne som resonansform 1, en anden tredjedel som resonansform 2 og den resterende tredjedel som resonansform 3.

i en prøve af nitrationer har alle ioner på et givet tidspunkt den samme struktur, som er hybrid.
den klassiske analogi, der bruges til at afklare disse to misforståelser, er muldyr (Morrison, R. T.; Boyd, R. N. organisk kemi, femte udgave; Allyn og Bacon: Boston, 1987, pg. 373). Biologisk er et muldyr en hybrid af en hest og et æsel. Dette betyder ikke, at et muldyr ligner en hest et øjeblik og derefter skifter til at ligne et æsel. Udseendet af en muldyr er en kombination af en hest og et æsel og ændrer sig ikke med tiden. Det betyder heller ikke, at nogle muldyr i en besætning ligner en hest og de andre et æsel. I en besætning har alle muldyr det samme udseende, som er en kombination af en hest og et æsel. Svagheden ved denne analogi er, at heste og Æsler eksisterer, mens resonansformer er strengt hypotetiske. En bedre analogi, citeret i Morrison og Boyd, er næsehornet. Efter at have set et næsehorn kunne man beskrive det som hybrid af en drage og en enhjørning, to skabninger, der ikke findes.
regler for tegning af Resonansformer
1. Resonansformer er uvis diagrammer, som er baseret på valensbindingsteori.De skal derfor overholde de grundlæggende regler for valensbindingsteori. Hydrogen kan således ikke have mere end to valenselektroner; periode-to elementer kan ikke have mere end otte valenselektroner; elementer i periode tre og derunder kan have mere end otte valenselektroner. F. eks: i hver resonansform af nitrationen er der to elementer, nitrogen og ilt, som er Periode-to elementer. I ingen af resonansformerne af nitrationen er der mere end otte valenselektroner på nogen af atomerne.
2. Alle resonansformer skal have den samme Sigma-bindingsramme, der kun adskiller sig i placeringen af pi-elektroner og ikke-bindede valenselektroner. eg: alle tre resonansformer af nitrationen har den samme Sigma-bindingsramme:
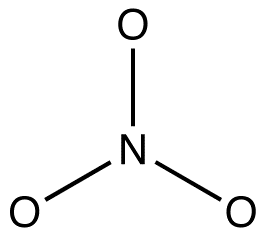
de adskiller sig kun fra hinanden på placeringen af pi-elektroner og ensomme par.
organiske kemikere overtræder i stigende grad denne regel for at forklare strukturerne af reaktive mellemprodukter som resonanstabiliserede arter. eg: oksymercuration
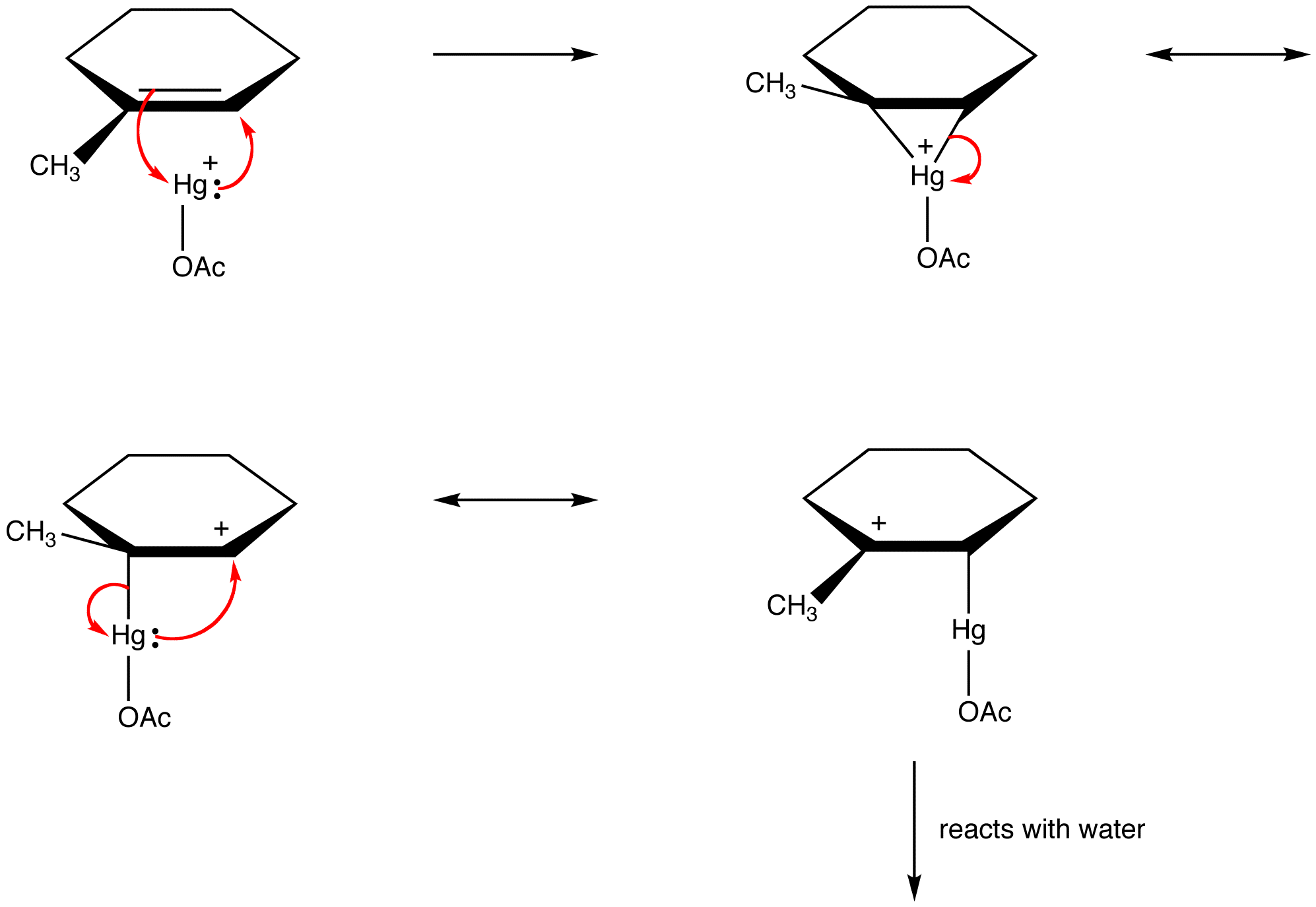
bestemmelse af relativ bidrag af Resonansformer til Hybrid
de tre former for nitration er identiske og har derfor den samme stabilitet. Derfor bidrager de ligeligt til hybrid. Resonansformerne for de fleste resonanstabiliserede molekyler er forskellige fra hinanden, så de bidrager ikke lige til hybriden. Jo mere stabil resonansformen er, desto mere bidrager den til hybriden. Bestemmelsen af relative bidrag eller resonansformer til hybriden kræver således bestemmelse af deres relative stabilitet. Brug følgende regler til at bestemme den relative stabilitet af resonansformer.
regel 1:
en resonansform, hvor alle atomer har en oktet af valenselektroner, er mere stabil end en, hvor mindst et atom ikke gør det. fx:
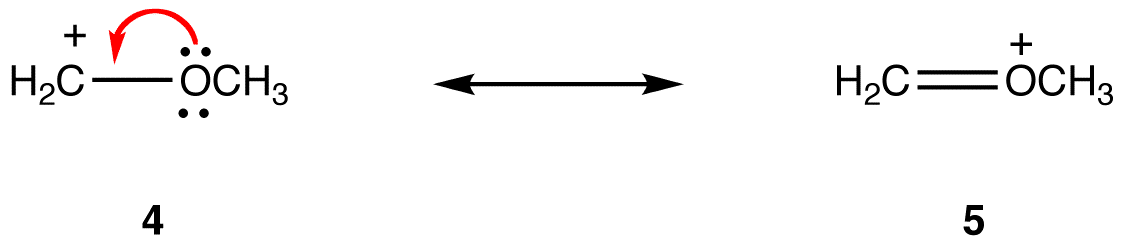
i resonansform 5 har alle atomer en oktet af valenselektroner; i 4 har et atom, carbonatomet, der bærer den formelle ladning på +1, ikke. Således er resonansform 5 mere stabil end resonansform 4.
regel 2:
alt andet lige er en resonansform, der har en formel negativ ladning på et mere elektronegativt atom, mere stabil end en, der har en formel negativ ladning på et mindre elektronegativt atom. fx:
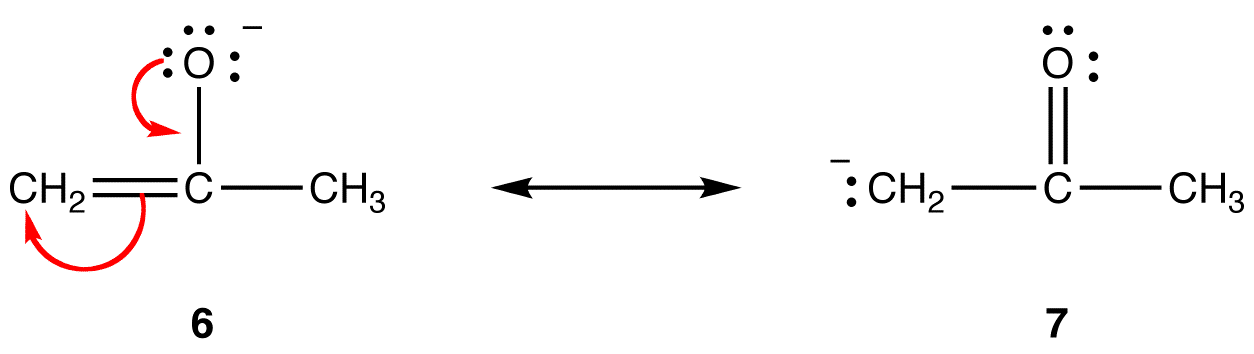
i resonansform 6 er den formelle negative ladning på et iltatom; i 7 er det på et carbonatom. Ilt er mere elektronegativt end kulstof. Således er resonansform 6 mere stabil end resonansform 7.
tendensen er modsat med hensyn til formelle positive ladninger. Alt andet lige er en resonansform, der har en formel positiv ladning på et mindre elektronegativt atom, mere stabil end en, der har en formel positiv ladning på et mere elektronegativt atom. fx:
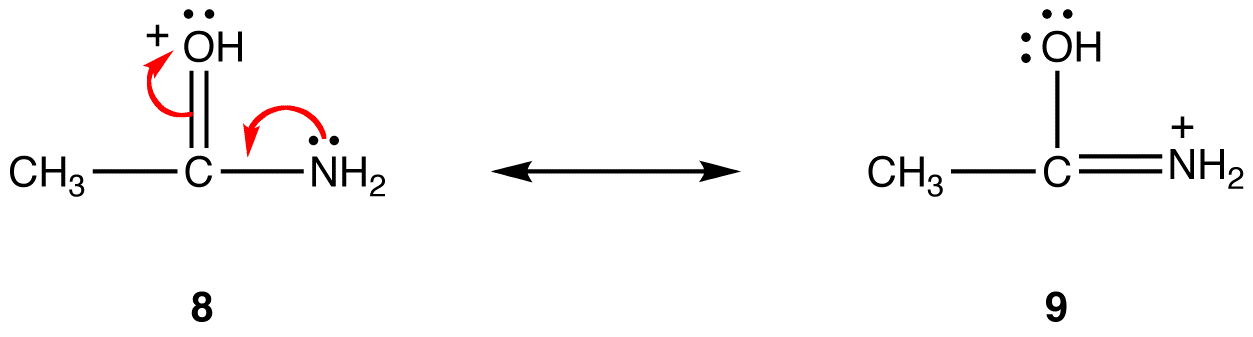
i resonansform 8 er den formelle positive ladning på et iltatom; i 9 er det på et nitrogenatom. Nitrogen er mindre elektronegativt end ilt, således er resonansform 9 mere stabil end resonansform 8.
regel 3:
alt andet lige er en resonansform, der ikke har en ladningsseparation, kaldet en dipolær resonansform, mere stabil end en der gør. eg:
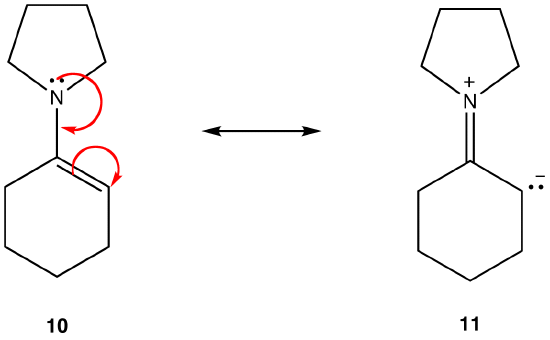
resonansform 11 er en dipolær resonansform; 10 er ikke. Således er 10 mere stabil end 11. Denne regel er en konsekvens af Vektorformen af Coloumbs lov, ifølge hvilken modsatte ladninger tiltrækker. Konsekvensen er, at for at holde modsatte ladninger adskilt kræves energi, hvilket betyder, at 11 har højere energi end 10, så 10 er mere stabil end 11.
Regel 4:
i dipolære resonansformer, alt andet lige, jo større afstanden mellem adskilte ladninger er, desto mere stabil er resonansformen. eg:
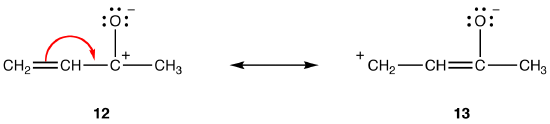
begge resonansformer 12 og 13 er dipolære resonansformer. Afstanden mellem de adskilte ladninger er større i 13 (tre obligationer) end i 12 (En binding), så 13 er mere stabil end 12. Denne regel er en konsekvens af den skalære form for Coloumbs lov, der siger, at den attraktive kraft mellem modsatte ladninger er omvendt proportional med kvadratet af afstanden mellem dem. Således er den energi, der kræves for at holde de modsatte ladninger adskilt i 12, højere end den i 13, hvilket betyder, at 12 har højere energi end 13, så 13 er mere stabil end 12.
ovenstående regler gælder muligvis ikke for resonans, der involverer elementer i periode tre og derunder på grund af deres evne til at rumme mere end otte elektroner i valensskallen. eg:
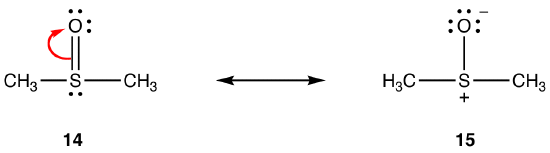
dobbeltbindingen i 14 består af en sigma-binding og en binding dannet ved overlapning af en 2P-orbital, der bærer to elektroner, i iltatomet og en tom 3D-orbital i svovlatomet. Disse to orbitaler har meget forskellige energier, størrelser og former, så overlapningen mellem dem, kendt som en pn–dn-interaktion, er svag. Følgelig er der ringe dobbeltbindingskarakter i svovl-iltbindingen i hybriden, dvs.15 er hovedresonansformen.
bidragydere og tilskrivninger
- Gamini Gunvadena fra Ochempal-stedet (Utah Valley University)