generisk navn: fluocinonid
doseringsform: salve
medicinsk gennemgået af Drugs.com. sidst opdateret den 22. december 2020.
- oversigt
- bivirkninger
- dosering
- professionel
- interaktioner
- mere
Lideks beskrivelse
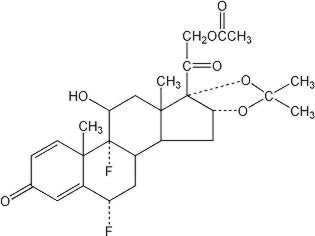
Lideks-salve 0,05% er beregnet til topisk administration. Den aktive komponent er kortikosteroidfluocinonidet, som er 21-acetatesteren af fluocinolonacetonid og har det kemiske navn pregna-1,4-dien-3,20-dion,21-(acetyloksi)-6,9-difluoro-11-hydroksi-16,17 -, (6-L,11 L,16 L) -. Det har følgende kemiske struktur:
Lideks salve indeholder fluocinonid 0.5 mg / g i en specielt formuleret salvebase bestående af glycerylmonostearat, hvidt petrolatum, propylencarbonat, propylenglycol og hvid voks. Det giver de okklusive og blødgørende virkninger, der er ønskelige i en salve.
i denne formulering er den aktive ingrediens helt i opløsning.
Lideks – Klinisk Farmakologi
topikale kortikosteroider deler antiinflammatoriske, anti-pruritiske og vasokonstriktive virkninger.
mekanismen for antiinflammatorisk aktivitet af de topiske kortikosteroider er uklar. Forskellige laboratoriemetoder, herunder vasokonstriktorassays, bruges til at sammenligne og forudsige potenser og/eller kliniske virkninger af de topiske kortikosteroider. Der er nogle beviser, der tyder på, at der findes en genkendelig sammenhæng mellem vasokonstriktorstyrke og terapeutisk virkning hos mennesker.
farmakokinetik
omfanget af perkutan absorption af topiske kortikosteroider bestemmes af mange faktorer, herunder køretøjet, integriteten af den epidermale barriere og brugen af okklusive forbindinger.
topikale kortikosteroider kan absorberes fra normal intakt hud. Betændelse og / eller andre sygdomsprocesser i huden øger perkutan absorption. Okklusive forbindinger øger signifikant den perkutane absorption af topiske kortikosteroider. Okklusive forbindinger kan således være et værdifuldt terapeutisk supplement til behandling af resistente dermatoser (se dosering og ADMINISTRATION).
når de er absorberet gennem huden, håndteres topikale kortikosteroider gennem farmakokinetiske veje svarende til systemisk administrerede kortikosteroider. Kortikosteroider er bundet til plasmaproteiner i varierende grad. Kortikosteroider metaboliseres primært i leveren og udskilles derefter af nyrerne. Nogle af de topiske kortikosteroider og deres metabolitter udskilles også i galden.
indikationer og anvendelse af Lideks
Lideks salve er indiceret til lindring af inflammatoriske og pruritiske manifestationer af kortikosteroid-responsive dermatoser.
kontraindikationer
topiske kortikosteroider er kontraindiceret hos de patienter med en historie med overfølsomhed over for nogen af præparatets komponenter.
forholdsregler
generelt
systemisk absorption af topiske kortikosteroider har produceret reversibel hypothalamus-hypofyse-binyre (HPA) – aksesuppression, manifestationer af Cushings syndrom, hyperglykæmi og glukosuri hos nogle patienter.
betingelser, der øger systemisk absorption, inkluderer anvendelse af de mere potente steroider, anvendelse over store overfladearealer, langvarig brug og tilsætning af okklusive forbindinger.
derfor bør patienter, der får en stor dosis af et potent topisk steroid påført et stort overfladeareal eller under en okklusiv bandage, evalueres periodisk for tegn på hPa-akseundertrykkelse ved hjælp af urinfri cortisol-og ACTH-stimuleringstest. Hvis hPa-akseundertrykkelse bemærkes, skal der forsøges at trække lægemidlet tilbage, reducere hyppigheden af påføring eller erstatte et mindre potent steroid.
genopretning af HPA-aksefunktionen er generelt hurtig og fuldstændig ved seponering af lægemidlet. Sjældent kan tegn og symptomer på steroidudtagning forekomme, hvilket kræver supplerende systemiske kortikosteroider.
børn kan absorbere forholdsmæssigt større mængder topiske kortikosteroider og dermed være mere modtagelige for systemisk toksicitet (se forholdsregler – pædiatrisk brug). Hvis der opstår irritation, skal topikale kortikosteroider seponeres, og passende behandling påbegyndes.
som med ethvert topisk kortikosteroidprodukt kan langvarig brug fremkalde atrofi i huden og subkutant væv. Når det bruges på intertriginøse eller bøjningsområder eller på ansigtet, kan dette forekomme selv ved kortvarig brug.
i nærvær af dermatologiske infektioner bør anvendelsen af et passende antifungalt eller antibakterielt middel indledes. Hvis et gunstigt respons ikke forekommer straks, skal kortikosteroid seponeres, indtil infektionen er blevet kontrolleret tilstrækkeligt.
Information til patienten
patienter, der bruger topiske kortikosteroider, skal modtage følgende oplysninger og instruktioner:
- denne medicin skal bruges som anvist af lægen. Det er kun til ekstern brug. Undgå kontakt med øjnene.
- patienter bør rådes til ikke at bruge denne medicin til andre lidelser end den, som den blev ordineret til.
- det behandlede hudområde bør ikke bandages eller på anden måde dækkes eller indpakkes for at være okklusivt, medmindre lægen har instrueret det.
- patienter skal rapportere tegn på lokale bivirkninger, især under okklusiv dressing.
- forældre til pædiatriske patienter bør rådes til ikke at bruge tætsiddende bleer eller plastbukser på et barn, der behandles i bleområdet, da disse beklædningsgenstande kan udgøre okklusive forbindinger.
laboratorieundersøgelser
følgende tests kan være nyttige til evaluering af HPA-akseundertrykkelsen:
urinfri cortisoltest
ACTH-stimuleringstest
carcinogenese, mutagenese og nedsat fertilitet
Langtids dyreforsøg er ikke udført for at evaluere det karcinogene potentiale eller effekten på fertiliteten af topikale kortikosteroider.
undersøgelser til bestemmelse af mutagenicitet med prednisolon og hydrocortison har afsløret negative resultater.
graviditetskategori C
kortikosteroider er generelt teratogene hos forsøgsdyr, når de administreres systemisk ved relativt lave doseringsniveauer. De mere potente kortikosteroider har vist sig at være teratogene efter dermal påføring på forsøgsdyr. Der er ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder af teratogene virkninger fra topisk anvendte kortikosteroider. Derfor bør topiske kortikosteroider kun anvendes under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret. Lægemidler i denne klasse bør ikke anvendes i vid udstrækning på gravide patienter, i store mængder eller i længere perioder.
ammende mødre
det vides ikke, om topisk administration af kortikosteroider kan resultere i tilstrækkelig systemisk absorption til at producere påviselige mængder i modermælk. Systemisk administrerede kortikosteroider udskilles i modermælk i mængder, der sandsynligvis ikke har en skadelig virkning på spædbarnet. Ikke desto mindre skal der udvises forsigtighed, når topiske kortikosteroider administreres til en ammende kvinde.
pædiatrisk brug
pædiatriske patienter kan vise større modtagelighed for topisk kortikosteroidinduceret hypotalmisk-hypofyse-binyre (HPA) akseundertrykkelse og Cushings syndrom end modne patienter på grund af et større hudoverfladeareal til kropsvægtforhold.
hPa-aksesuppression, Cushings syndrom og intrakraniel hypertension er rapporteret hos børn, der får topikale kortikosteroider. Manifestationer af binyrebarksuppression hos børn inkluderer lineær væksthæmning, forsinket vægtøgning, lave plasmakortisolniveauer og fravær af respons på ACTH-stimulering. Manifestationer af intrakraniel hypertension inkluderer svulmende fontaneller, hovedpine og bilateralt papilledem.
Administration af topikale kortikosteroider til børn bør begrænses til den mindste mængde, der er kompatibel med et effektivt terapeutisk regime. Kronisk kortikosteroidbehandling kan forstyrre væksten og udviklingen af børn.
bivirkninger
følgende lokale bivirkninger rapporteres sjældent med topikale kortikosteroider, men kan forekomme hyppigere ved brug af okklusive forbindinger. Disse reaktioner er anført i en omtrentlig faldende rækkefølge af forekomsten:
| Burning | Perioral dermatitis |
| Itching | Allergic contact dermatitis |
| Irritation | Maceration of the skin |
| Dryness | Secondary infection |
| Folliculitis | Skin atrophy |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Overdosage
Topically applied corticosteroids can be absorbed in sufficient amounts to produce systemic effects (see PRECAUTIONS).
Lideks Dosering og Administration
Lideks salve påføres generelt på det berørte område som en tynd film fra to til fire gange dagligt afhængigt af sværhedsgraden af tilstanden.
okklusive forbindinger kan anvendes til behandling af psoriasis eller recalcitrant betingelser.
Hvis en infektion udvikler sig, skal brugen af okklusive forbindinger seponeres, og passende antimikrobiel behandling indledes.
hvordan leveres Lideksa
Lideksa (fluocinonid) salve 0.05% leveres i
15 g rør –NDC 99207-514-13
30 g rør –NDC 99207-514-14
60 g rør –NDC 99207-514-17
120 g rør –NDC 99207-514-22
opbevares ved stuetemperatur. Undgå temperatur over 30 liter C (86 liter F).4.017.615
fremstillet til:
Medicis, Dermatologiselskabet kart
Scottsdale, DET 85258
af: Patheon, Inc.
Mississauga, Ontario
Canada L5N 7K9
IN-5070/S
| Lidex fluocinonide ointment |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – MEDICIS
Frequently asked questions
- Is it used for hair loss?
- What is a substitute for fluocinonide cream?
- Is fluocinonide an antifungal cream?
- How long should you use fluocinonide for?
- What is fluocinonide cream good for?
- kan fluocinonid anvendes til behandling af en poison ivy udslæt?
- er det et steroid?
- er dette et antibiotikum?
- bivirkninger
- under graviditet eller amning
- doseringsoplysninger
- lægemiddelinteraktioner
- 8 anmeldelser
- generisk tilgængelighed
- lægemiddelklasse: topiske steroider
Forbrugerressourcer
- avanceret læsning
- avanceret læsning (avanceret læsning)
- regelmæssig (avanceret læsning)
professionelle ressourcer
- ordinerende Information
- ul> andre mærker Vanos, lideks-e
relaterede behandlingsvejledninger
- atopisk dermatitis
- eksem
- dermatitis
- psoriasis
relaterede behandlingsvejledninger
- atopisk dermatitis
- eksem
- dermatitis
- psoriasis
medicinsk ansvarsfraskrivelse