egenskaber af kovalente forbindelser
når vi talte om faste ioniske forbindelser i ioniske forbindelser, fandt vi, at deres egenskaber ofte stammer fra den stærke tiltrækning af modsatte elektriske ladninger. Det bør ikke komme som en overraskelse at finde ud af, at egenskaberne ved kovalente forbindelser i vid udstrækning skyldes arten af kovalente bindinger.en af de vigtigste ting at huske om kovalente forbindelser er, at de ikke er ioniske. Dette virker indlysende, men forskellen er faktisk subtilere, end du måske forestiller dig. For at illustrere dette koncept skal du se på følgende figur:
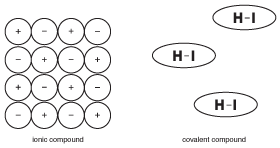
figur 9.5 egenskaberne af faste ioniske forbindelser er baseret på det faktum, at mange ioner holdes stift på plads med elektriske kræfter. Molekyler i kovalente forbindelser fungerer imidlertid med relativ uafhængighed fra nabomolekyler.i modsætning til ionforbindelser, hvor alle ioner i en stor krystal hjælper med at holde hinanden sammen, holdes molekylerne i en kovalent forbindelse sammen af kræfter kaldet “intermolekylære kræfter”, som er meget svagere end kemiske bindinger (mere om intermolekylære kræfter i faste stoffer). Som et resultat tiltrækkes molekylerne i en kovalent forbindelse ikke så meget til hinanden som ionerne i ioniske forbindelser. Denne forskel i struktur er vigtig for at forstå egenskaberne af kovalente forbindelser.
kovalente forbindelser har lave smelte-og kogepunkter
som nævnt i ioniske forbindelser kræves der en stor mængde energi for at smelte en ionforbindelse på grund af de stærke interaktioner mellem kationer og anioner i en ionkrystal. I kovalente forbindelser er alle molekyler imidlertid kun svagt bundet til nabomolekyler; derfor kræver det meget lidt energi at adskille kovalente molekyler fra hinanden.
mange begyndende kemistuderende tror fejlagtigt, at når et kovalent molekyle smelter, brydes kovalente bindinger. Dette er falsk. Når ioniske forbindelser smelter, fejler den ioniske tiltrækning. Når kovalente forbindelser smelter, trækker molekylerne simpelthen væk fra hinanden og efterlader bindingerne intakte.
kovalente forbindelser er dårlige ledere
ioniske forbindelser er store ledere af elektricitet, når de opløses eller smeltes. Som nævnt i ioniske forbindelser skyldes dette, at ioniske forbindelser har mobile ioner, der er i stand til at overføre elektrisk ladning fra et sted til et andet. De leder også varme meget godt, fordi ionerne er lige ved siden af hinanden, hvilket gør det muligt for energi at blive overført effektivt fra et sted til et andet.kovalente forbindelser er på den anden side næsten altid gode isolatorer af både elektricitet og varme. Elektricitet er ikke i stand til at lede effektivt gennem kovalente forbindelser, fordi der ikke er ioner til at bevæge den elektriske ladning. Et glimrende eksempel på dette er i dit eget hus, hvor metallet i dine forlængerledninger er dækket af plast for at undgå at elektrokutere din kat. Varme bevæger sig heller ikke godt gennem kovalente forbindelser, fordi molekylerne ikke holdes så tæt på hinanden som ionerne i en ionforbindelse, hvilket gør varmeoverførslen mindre effektiv. Derfor bruger du ovnhandsker til at tage dine cookies ud af ovnen i stedet for at belægge dine hænder med salt.
kovalente forbindelser brænder undertiden
organiske forbindelser er kovalente forbindelser, der indeholder kulstof. De indeholder normalt også hydrogen. og kan indeholde mindre mængder af andre elementer såsom nitrogen, svovl, fosfor, ilt eller nogen af halogener.
mange kovalente forbindelser er brandfarlige og brænder let med tilsætning af varme. Hovedgruppen af kovalente forbindelser, der er brandfarlige, kaldes organiske forbindelser. Organiske forbindelser brænder, fordi de indeholder kulstof og brint, som begge kombineres pænt med ilt ved høje temperaturer.det er vigtigt at huske på, at ikke alle kovalente forbindelser brænder?for eksempel er vand en kovalent forbindelse, og du har meget svært ved at starte en brand med det. Imidlertid er mange flere kovalente end ioniske forbindelser brandfarlige.brændbarhed er en generel egenskab ved kovalente forbindelser, fordi et stort flertal af de kendte kovalente forbindelser er organiske. Da de fleste organiske forbindelser brænder, kan vi sikkert Liste dette som en egenskab ved kovalente forbindelser, selvom der er mange kovalente forbindelser, der ikke brænder.uddrag fra The Complete Idiot ‘ s Guide to Chemistry 2003 af Ian Guch. Alle rettigheder forbeholdes, herunder retten til reproduktion helt eller delvist i enhver form. Anvendes efter aftale med Alpha Books, medlem af Penguin Group (USA) Inc.
for at bestille denne bog direkte fra udgiveren, besøg Penguin USA hjemmeside eller ring 1-800-253-6476. Du kan også købe denne bog på