tilsætning af hydrogen til en carbon-carbon dobbeltbinding kaldes hydrogenering. Den samlede virkning af en sådan tilsætning er den reduktive fjernelse af dobbeltbindingsfunktionsgruppen. Regioselektivitet er ikke et problem, da den samme gruppe (et hydrogenatom) er bundet til hver af dobbeltbindingskulstofferne. Den enkleste kilde til to hydrogenatomer er molekylært hydrogen (H2), men blanding af alkener med hydrogen resulterer ikke i nogen mærkbar reaktion. Selvom den samlede hydrogeneringsreaktion er eksoterm, forhindrer en høj aktiveringsenergi den i at finde sted under normale forhold. Denne begrænsning kan omgås ved anvendelse af en katalysator, som vist i det følgende diagram.
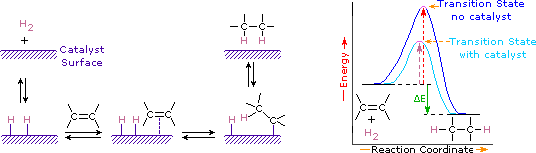
katalysatorer er stoffer, der ændrer hastigheden (hastigheden) af en kemisk reaktion uden at blive forbrugt eller vises som en del af produktet. Katalysatorer virker ved at sænke reaktionsaktiveringsenergien, men de ændrer ikke den relative potentielle energi af reaktanterne og produkterne. Fininddelte metaller, såsom platin, palladium og nikkel, er blandt de mest anvendte hydrogeneringskatalysatorer. Katalytisk hydrogenering finder sted i mindst to trin, som vist i diagrammet. For det første skal Alken adsorberes på overfladen af katalysatoren sammen med noget af hydrogenet. Derefter skifter to hydrogener fra metaloverfladen til carbonhydriderne i dobbeltbindingen, og det resulterende mættede carbonhydrid, som er mere svagt adsorberet, forlader katalysatoroverfladen. Den nøjagtige karakter og timing af de sidste begivenheder forstås ikke godt.
som vist i energidiagrammet er hydrogeneringen af alkener eksoterm, og der frigives varme svarende til den røde farve (farvet grøn) i diagrammet. Denne reaktionsvarme kan bruges til at evaluere den termodynamiske stabilitet af alkener med forskellige antal alkylsubstituenter på dobbeltbindingen. For eksempel viser den følgende tabel opvarmningen af hydrogenering for tre C5H10 alkener, der giver det samme Alkan-produkt (2-methylbutan). Da en stor reaktionsvarme indikerer en reaktant med høj energi, er disse heats omvendt proportional med stabiliteterne af Alken-isomerer. Til en grov tilnærmelse ser vi, at hver alkylsubstituent på en dobbeltbinding stabiliserer denne funktionelle gruppe med lidt mere end 1 kcal/mol.
| Alken Isomer | (CH3)2chch=CH2 3-methyl-1-buten |
CH2=C(CH3)ch2ch3 2-methyl-1-buten |
(CH3)2C=chch3 2-methyl-2-buten |
|---|---|---|---|
| reaktionsvarme ( larth ) |
-30,3 kcal/mol | -28,5 kcal/mol | -26,9 kcal/mol |
fra den mekanisme, der er vist her, ville vi forvente, at tilsætningen af hydrogen forekommer med syn-STEREOSELEKTIVITET. Dette er ofte sandt, men hydrogeneringskatalysatorerne kan også forårsage isomerisering af dobbeltbindingen inden hydrogentilsætning, i hvilket tilfælde stereoselektivitet kan være usikker.
dannelsen af overgangsmetalkomplekser med alkener er overbevisende demonstreret ved isolering af stabile platinkomplekser, såsom Seises salt, K. H2O og ethylenbis(triphenylphosphin)platin, 2pt(H2C=CH2). I sidstnævnte er platin tre-koordinat og nul-valent, mens salt er et derivat af platin (II). En model af Sises salt og en diskussion af den usædvanlige binding i sådanne komplekser kan ses ved at klikke her. Lignende komplekser er blevet rapporteret for nikkel og palladium, metaller, der også fungerer som katalysatorer til Alken hydrogenering.
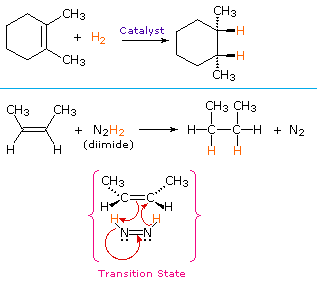
en ikke-katalytisk procedure til syn-tilsætning af hydrogen gør brug af den ustabile forbindelse diimid, N2H2. Dette reagens skal genereres frisk i reaktionssystemet, normalt ved iltning af hydrasin, og den stærkt eksoterme reaktion foretrækkes ved eliminering af nitrogengas (en meget stabil forbindelse). Diimid kan eksistere som cis-trans-isomerer; kun cis-isomeren tjener som et reduktionsmiddel. Eksempler på alkenreduktioner ved begge procedurer er vist nedenfor.
bidragydere
- Professor Emeritus (Michigan State U.), virtuel lærebog om organisk kemi