læringsmål
ved udgangen af dette afsnit vil du kunne:
- undersøge varmeoverførsel.
- Beregn sluttemperatur fra varmeoverførsel.
indtil videre har vi diskuteret temperaturændring på grund af varmeoverførsel. Der sker ingen temperaturændring fra varmeoverførsel, hvis isen smelter og bliver flydende vand (dvs.under en faseændring). Overvej for eksempel vand, der drypper fra istapper, der smelter på et tag opvarmet af solen. Omvendt fryser vand i en isbakke afkølet af omgivelser med lavere temperatur.

Figur 1. Varme fra luften overføres til isen, hvilket får den til at smelte. (kredit: Mike Brand)
energi kræves for at smelte et fast stof, fordi de sammenhængende bindinger mellem molekylerne i det faste stof skal brydes fra hinanden, således at molekylerne i væsken kan bevæge sig rundt ved sammenlignelige kinetiske energier; der er således ingen stigning i temperaturen. Tilsvarende er energi nødvendig for at fordampe en væske, fordi molekyler i en væske interagerer med hinanden via attraktive kræfter. Der er ingen temperaturændring, før en faseændring er afsluttet. Temperaturen på en kop soda oprindeligt ved 0 liter forbliver ved 0 liter, indtil al isen er smeltet. Omvendt frigives energi under frysning og kondens, normalt i form af termisk energi. Arbejdet udføres af sammenhængende kræfter, når molekyler bringes sammen. Den tilsvarende energi skal afgives (spredes) for at give dem mulighed for at forblive sammen figur 2.
energien involveret i en faseændring afhænger af to hovedfaktorer: antallet og styrken af bindinger eller kraftpar. Antallet af bindinger er proportional med antallet af molekyler og dermed til prøveens masse. Styrken af kræfter afhænger af typen af molekyler. Den varme K, der kræves for at ændre fasen af en prøve af masse m, er givet ved
K = MLF (smeltning/frysning,
K = MLV (fordampning/kondensation),
hvor den latente fusions -, Lf-og latente fordampningsvarme, Lv, er materialekonstanter, der er bestemt til at eksperimentelt. Se Tabel 1.

figur 2. (a) energi er nødvendig for delvist at overvinde de attraktive kræfter mellem molekyler i et fast stof for at danne en væske. Den samme energi skal fjernes for at frysning kan finde sted. (B) molekyler adskilles af store afstande, når de går fra væske til damp, hvilket kræver betydelig energi for at overvinde molekylær tiltrækning. Den samme energi skal fjernes for at kondens kan finde sted. Der er ingen temperaturændring, før en faseændring er afsluttet.
Latent varme måles i enheder på J / kg. Både Lf og Lv afhænger af stoffet, især på styrken af dets molekylære kræfter som tidligere nævnt. Lf og Lv kaldes samlet latente varmekoefficienter. De er latente eller skjulte, fordi energi i faseændringer kommer ind i eller forlader et system uden at forårsage en temperaturændring i systemet; så i virkeligheden er energien skjult. Tabel 1 viser repræsentative værdier for Lf og Lv sammen med smelte-og kogepunkter.
tabellen viser, at betydelige mængder energi er involveret i faseændringer. Lad os for eksempel se på, hvor meget energi der er behov for at smelte et kilo is ved 0 liter for at producere et kilo vand ved 0 liter C. Ved hjælp af ligningen for en temperaturændring og værdien for vand fra tabel 1 finder vi, at K = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ er energien til at smelte et kilo is. Dette er meget energi, da det repræsenterer den samme mængde energi, der er nødvendig for at hæve temperaturen på 1 kg flydende vand fra 0 liter til 79,8 liter. Endnu mere energi kræves for at fordampe vand; det ville tage 2256 kJ at skifte 1 kg flydende vand ved det normale kogepunkt (100 liter ved atmosfærisk tryk) til damp (vanddamp). Dette eksempel viser, at energien til en faseændring er enorm sammenlignet med energi forbundet med temperaturændringer uden en faseændring.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Tag for eksempel det faktum, at lufttemperaturer i fugtige klimaer sjældent går over 35,0 liter, hvilket skyldes, at de fleste varmeoverførsler går i fordampende vand i luften. Tilsvarende falder temperaturer i fugtigt vejr sjældent under dugpunktet, fordi der frigøres enorm varme, når vanddamp kondenserer.
Vi undersøger virkningerne af faseændring mere præcist ved at overveje at tilføje varme til en prøve af is ved −20 liter (figur 3). Isens temperatur stiger lineært og absorberer varme med en konstant hastighed på 0,50 cal/g-liter, indtil den når 0 liter. En gang ved denne temperatur begynder isen at smelte, indtil al isen er smeltet og absorberer 79,8 cal/g varme. Temperaturen forbliver konstant ved 0 liter under denne faseændring. Når al isen er smeltet, stiger temperaturen på det flydende vand og absorberer varme med en ny konstant hastighed på 1,00 cal/g liter. Ved 100 liter begynder vandet at koge, og temperaturen forbliver igen konstant, mens vandet absorberer 539 cal/g varme under denne faseændring. Når al væsken er blevet dampdamp, stiger temperaturen igen og absorberer varme med en hastighed på 0,482 cal/g kartsc.
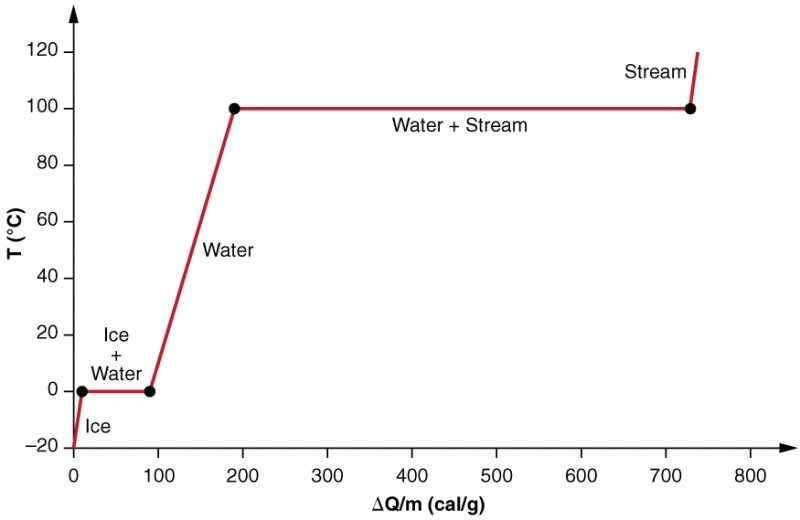
figur 3. En graf over temperatur versus energi tilføjet. Systemet er konstrueret således, at ingen damp fordamper, mens isen opvarmes til at blive flydende vand, og således at dampen forbliver i systemet, når fordampning sker. De lange strækninger med konstante temperaturværdier ved 0 liter og 100 liter afspejler henholdsvis den store latente varme ved smeltning og fordampning.
vand kan fordampe ved temperaturer under kogepunktet. Der kræves mere energi end ved kogepunktet, fordi den kinetiske energi af vandmolekyler ved temperaturer under 100 liter er mindre end den ved 100 liter, hvorfor der er mindre energi tilgængelig fra tilfældige termiske bevægelser. Tag for eksempel det faktum, at sved fra huden ved kropstemperatur kræver en varmeindgang på 2428 kJ/kg, hvilket er omkring 10 procent højere end den latente fordampningsvarme ved 100 liter. Denne varme kommer fra huden og giver således en effektiv kølemekanisme i varmt vejr. Høj luftfugtighed hæmmer fordampning, så kropstemperaturen kan stige, hvilket efterlader ujævn sved på din pande.
eksempel 1. Beregn sluttemperatur fra faseændring: Kølesoda med isterninger
tre isterninger bruges til at afkøle en sodavand ved 20 liter med masse msoda = 0,25 kg. Isen er på 0 kg, og hver isterning har en masse på 6,0 g. Antag, at sodavand opbevares i en skumbeholder, så varmetab kan ignoreres. Antag, at sodavand har samme varmekapacitet som vand. Find den endelige temperatur, når al is er smeltet.
strategi
isterningerne er ved smeltetemperaturen på 0 liter. Varme overføres fra sodavand til isen til smeltning. Smeltning af is sker i to trin: først sker faseændringen, og fast (is) omdannes til flydende vand ved smeltetemperaturen, så stiger temperaturen på dette vand. Smeltning giver vand ved 0 liter, så mere varme overføres fra sodavand til dette vand, indtil vand plus sodavand når termisk ligevægt.
den varme, der overføres til isen, er
Kice = mus Lf + micecv(Tf−0 liter).
den varme, der afgives af sodavand, er Ksoda = MSODACV(Tf−20 liter). Da der ikke går nogen varme tabt, så
mus Lf + micecv(Tf−0 liter) = –msodacv(Tf−20 liter).
Medbring alle udtryk, der involverer Tf på venstre side og alle andre udtryk på højre side. Løs for den ukendte mængde Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
opløsning
- Identificer de kendte mængder. Massen af is er mus = 3 liter 6,0 g = 0,018 kg og massen af sodavand er msoda = 0,25 kg.
- Beregn termerne i tælleren: m sodakv (20 liter)=(0,25 kg)(4186 J/kg liter) (20 liter) = 20.930 J og micelf = (0,018 kg) (334.000 J/kg) = 6012 J.
- Beregn nævneren: (msoda + mus) vægt = (0,25 kg + 0.018 kg) (4186 K/(kg liter) = 1122 J/liter.
- Beregn den endelige temperatur: \ displaystyle{t}_{\tekst{f}}=\frac{20,930 \ tekst{ J}-6012 \ tekst{ J}}{1122\tekst{ J/}^{\circ} \ Tekst{C}}=13^{\circ}\Tekst{C}\ \
Diskussion
dette eksempel illustrerer de enorme energier, der er involveret under en faseændring. Massen af is er omkring 7 procent massen af vand, men fører til en mærkbar ændring i temperaturen af sodavand. Selvom vi antog, at isen var ved frysetemperaturen, er dette forkert: den typiske temperatur er −6 liter. Denne korrektion giver imidlertid en endelig temperatur, der i det væsentlige er identisk med det resultat, vi fandt. Kan du forklare hvorfor?

figur 4. Kondens på et glas iste. vi har set, at fordampning kræver varmeoverførsel til en væske fra omgivelserne, så energi frigives af omgivelserne. Kondensation er den omvendte proces, der øger temperaturen i omgivelserne. Denne stigning kan virke overraskende, da vi forbinder kondens med kolde genstande—f.eks. Imidlertid skal energi fjernes fra kondenserende molekyler for at gøre en dampkondensation. Energien er nøjagtig den samme som den, der kræves for at gøre faseændringen i den anden retning, fra væske til damp, og så kan den beregnes ud fra K = mLv.
kondensation dannes i figur 4, fordi temperaturen i den nærliggende luft reduceres til under dugpunktet. Luften kan ikke holde så meget vand som det gjorde ved stuetemperatur, og så kondenserer vandet. Energi frigives, når vandet kondenserer, hvilket fremskynder isens smeltning i glasset.
anvendelse i den virkelige verden
energi frigives også, når en væske fryser. Dette fænomen bruges af frugtavlere i Florida til at beskytte appelsiner, når temperaturen er tæt på frysepunktet (0 liter). Dyrkere sprøjter vand på planterne i frugtplantager, så vandet fryser og varme frigives til de voksende appelsiner på træerne. Dette forhindrer temperaturen inde i appelsinen i at falde under frysepunktet, hvilket vil skade frugten.

figur 14.11. Isen på disse træer frigav store mængder energi, når den frøs, hvilket hjælper med at forhindre, at træernes temperatur falder til under 0 liter. Vand sprøjtes med vilje på frugtplantager for at forhindre hårde frost. (kredit: Hermann Hammer)
sublimering er overgangen fra fast til dampfase. Du har måske bemærket, at sne kan forsvinde i tynd luft uden spor af flydende vand eller forsvinden af isterninger i en fryser. Det modsatte er også sandt: Frost kan dannes på meget kolde vinduer uden at gå gennem væsketrinnet. En populær effekt er fremstillingen af” røg ” fra tøris, som er fast kulsyre. Sublimering opstår, fordi ligevægtsdamptrykket af faste stoffer ikke er nul. Visse luftfriskere bruger sublimering af et fast stof til at injicere en parfume i rummet. Mølkugler er et let giftigt eksempel på en phenol (en organisk forbindelse), der sublimerer, mens nogle faste stoffer, såsom osmium tetroksid, er så giftige, at de skal opbevares i lukkede beholdere for at forhindre menneskelig eksponering for deres sublimeringsproducerede dampe.

figur 5. Direkte overgange mellem fast og damp er almindelige, nogle gange nyttige og endda smukke. a) tøris sublimerer direkte til kulsyre. Den synlige damp er lavet af vanddråber. Frost danner mønstre på et meget koldt vindue, et eksempel på et fast stof dannet direkte fra en damp.
alle faseovergange involverer varme. I tilfælde af direkte faste dampovergange gives den krævede energi ved ligningen K = mLs, hvor Ls er sublimeringsvarmen, som er den energi, der kræves for at ændre 1.00 kg af et stof fra den faste fase til dampfasen. Ls er analog med Lf og Lv, og dens værdi afhænger af stoffet. Sublimering kræver energiindgang, så tøris er et effektivt kølemiddel, mens den omvendte proces (dvs.frosting) frigiver energi. Mængden af energi, der kræves til sublimering, er af samme størrelsesorden som for andre faseovergange.
materialet præsenteret i dette afsnit og det foregående afsnit giver os mulighed for at beregne et hvilket som helst antal effekter relateret til temperatur og faseændring. I hvert tilfælde er det nødvendigt at identificere, hvilke temperatur-og faseændringer der finder sted, og derefter anvende den passende ligning. Husk, at varmeoverførsel og arbejde kan forårsage både temperatur-og faseændringer.
problemløsningsstrategier for virkningerne af varmeoverførsel
- Undersøg situationen for at bestemme, at der er en ændring i temperaturen eller fasen. Er der varmeoverførsel til eller ud af systemet? Når tilstedeværelsen eller fraværet af en faseændring ikke er indlysende, kan du først løse problemet, som om der ikke var nogen faseændringer, og undersøge den opnåede temperaturændring. Hvis det er tilstrækkeligt at tage dig forbi et kogepunkt eller smeltepunkt, skal du derefter gå tilbage og gøre problemet i trin—temperaturændring, faseændring, efterfølgende temperaturændring osv.
- identificere og liste alle objekter, der ændrer temperatur og fase.
- Identificer nøjagtigt, hvad der skal bestemmes i problemet (Identificer de ukendte). En skriftlig liste er nyttig.
- lav en liste over, hvad der er givet, eller hvad der kan udledes af problemet som angivet (Identificer de kendte).
- Løs den passende ligning for den mængde, der skal bestemmes (det ukendte). Hvis der sker en temperaturændring, afhænger den overførte varme af den specifikke varme (se tabel 1 i temperaturændring og varmekapacitet), mens den overførte varme for en faseændring afhænger af den latente varme. Se Tabel 1.
- Udskift de kendte sammen med deres enheder i den relevante ligning og få numeriske løsninger komplet med enheder. Du bliver nødt til at gøre dette i trin, hvis der er mere end et trin i processen (såsom en temperaturændring efterfulgt af en faseændring).
- kontroller svaret for at se, om det er rimeligt: giver det mening? Som et eksempel skal du være sikker på, at temperaturændringen ikke også forårsager en faseændring, som du ikke har taget højde for.
Tjek din forståelse
hvorfor forbliver sne på bjergskråninger, selv når dagtemperaturerne er højere end frysetemperaturen?
opløsning
sne er dannet af iskrystaller og er således den faste fase af vand. Fordi enorm varme er nødvendig for faseændringer, tager det en vis tid, før denne varme akkumuleres fra luften, selvom luften er over 0 liter. Jo varmere luften er, jo hurtigere sker denne varmeveksling, og jo hurtigere smelter sneen.
Sektionsoversigt
- de fleste stoffer kan eksistere enten i faste, flydende og gasformer, der kaldes “faser.”
- faseændringer forekommer ved faste temperaturer for et givet stof ved et givet tryk, og disse temperaturer kaldes kognings-og frysepunkter (eller smeltepunkter).
- under faseændringer gives varme absorberet eller frigivet ved: K = mL, hvor L er den latente varmekoefficient.
konceptuelle spørgsmål
- varmeoverførsel kan forårsage temperatur-og faseændringer. Hvad andet kan forårsage disse ændringer?
- Hvordan hjælper den latente fusionsvarme af vand med at bremse faldet i lufttemperaturer, måske forhindre temperaturer i at falde markant under LUSC, i nærheden af store vandmasser?
- hvad er isens temperatur lige efter at den er dannet ved frysning af vand?
- hvad sker der, hvis du placerer is i vand i en isoleret beholder? Vil noget is smelte, vil mere vand fryse, eller vil hverken finde sted?
- hvilken effekt har kondens på et glas isvand på den hastighed, hvormed isen smelter? Vil kondensationen fremskynde smelteprocessen eller sænke den?
- i meget fugtige klimaer, hvor der er mange vandområder, som i Florida, er det usædvanligt, at temperaturerne stiger over omkring 35 liter (95 liter). I ørkener kan temperaturerne dog stige langt over dette. Forklar, hvordan fordampning af vand hjælper med at begrænse høje temperaturer i fugtige klimaer.
- om vinteren er det ofte varmere i San Francisco end i nærliggende Sacramento, 150 km inde i landet. Om sommeren er det næsten altid varmere i Sacramento. Forklar, hvordan vandmasserne omkring San Francisco modererer dets ekstreme temperaturer.
- hvis du lægger et låg på en kogende gryde, reduceres den varmeoverførsel, der er nødvendig for at holde den kogende. Forklar hvorfor.frysetørrede fødevarer er blevet dehydreret i et vakuum. Under processen fryser maden og skal opvarmes for at lette dehydrering. Forklar både, hvordan vakuumet fremskynder dehydrering, og hvorfor maden fryser som et resultat.
- når stadig luft afkøles ved at udstråle om natten, er det usædvanligt, at temperaturerne falder under dugpunktet. Forklar hvorfor.
- i en fysik klasseværelse demonstration, en instruktør puster en ballon gennem munden og derefter køler det i flydende nitrogen. Når den er kold, har den krympede ballon en lille mængde Lyseblå væske i den samt nogle snelignende krystaller. Når det opvarmes, koger væsken, og en del af krystallerne sublimerer, med nogle krystaller dvælende i et stykke tid og derefter producerer en væske. Identificer den blå væske og de to faste stoffer i den kolde ballon. Begrund dine identifikationer ved hjælp af data fra tabel 1.
problemer & øvelser
- hvor meget varmeoverførsel (i kilokalorier) kræves for at optø en 0, 450 kg Pakke med frosne grøntsager oprindeligt ved 0 liter, hvis deres fusionsvarme er den samme som for vand?
- en pose, der indeholder 0 liter is, er meget mere effektiv til at absorbere energi end en, der indeholder den samme mængde 0 liter vand. (A) hvor meget varmeoverførsel er nødvendig for at hæve temperaturen på 0,800 kg vand fra 0 liter til 30,0 liter? (b) hvor meget varmeoverførsel der kræves for først at smelte 0.800 kg 0 liter is og derefter hæve dens temperatur? (C) Forklar, hvordan dit svar understøtter påstanden om, at isen er mere effektiv.
- (a) hvor meget varmeoverførsel kræves for at hæve temperaturen på en 0,750 kg aluminiumspotte indeholdende 2,50 kg vand fra 30,0 liter til kogepunktet og derefter koge væk 0,750 kg vand? (b) Hvor lang tid tager dette, hvis varmeoverførselshastigheden er 500 V1 V = 1 joule/sekund (1 V = 1 J/s)?
- dannelsen af kondens på et glas isvand får isen til at smelte hurtigere, end den ellers ville. Hvis 8.00 g kondens dannes på et glas, der indeholder både vand og 200 g is, hvor mange gram af isen smelter som et resultat? Antag, at der ikke sker nogen anden varmeoverførsel.
- på en tur bemærker du, at en 3,50 kg pose is varer i gennemsnit en dag i din køler. Hvad er den gennemsnitlige effekt i vand, der kommer ind i isen, hvis den starter ved 0 liter og smelter fuldstændigt til 0 liter vand på nøjagtigt en dag 1 liter = 1 kg/sekund (1 liter = 1 Kg/s)?
- på en bestemt tør solskinsdag ville en svømmepøls temperatur stige med 1,50 liter, hvis ikke til fordampning. Hvilken brøkdel af vandet skal fordampe for at transportere nøjagtigt nok energi til at holde temperaturen konstant?
- (a) hvor meget varmeoverførsel er nødvendig for at hæve temperaturen på et isstykke på 0,200 kg fra -20,0 liter til 130 liter, inklusive den energi, der er nødvendig til faseændringer? (b) hvor lang tid kræves der for hvert trin under forudsætning af en konstant 20,0 kJ/s varmeoverførselshastighed? (C) lav en graf over temperatur versus tid for denne proces.
- i 1986 brød et gigantisk isbjerg væk fra Ross Ice Shelf i Antarktis. Det var cirka et rektangel 160 km langt, 40.0 km bred og 250 m tyk. (a) Hvad er massen af dette isbjerg, i betragtning af at isdensiteten er 917 kg/m3? (b) hvor meget varmeoverførsel (i joule) er nødvendig for at smelte den? (c) hvor mange år ville det tage sollys alene at smelte is så tyk, hvis isen absorberer et gennemsnit på 100 vægt/m2, 12,00 time om dagen?
- hvor mange gram kaffe skal fordampe fra 350 g kaffe i en 100 g glaskop for at afkøle kaffen fra 95,0 liter til 45,0 liter? Du kan antage, at kaffen har de samme termiske egenskaber som vand, og at den gennemsnitlige fordampningsvarme er 2340 kJ/kg (560 cal/g). (Du kan forsømme ændringen i massen af kaffen, når den afkøles, hvilket giver dig et svar, der er lidt større end korrekt.)
- (A) det er vanskeligt at slukke en brand på et råolietankskib, fordi hver liter råolie frigiver 2,80 liter 107 j energi, når den brændes. For at illustrere denne vanskelighed skal du beregne antallet af liter vand, der skal bruges til at absorbere den energi, der frigives ved at brænde 1,00 L råolie, hvis vandet har sin temperatur hævet fra 20,0 liter til 100 liter, koger det, og den resulterende damp hæves til 300 liter. B) drøfte yderligere komplikationer, der skyldes, at råolie har en mindre massefylde end vand.
- energien frigivet fra kondens i tordenvejr kan være meget stor. Beregn den energi, der frigives i atmosfæren for en lille storm med radius 1 km, forudsat at 1,0 cm regn udfældes ensartet over dette område.
- for at forhindre frostskader sprøjtes 4,00 kg 0 liter vand på et frugttræ. (A) hvor meget varme overføres når vandet fryser? (b) hvor meget ville temperaturen på 200 kg træet falde, hvis denne mængde varme overføres fra træet? Tag den specifikke varme til at være 3,35 kJ / kg · liter, og antag, at der ikke sker nogen faseændring.
- en 0,250 kg aluminiumskål med 0,800 kg suppe ved 25,0 liter placeres i en fryser. Hvad er den endelige temperatur, hvis 377 kJ energi overføres fra skålen og suppen, forudsat at suppens termiske egenskaber er de samme som for vand?
- en 0,0500 kg isterning ved -30,0 liter placeres i 0,400 kg 35,0 liter vand i en meget velisoleret beholder. Hvad er den endelige temperatur?
- hvis du hælder 0,0100 kg 20,0 liter vand på en 1,20 kg isblok (som oprindeligt er ved -15,0 liter), hvad er den endelige temperatur? Du kan antage, at vandet køler så hurtigt, at virkningerne af omgivelserne er ubetydelige.oprindelige folk laver undertiden mad i vandtætte kurve ved at placere varme klipper i vand for at koge det. Hvilken masse på 500 liter sten skal placeres i 4,00 kg 15,0 liter vand for at bringe temperaturen til 100 liter, hvis 0,0250 kg vand slipper ud som damp fra den oprindelige syde? Du kan forsømme virkningerne af omgivelserne og tage den gennemsnitlige specifikke varme af klipperne til at være granit.
- hvad ville være den endelige temperatur på gryden og vandet ved beregning af den endelige temperatur, når varmen overføres mellem to kroppe: hælde koldt vand i en varm gryde, hvis 0,260 kg vand blev anbragt i gryden og 0,0100 kg af vandet fordampede straks, hvilket efterlod resten til en fælles temperatur med gryden?
- i nogle lande anvendes flydende nitrogen på mælkevogne i stedet for mekaniske køleskabe. A 3.00-timers leveringstur kræver 200 L flydende nitrogen, som har en densitet på 808 kg/m3. (A) Beregn den varmeoverførsel, der er nødvendig for at fordampe denne mængde flydende nitrogen, og hæv temperaturen til 3,00 liter. (Brug cp og antag, at det er konstant over temperaturområdet.) Denne værdi er mængden af afkøling af flydende nitrogenforsyninger. (b) Hvad er denne varmeoverførselshastighed i kilovatt-timer? C) sammenligne den afkølingsmængde, der opnås ved smeltning af en identisk masse på 0 liter is, med den, der opnås ved fordampning af det flydende nitrogen.
- nogle pistolfans laver deres egne kugler, hvilket indebærer smeltning og støbning af blysnegle. Hvor meget varmeoverførsel er nødvendig for at hæve temperaturen og smelte 0,500 kg bly, startende fra 25,0 liter?
ordliste
sublimeringsvarme: den energi, der kræves for at ændre et stof fra den faste fase til dampfasen
latent varmekoefficient: en fysisk konstant svarende til mængden af overført varme for hver 1 kg af et stof under ændringen i stoffets fase
sublimering: overgangen fra den faste fase til dampfasen
udvalgte løsninger på problemer& øvelser
1. 35, 9 kcal
3. (a) 591 kcal; (b) 4,94 liter 103 s
5. 13, 5 V
7. (a) 148 kcal; (b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33, 0 g
10. (a) 9,67 L; (b) råolie er mindre tæt end vand, så den flyder oven på vandet og derved udsætter den for iltet i luften, som den bruger til at brænde. Hvis vandet er under olien, er det også mindre effektivt til at absorbere den varme, der genereres af olien.
12. a) 319 kcal; (b) 2.00 LARC
14. 20, 6 LARC
16. 4, 38 kg
18. (a) 1,57 liter 104 kcal; (b) 18,3 kg liter h; (c) 1,29 liter 104 kcal
- værdier Citeret ved de normale smelte-og kogetemperaturer ved standard atmosfærisk tryk (1 atm). ved 37,0 liter (kropstemperatur) er fordampningsvarmen Lv for vand 2430 kJ / kg eller 580 kcal/kg liter
- ved 37,0 liter (kropstemperatur), fordampningsvarmen Lv for vand er 2430 kJ / kg eller 580 kcal /kg liter