en 49-årig mand med en historie med alkoholmisbrug præsenterer ED med klager over generaliseret mavesmerter og opkast i de sidste 36 timer. Patienten er velkendt for afdelingen for alkoholrelaterede besøg og fortsætter med at drikke dagligt. Ved ankomsten er han takykardisk og takypneisk, og fysiske undersøgelsesresultater inkluderer tørre slimhinder, nedsat sakin turgor, epigastrisk ømhed og rysten i begge hænder. Laboratorieundersøgelser viser et serumbicarbonat på 10 mekv/L, et aniongab på 30, en serumglukose på 95 mg/dL, en mælkesyreacidose med pH 7,2, hypofosfatæmi og spor ketonuri. Abdominal CT-scanning er normal. Han benægter en historie med diabetes mellitus, indtagelse af giftige alkoholer eller nylig sygdom.
denne patient kunne potentielt have en af mange diagnoser, men hans præsentation og laboratoriefund er mest konsistente med alkoholisk ketoacidose (AKA). AKA kan være en almindelig ED-diagnose og forekommer typisk hos kroniske alkoholdrikkere, der har en pludselig ophør i deres alkoholindtag kombineret med nedsat glykæmisk indtag og intravaskulær volumenudtømning.1
i de fleste tilfælde fører en udfældende begivenhed såsom pancreatitis, gastritis eller en aspirationspneumoni til et pludseligt fald i oral indtagelse. Cirka 24 Til 72 timer efter ophør af PO-indtagelse kan AKA udvikle sig.2 Disse patienter har normalt en lav eller fraværende serumalkoholkoncentration og kan præsentere med forskellige grader af alkoholudtagning. Imidlertid er et klart sensorium et kendetegn ved denne tilstand. Tilstedeværelsen af en ændring i bevidstheden antyder stærkt, at en anden proces er til stede.3
selvom den underliggende patofysiologi er kompleks, hjælper en korrekt forståelse i høj grad diagnosen og håndteringen af denne tilstand.
Der er tre generelle begreber, der driver AKA:
- alkoholindtagelse, sammensat med nedsat kalorieindtag og dehydrering, favoriserer en ketotisk tilstand.
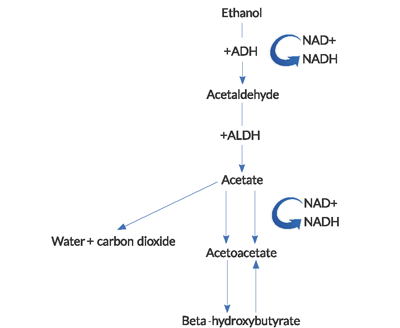
ketoacidose er forårsaget af en kombination af faktorer, herunder sult-induceret hypoinsulinæmi, iltning af alkohol til dets forskellige ketonmetabolitter, lipolyse med fri fedtsyre (FFA) frigivelse og intravaskulær volumenkontraktion. Den relative sulttilstand i AKA fører til overdreven glukagonsekretion og reducerede perifere insulinkoncentrationer, som spiller en nøglerolle i udviklingen af ketoacidose. Metabolisme af fedtstoffer gennem lipolyse producerer beta-hydroksybutyrat (BHB) og acytylacetat (ACA). Disse ketoner anvendes til cellulær respiration for at give energi gennem adenosintrifosfat (ATP) produktion, men tilføjer til aniongabet acidose set i AKA.
- under metabolismen af ethanol genereres store mængder NADH (den reducerede form af nicotinamid-adenindinucleotid).4
NAD+ er et coensym, der bruges til at bære elektroner i intracellulære reaktioner. Reduktionen af NAD+ og følgeakkumulering og ubalance af NADH i metabolismen af ethanol har flere vigtige konsekvenser. BHB-generation dominerer over produktionen af ACA i dette høje NADH til NAD+ – forhold. Dette unormale forhold fører til en hæmning af citronsyrecyklussen og hepatisk glukoneogenese, hvilket delvis forklarer, hvorfor hyperglykæmi er sjælden hos disse patienter.Næsten kontraintuitivt er der en manglende regenerering af normale niveauer af NAD+ og ACA i AKA. REOKSIDISERINGEN af NADH til NAD + ser ud til at være begrænset af en kombination af faktorer, herunder hypofosfatæmi og en funktionel blok i mitokondrierne.2den mælkesyreacidose, der ses i AKA, skyldes en unormal redoks-tilstand. Pyruvat er et substrat, der anvendes i adskillige energiproducerende veje, men ved alkoholisk ketoacidose skiftes det fra dets normale metaboliske veje til andre, der øger laktatproduktionen. Derudover er regenerering af pyruvat fra mælkesyre svækket.
- en øget adrenerg tilstand og volumenudtømning forværrer ketose og hæmmer glukoneogenese, hvilket skaber en tilstand, der favoriserer oprettelse og vedligeholdelse af et ketotisk miljø.
kroppen reagerer på sult, dehydrering og hypoglykæmi med frigivelse af modregulerende hormoner. Disse hormoner øger sympatisk tone, nedsætter insulinfrigivelsen og øger ketonkoncentrationen gennem frigivelse af FFA ‘ er og nedsat perifer ketonmetabolisme. Alle disse ændringer opretholder den ketotiske tilstand, indtil glukose genindføres i systemet. Signifikant dehydrering på grund af opkastning og nedsat oral indtagelse fører til nedsat renal keton clearance, hvilket yderligere forværrer situationen.2differentialdiagnosen for AKA bør omfatte sulteketose og diabetisk ketoacidose (DKA). Selvom en grundig historie kan hjælpe med at indsnævre forskellen, er et metabolisk panel vigtigt for at bekræfte diagnosen. Anionhuller på 30 mækv / L eller mere kan ses i AKA, selvom kløften kan skjules af en samtidig primær metabolisk alkalose på grund af opkast. Faktisk er der tilfælde rapporter om patienter med AKA, der har en alkalæmisk serum pH på grund af overdreven opkastning.Aniongabet i sulteketose er typisk meget lavere, med bicarbonatniveauer sjældent under 18 mækv/L og serum-pH typisk over 7,30.2 i DKA kan derimod aniongabet være ret højt, hvor bicarbonatniveauer ofte når de enkelte cifre. Hyperglykæmi med glykosuri, typisk set ved diabetisk ketoacidose (DKA), er sjælden med AKA.4 kronisk underernæring fører til lave glykogenreserver, og den øgede adrenerge tone fører til hæmning af hepatisk glukoneogenese. Ketonuri, der er til stede under alle tre af disse tilstande, kan forvirre sværhedsgraden af AKA.Ketonuri måles ved nitroprussid-testen, hvor en farveændring indikerer den relative koncentration af acetone og ACA i urinen. Tilstedeværelsen af BHB, den mest fremtrædende keton til stede i AKA, afspejles ikke af nitroprussid-testen. Dette forklarer, hvorfor patienter med AKA muligvis ikke viser nogen eller kun let ketonuri ved den første præsentation med en paradoksal stigning, da tilstanden vendes. Efterhånden som ACA:BHB-forholdet normaliseres, ryddes både den påviselige ACA og BHB i urinen.
differentialdiagnose
andre livstruende tilstande, der kan forårsage en signifikant aniongab acidose, bør også overvejes i differentialdiagnosen. De giftige alkoholer, specifikt methanol og ethylenglycol, kan indtages forsætligt eller ved et uheld i denne patientpopulation. Disse indtag kan forårsage betydelig sygelighed og dødelighed, hvis det ikke håndteres korrekt.5 ændret mental status er et almindeligt træk ved indtagelse af giftig alkohol, men ses normalt ikke i AKA.5
patienter vil typisk have et indledende osmolært hul, der overgår til et øget aniongab, når den giftige alkohol metaboliseres. Forhøjet serum BHB-koncentration kan være ret forhøjet i AKA, men dette udelukker ikke nødvendigvis muligheden for indtagelse af giftig alkohol; fraværet af et osmolært eller aniongab udelukker heller ikke diagnosen. Mens patienter i AKA har en svag mælkesyreacidose, bør tilstedeværelsen af et signifikant forhøjet laktatniveau bede om søgen efter en underliggende sygdom. Sjældent kan en kombination af AKA og en af disse andre begivenheder forekomme og præsentere et diagnostisk Gåde. Tankevækkende overvejelse af timing, type og mængde indtagelse og tilknyttede symptomer i kombination med observation og laboratorieundersøgelser skal bruges til at foretage denne differentiering, hvis der mangler en klar og nøjagtig historie.
behandling
reversering af ketose og kraftig rehydrering er centrale i håndteringen af AKA. Ud over isotonisk væskeudskiftning er der behov for glucoseholdige intravenøse væsker. Typisk giver 5% dekstrose med halv normal saltvand med en hastighed på 150 mL i timen tilstrækkelig glukose til at stimulere bugspytkirtlen til at udskille insulin, hvilket gør det muligt for perifere væv at metabolisere ketoner og hæmme FFA-frigivelse.2 Det giver også kroppen mulighed for at regenerere NAD+, som hæmmes af de metaboliske ændringer forårsaget af AKA. Intravenøs infusion af glucoseholdig væske skal stoppes, når bicarbonatniveauerne har nået 18-20 mekv/L, og patienten tolererer oral indtagelse. Dette sker typisk 8 til 16 timer efter påbegyndelse af behandlingen.2 tilbagetrækning af alkohol hos disse patienter skal håndteres aggressivt med intravenøs brug. Thiamin, folat og andre elektrolytter, især fosfat og kalium, skal muligvis genopfyldes hos disse patienter.6 interessant nok skyldes størstedelen af sygelighed set i AKA den underliggende proces, der forårsagede ophør af alkohol.
Case konklusion
patienten modtog 4 liter normal saltvand og blev startet på D5-1/2 NS før optagelse. Han fik IV valium til tilbagetrækning af alkohol, og thiamin, folat og fosfat blev genopfyldt. Han blev indlagt på hospitalet i tre dage til behandling af AKA og tilbagetrækning af alkohol, derefter udskrevet, når han tolererede oral indtagelse og i god stand. Han blev set tre uger senere i beredskabsafdelingen for en lignende præsentation.
tabel 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Vej for alkoholmetabolisme
(ADH = alkoholdehydrogenase, ALDH = acetaldehyddehydrogenase).
- Palmer, Jerry P. alkoholisk ketoacidose: klinisk og laboratoriepræsentation, patofysiologi og behandling. Klinikker i endokrinologi og metabolisme 12.2 (1983): 381-389.
- Duffens K, Ja. Alkoholisk ketoacidosisa anmeldelse.Journal of emergency medicine 5.5 (1987): 399-406.
- skruenøgle KD, Slovis CM, Minion GE, et al. Syndromet af alkoholisk ketoacidose. American journal of medicine 91.2 (1991): 119-128.ja, Hockberger RS, vægge RM, et al., EDS. Rosenkrans akutmedicin: begreber og klinisk praksis. Philadelphia, PA: Mosby / Elsevier; 2013. Kapitel 185 alkoholrelateret sygdom af John T. Finnell.
- Kraut JA, Kurts I. krottoksisk alkoholindtagelse: kliniske træk, diagnose og ledelse. Klinisk Tidsskrift for American Society of Nephrology 3.1 (2008): 208-225.
- Miller PD, Heinig R, vandhus C. Behandling af alkoholisk acidose: rollen som dekstrose og fosfor. Arkiv for intern medicin 138.1 (1978): 67-72.