A Microbial Biorealm page on the genus Enterococcus faecalis
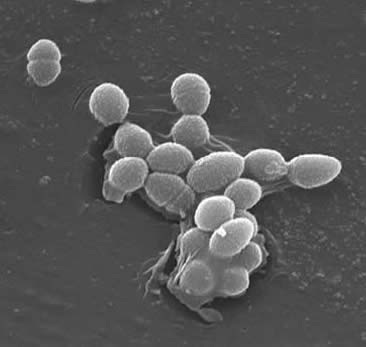
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
arter
Enterococcus faecalis
beskrivelse og betydning
enterokokker er Gram-positive kokker, der kan overleve barske forhold i naturen. De kan findes i jord, vand og planter. Nogle stammer anvendes til fremstilling af fødevarer, mens andre er årsagen til alvorlige infektioner hos mennesker og dyr (f.eks. De er forbundet med både samfund og hospital erhvervet infektioner. Enterokokker kan vokse ved et temperaturområde på 10 til 42 liter C og i miljøer med brede pH-værdier. Nogle er kendt for at være bevægelige. Mens der er over 15 arter af Enterococcus-slægten, er 80-90% af de kliniske isolater E. faecalis (8). Enterokokker danner typisk korte kæder eller er arrangeret parvis. Under visse vækstbetingelser forlænger de imidlertid og forekommer cocobacillære. Generelt er enterokokker alfa-hæmolytiske. Nogle besidder Gruppe D Lancefield antigen og kan detekteres ved hjælp af monoklonale antistofbaserede agglutinationstest.Enterokokker er typisk katalasenegative og er anaerobe. De er i stand til at vokse i 6,5% NaCl, kan hydrolysere esculin i nærvær af 40% galdesalte og er pyrrolidonyl arylamidase og leucin arylamidase positive (8). Enterokokker har vist sig at udgøre en terapeutisk udfordring på grund af deres resistens over for mange antimikrobielle lægemidler, “herunder cellevægsaktive stoffer; aminoglycosider, penicillin og ampicillin og vancomycin” (1). Enterokokkerne har kapacitet til at erhverve en lang række antimikrobielle resistensfaktorer, som udgør alvorlige problemer i behandlingen af patienter med enterokokinfektioner (8). Generelt kan enterokokisolater med nedsat modtagelighed for vancomycin kategoriseres som vanA, vanB og vanC. vanA og vanB udgør den største trussel, fordi de er de mest resistente, og resistensgenerne bæres på et plasmid. Da resistensgenerne bæres på et plasmid, kan de let overføres, E. faecalis kan overføre disse plasmider ved konjugation (2). E. faecalis er også resistente over for teicoplanin. Enterokokstammer, der er vancomycin-afhængige, er fundet, men er sjældne og mindre almindelige end vancomycin-resistente stammer (benævnt “vancomycin-resistente enterokokker” eller “VRE”) (1).
Genomstruktur

På grund af mange folkesundhedsfarer var genomsekvensdata fra en stamme af Enterococcus nødvendig. Stammen valgt til genom-DNA-sekventering var E. faecalis V583, det første vancomycinresistente isolat i USA. Genomet af stamme V583 blev sekventeret af Institut for genomforskning (TIGR). Enterokokgenomet viser, at E. faecalis er metabolisk forskelligartet og indeholder en bred vifte af reguleringssystemer. Stamme V583 indeholder fire DNA-molekyler: de vigtigste 3.218.030 basepar bakteriekromosomer og tre cirkulære plasmider. Kromosomet indeholder omkring 3.500 åbne læserammer (Orf ‘er), omkring 1/3 af disse Orf’ er har ingen tildelbar funktion (8). De tre plasmider er cirkulære DNA-molekyler identificeret som Plasmid-1, Plasmid-2 og Plasmid-3. Plasmid-1 indeholder 66.320 bp, Plasmid-2 indeholder 17.963 bp, og Plasmid-3 indeholder 57.660 BP. Plasmiderne koder for et antal gener, herunder transposaser, multi-lægemiddelresistensproteiner og en ppGpp-reguleret væksthæmmer (8). Den gennemsnitlige G + C-sammensætning af E. faecalis-kromosomet er 37,38%. Da DNA-molekylet er så stort, forekommer regionale afvigelser fra gennemsnittet. Et af disse placeringer er det store segment forbundet med “vancomycinresistensgenklyngen placeret nær 2,22 Mb”, der viser en stor stigning i procent G+C-indhold (8). Disse forskelle forbundet med antibiotikaresistens eller virulens foreslog erhvervelse af genetisk materiale fra en fremmed art gennem vandret overførsel. Det er stadig ukendt, om overførslerne er ansvarlige for variationerne i DNA-makeup. Oplysningerne indeholdt i genomet af E. faecalis V583 vil i høj grad hjælpe forståelsen af, hvordan organismen har tilpasset sig til at være et alsidigt humant patogen. Ved hjælp af sammenlignende genomik forstås de forskellige reguleringselementers rolle bedre i, hvordan de reagerer på forskellige miljøbelastninger og i udtrykket af potentielle virulensfaktorer (8). Flere undersøgelser som disse vil foreslå nye lægemidler til bakterielle infektioner forårsaget af enterokokker.Genomet indeholder også 3 Ebp (koder for endocarditis biofilm-associerede pili) operoner, som er vigtige for biofilmproduktion af E. faecalis stamme og1rf. Denne stamme bruger disse operoner til at producere overfladepili. . Overfladen pili anvendes til “fastgørelse til værtsoverfladerne og er antigene hos mennesker under endokarditis” (9).
TIGR indeholder en komplet liste over gener for E. faecalis kromosomer.
cellestruktur og metabolisme
cellemetabolisme
Enterokokkerne befinder sig i barske miljøer, som tarmkanalerne hos mennesker og dyr. Vækst under disse fjendtlige forhold kræver, at E. faecalis har et stofskifte, der er fleksibelt. E. faecalis er i stand til ikke kun gæring for at producere mælkesyre, men kan også “katabolisere et spektrum af energikilder fra kulhydrater, glycerol, lactat, malat, citrat, diaminosyrer og Manya-keto syrer” (3).Det har vist sig, at E. faecalis under udvalgte vækstbetingelser kan øge væksten gennem iltning phosphorylering ved hjælp af en protonmotivkraft etableret ved elektrontransport. En konsekvens af “spirende respiration er produktion af potente iltningsmidler” (f.eks. superkilte og brintoverilte), iltning stress E. faecalis kan tåle (3). Tolerancen for denne stress kombineret med andre alvorlige vækstbetingelser gør det muligt for E. faecalis at vokse ved 10 til 45 liter C, i galdesalte og ved ekstremt lav og høj pHs. Desuden kan E. faecalis modstå acid, vaskemidler, tungmetaller og ethanol. Da E. faecalis kan udnytte forskellige sukkerkilder, kan den leve i forskellige miljøer, især i tarmen, hvor næringsstoffer er begrænsede (2). I tarmen får E. faecalis det meste af deres energi fra gæringen af ikke-absorberede sukkerarter. E. faecalis kan også få energi ved at nedbryde muciner, et kulhydrat, der er stærkt glycosyleret og produceret af tarmbægerceller (2).E. faecalis bruger et “phosphoenolypyruvatphosphotransferasesystem (PTS) til at mærke sukker uden for cellen og par optagelse af sukker med phosphorylering” (2). Dermed spildes mindre energi (ATP) sammenlignet med, hvordan sukker akkumuleres af ikke-PTS-systemer. Sukkerarter, der metaboliseres af E. faecalis, omfatter: D-glucose, D-fructose, lactose, maltose (alle PTS-substrater). I enterokokker regulerer PTS også glycerolmetabolisme, inducerudvisning og katabolitundertrykkelse (8). E. faecalis er en af få grampositive bakterier med lavt G+C-indhold, der udviser sukker under vækst på glukose, et fænomen kendt som inducerudvisning (8). E. faecalis kan endda fermentere glycerol under aerobe og mikroaerophilliske forhold. E. faecalis kan også vokse på glycerol under anaerobe forhold, fordi det “udtrykker et gen for NAD+-bundet anaerob glyceroldehydrogenaseaktivitet” (8). Glycerol kan krydse cellemembranen ved hjælp af et protein kaldet glycerol diffusion facilitator (GlpF). GlpF gør koncentrationen af glycerol i og uden for cellen lige, proteinet hæmmes af glykolyse. E. faecalis er i stand til at leve i ekstrem alkalisk pH og høj saltkoncentration. Disse træk kræver kationtransport for at opretholde den konstante cytosoliske ionsammensætning, der er essentiel for homeostase. Alle celler skal udvise overskydende natrium for at opretholde cytosoliske koncentrationer i rækkevidde, der favoriserer homeostase. E. faecalis udtrykker både en Na+ / H + antiporter og en vakuolær ATPase (2). Kalium er en større intracellulær kation. Kaliumkoncentrationen inden for E. faecalis på 0,4 til 0,6 M er afgørende for normal cellulær metabolisme, det “neutraliserer intracellulære anioner, aktiverer forskellige former og regulerer cytosolisk pH” (8). E. faecalis udtrykker mindst to kaliumtransportører til at udføre reguleringen, KtrI og KtrII sammen med Kep-systemet til K+ – ekstrudering (8). Selvom det er kendt, at KtrI og KtrII er k+ optagelsessystemer (de er K+/H+ symportere), er lidt mere kendt proteinerne.
cellestruktur
enterokokker er Gram-positive kokker, der typisk danner korte kæder eller er arrangeret parvis (3). Under visse vækstbetingelser kan de forlænge og forekomme coccobacillary. Cellevæggen af E. faecalis er 20 Til 38% af tørcellevægten (i de eksponentielle og stationære faseceller). I betragtning af at E. faecalis er en Gram-positiv bakterie, er der tre hovedkomponenter, der udgør dens cellevæg: peptidoglycan, teichoinsyre og polysaccharid. 40% af cellevæggen består af peptidoglycan, mens resten af cellevæggen består af et “rhamnoseholdigt polysaccharid og en ribitolholdig teichosyre” (3). Peptidioglycan fungerer (som i de fleste Gram-positive celler) til at modstå sprængning induceret af højt cytoplasmatisk osmotisk tryk. E. faecalis betragtes generelt som en ikke-indkapslet organisme, vist ved” manglen på en påviselig mucoidfænotype ” (3). Imidlertid har delmængder af E. faecalis isolater et kapselpolysaccharid. E. faecalis kan udveksle genetisk materiale (plasmider) ved konjugationsprocesser induceret af små peptidferomoner (2). Overfladeprotein “aggregeringsstoffer, der genkender en specifik ligand på modtagerceller” sikrer vellykkede forbindelser til konjugation (2).E. faecalis har også evnen til at fremstille overfladepili, hvilket kan føre til dannelse af en biofilm. E. faecalis-stammerne, der forårsager endokarditis, indeholder store mængder af disse pili. Pili giver mulighed for fastgørelse til værtsoverflader (f.eks. hjertevævet). Stammerne af E. faecalis, der forårsager endokarditis, producerer “biofilmen signifikant oftere og også i større grad end ikke-endokarditis isolater” (9).
økologi
E. faecalis er en meget forskelligartet art af enterokokker. Det interagerer med mange andre organismer og har virkninger på miljøet. Enterokokkerne er medlemmer af bakteriesamfundet, der befinder sig i tyktarmen hos mennesker. De er også en naturlig del af tarmfloraen i de fleste andre pattedyr og fugle (8). Enterokokker findes også i jord, planter og vand. Når de findes i vand, skyldes det typisk, at vandet var blevet forurenet med fækalt stof. Selvom E. faecalis ikke forekommer for ofte i planter, er der fundet andre stammer af enterokokker blandt planter og er sandsynligvis gøre for en forurenet vandkilde (8).Økologien af antibiotikaresistens og virulensgenoverførsel i miljøet er stadig ikke godt forstået. Insekter, såsom husfluer (HF), der udvikler sig i rådnende organisk materiale, kan overføre antibiotikaresistente bakterier fra husdyrgødning og andre rådnende organiske substrater til boligområder (7). HF er perfekte sendere på grund af de levende mikrobielle samfund, der findes i de levesteder, hvor de udvikler sig (f.eks. Tilføjelse til de gode overførselskvaliteter er den måde, hvorpå HF fodrer deres unge (regurgitation) og deres tiltrækning til menneskelig mad. Da HF kan flyve lange afstande, er dette insekt meget godt til spredning af fækale bakterier, herunder humane og animalske patogener, og muligvis antibiotikaresistente stammer af enterokokker (7). En nylig undersøgelse screenet for antibiotikaresistens og virulensgener i enterokokker fra HF i fastfood restauranter i Kanasas. Denne undersøgelse viste ,at” husfluer i madhåndterings-og serveringsfaciliteter kan bære antibiotikaresistente og potentielt virulente enterokokker, der har kapacitet til vandret overførsel af antibiotikaresistensgener til andre bakterier ” (7).De virkninger, som E. faecalis har på miljøet tendens til at være mere negativ. De forurener typisk vandforsyninger, der kan føre til inficerede planter såvel som infektioner hos mennesker (8). De antibiotiske faktorer kan også transporteres af forskellige insekter (f.eks. husfluer) og dyr, hvilket fører til et stigende antal virulente E. faecalis.
patologi
enterokokker er opstået som en væsentlig årsag til nosokomiale infektioner, og inden for denne gruppe forårsager Enterococcus faecalis størstedelen af humane enterokokinfektioner. Disse infektioner kan være lokale eller systematiske og omfatter urinvejsinfektioner og abdominale infektioner, sårinfektioner, bakteriæmi og endokarditis (2). Da E. faecalis er i stand til at overleve adskillige miljømæssige udfordringer (såsom ekstreme temperaturer og tilstedeværelsen af galdesalte), og fordi de kan erhverve resistens over for flere antibiotika, er disse bakterier blevet et stort helbredsproblem. Det Nationale nosokomiale Infektionsovervågningssystem (NNIS) har rapporteret stigninger i forekomsten af infektioner på grund af vancomycinresistente enterokokker (VRE) siden 1989 (1). Dette kan betyde alvorlige helbredsproblemer, som inkluderer manglen på tilgængelig antibiotikabehandling mod VRE-infektioner, fordi de fleste VRE-stammer har resistens over for flere antibiotika udover vancomycin (f.eks. Overførslen af vanocmycinresistente gener fra VRE til andre Gram-positive patogener er et alvorligt folkesundhedsproblem. Den mest almindelige måde, hvorpå E. faecalis forårsager infektion, forekommer på et hospital / langtidspleje, er transmission af E. faecalis mellem patienter (8). Enterokokker kan bæres i hænderne på sundhedspersonale og transporteres (overføres) fra en patient til en anden. Det har vist sig, at VRE på hænderne kan vare i op til 60 minutter (8). Overførslen fra en sundhedsarbejders hænder til patienten kan finde sted ved kontakt med patientens intravenøse eller urinkateter. Rektale termometre, der ikke rengøres korrekt efter brug, kan også overføre VRE fra patient til patient. Nogle gange kan transmissionen resultere i kolonisering af patientens GI-kanal med den erhvervede stamme. Den nye stamme bliver derefter en del af patientens endogene flora (8). Den erhvervede stamme, der bærer antibiotikaresistensgener, er i stand til at leve i GI-kanalen. Infektioner opstår derefter fra disse nyerhvervede E. faecalis-stammer.E. faecalis kan forårsage mange infektioner i den menneskelige krop. Den mest almindelige infektion forårsaget af enterokokker er infektion i urinvejen. E. faecalis kan forårsage nedre urinvejsinfektioner (UTI), såsom cystisis, prostatitis og epididymitis (8). E. faecalis findes også i intra-abdominal, bækken og blødt væv infektioner. E. faecalis kan forårsage nosokomial bakteriæmi. Kilden til bakteriæmi er oftest urinvejen, der forekommer fra et inficeret intravenøst kateter. Endokarditis er den mest alvorlige enterokokinfektion, da det forårsager betændelse i hjerteklapperne. I mange tilfælde af endokarditis mislykkes antibiotikabehandling, og kirurgi for at fjerne den inficerede ventil er nødvendig (8). Mindre almindelige infektioner forårsaget af E. faecalis inkluderer meningitis, hæmatogen, osteomyelitis, septisk arthritis og (meget sjældent) lungebetændelse. På grund af enterokokkernes resistens over for mange antibiotika er behandling af disse infektioner vanskelig.
anvendelse på bioteknologi
enterokokker er blevet undersøgt til mulig anvendelse som et probiotikum (et kosttilskud, der indeholder levende ikke-virulente mikrobielle celler, der, når de indtages, menes at have en gavnlig indflydelse på sammensætningen af tarmmikrofloraen). Administration af E. faecalis-stammen har vist sig at reducere diarre. E. faecalis probiotika anvendes i kylling/svin / kvægfoder til at sænke diarre hos dyrene (8).
på grund af E. faecalis ‘ høje sygdomsfremkaldende egenskaber er der udført meget mere forskning i, hvordan man stopper virulensen af E. faecalis end den gavnlige anvendelse af E. faecalis.
aktuel forskning
1.) Håb for infektioner forårsaget af Enterococcus faecalis (4)
det er kendt, at vancomycinresistente bakterier (f.eks. E. faecalis) udgør mange problemer for samfundet og forårsager bakterielle infektioner hos mennesker, der er vanskelige at behandle. Enterokokinfektionerne er udfordrende, fordi organismerne har evnen til hurtigt at erhverve og formidle resistensgener. Ceftobiprole (BPR) blev anvendt som et undersøgende cephalosporin mod Gram-positive cocci. BPR er et bredspektret parenteralt cephalosporin med høje affiniteter fra Gram-positive og Gram-negative penicillinbindende proteiner. Det viser også stabilitet mod hydrolyse ved hjælp af kur-lactamaser.Denne undersøgelse undersøgte aktiviteten af BRP mod en stor samling af E. faecalis, ser på Bpr bakteriedræbende aktivitet mod vancomycinresistente isolater. Undersøgelsen viste, at modtageligt for BPR i E. faecalis ikke påvirkes af tilstedeværelsen af vancomycinresistens eller ved produktion af larr-lactamase. I stammerne af E. faecalis, der viste enten vancomycinresistens (VanA-og VanB-fænotyper) eller ampiciliinresistens, var BPR bakteriedræbende. Forskerne viste, at BPR udviste bakteriedræbende aktivitet mod E. faecalis i en dosis på 750 mg, hvilket hæmmer 100% af E. faecalis-aktiviteten. Selv om tilstedeværelsen af E. faecalis er sjælden, kompromitterer dens tilstedeværelse brugen af de mest effektive anti-enterokok-purpura-lactamer (f.eks. ampicillin). BPR er et dårligt substrat for E. faecalis, hvilket forklarer dets fremragende aktivitet mod E. faecalis, der producerer E. lactamase.Denne forskning viste, at BPR har potent aktivitet mod en meget stor samling af E. faecalis. BPR ‘ s aktivitet blev ikke påvirket af vancomycinresistens eller produktion af kurr-lactamase. Derfor er BPR et håbende middel til brug til behandling af larr-lactamaseproducerende og vancomycin-resistente E. faecalis-infektioner hos mennesker.
2.(5)
når antibiotika anvendes til behandling af en bakteriel infektion, kan de have indflydelse på tarmfloraen. Resistente bakterier kan vælges under behandling, såsom enterokokker, og er potentielt patogene. Fremkomsten af resistens er et problem for nye antibiotika, fordi det kan risikere nytten af antibiotika.Denne undersøgelse undersøgte fremkomsten af resistens over for antibiotika af E. faecalis. Mere specifikt så forskerne på resistens over for linesolid (den første af en ny klasse af antibiotika kendt som “oksolidinoner”). Linesolid kan anvendes mod multiresistente Gram-positive cocci, herunder VRE. Det hæmmer bakteriel proteinsyntese ved at binde specifikt til et domæne i 50S ribosomal underenhed og påvirkes ikke af resistensmekanismerne, der påvirker andre antibiotika. Denne undersøgelse undersøgte forekomsten af linesolidresistente E. faecalis-mutanter i fordøjelseskanalen hos gnotobiotiske mus. Dis af linesolid blev fodret i vand med en dosis varierende fra 0,5, 0,005 til 0,005 g/L. mutanterne var alle afhængige af linesolid givet, resistensniveauer steg med eksponeringens varighed. Ingen mutanter blev isoleret i fravær af linesolid, hvilket tyder på, at de novo-resistens over for Linesolid var usædvanlig i Enterokokkerne.Undersøgelsen viste, at en mutation i et enkelt 23S rRNA-gen var det kritiske trin i fremkomsten af linesolid resistens. Primær kolonisering med enkeltmutationsmutanter blev observeret så tidligt som 5 dage efter behandlingsstart hos mus.Disse eksperimenter, der involverer mus, hjælper med at forklare mønsteret for fremkomsten af resistens over for linesolid observeret i kliniske isolater. Forskergruppen viste, at dosis er kritisk for resistensdynamikken. Disse fund skal hjælpe med at definere de bedste terapeutiske strategier for at minimere fremkomsten af resistens i den kliniske indstilling og muligvis redde mange liv.
3.) En Ser / Thr-kinase i Enterococcus faecalis viser sig at formidle antimikrobiel resistens (6)
Enterococcus faecalis forårsager mange af de antibiotikaresistente infektioner på hospitaler, en konsekvens af dens iboende resistens over for visse antibiotika og dens evne til at overleve og sprede sig i tarmkanalen.Det genetiske grundlag for modstanden set i E. faecalis er ikke kendt, denne forskning forsøger at identificere en årsag til modstanden. Forskerne viste, at PrkC, et en-komponent signalprotein indeholdende et eukaryot-Type Ser/Thr-kinasedomæne, tillod iboende antimikrobiel resistens og intestinal persistens af E. faecalis. De fandt ud af, at en E. faecalis-mutant, der manglede PrkC, voksede med en vildtypehastighed i fravær af antimikrobiel stress, men viste øget følsomhed over for celle-kuvert-aktive forbindelser, herunder antibiotika, der målrettede mod cellevægsbiogenese og galdevaskemidler.PrkC regulerer fysiologiske processer i E. faecalis, der er nøglen til dens succes som et nosokomialt patogen. Forskernes forudsagte struktur af PrkC var et cytoplasmatisk kinasedomæne adskilt af et transmembransegment, der menes at binde ikke-tværbundet peptidoglycan. Dette antydede, at PrkC var en transmembranreceptor, der overvåger integriteten af E. faecalis-cellevæggen og formidler adaptive reaktioner for at opretholde denne intergrity. PrKC er vigtigt for E. faecalis forårsager nosokomiale infektioner, hvilket antyder, at signalproteinet er et mål for udvikling af terapier til forebyggelse af infektioner med antibiotikaresistente enterokokker.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. “Rolle af mobilt DNA i udviklingen af vancomycinresistent Enterococcus faecalis.” Videnskab. Marts 2003. Vol. 299, nr. 5615. s. 2071-2074
2.) Murrary være. Maj 1998. “Mangfoldighed blandt de multidrugresistente enterokokker.”Nye Smitsomme Sygdomme. Vol. 4, Nr. 1. s. 46-65.
3.) De la M., Luis M., Marie T. P. og Janet T. Shigei. Farveatlas af medicinsk bakteriologi. Bøger fra American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. “Time-Kill og Synergism undersøgelser af ceftobiprol mod Enterococcus faecalis, herunder isolater, der producerer relactamase og vancomycinresistente.”Antimikrobielle midler og kemoterapi. Juni 2007. Vol. 51, nr.6. s. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. ” dosisafhængighed af fremkomsten af resistens over for Linesolid i Enterococcus faecalis In vivo.”Journal of Infectious Diseases. 2007. Vol. 195. s. 1480-1488.
6.) Kristich C., Brønd C., Dunny G. “En eukaryot-type Ser/Thr-kinase i Enterococcus faecalis medierer antimikrobiel resistens og intestinal persistens.”Proceedings of the National Academy of Sciences i Amerikas Forenede Stater. Februar 2007. Vol. 104, nr.9. s. 3508-3513.
7.”Økologi af antibiotikaresistensgener: karakterisering af enterokokker fra Husfluer indsamlet i fødevareindstillinger.”Anvendt og miljømæssig Mikrobiologi. Juni 2006. Vol. 72, nr.6. s. 4028-4035.
8.) Gilmore, Michael. Enterokokker: patogenese, Molekylærbiologi og antibiotikaresistens. Bøger fra American Society for Microbiology Press, 2002.
9.)Nallapareddy SR, Singh KV, Sillanp Larsen J, Garsin da, H Larsen M, Erlandsen SL, Murray be.. “Endocarditis og biofilm-associeret pili af Enterococcus faecalis.”Journal of Clinical Investigation. Oktober 2006. 116. s.2799-2807.af Richard A. Martines fra UC San Diego, studerende af Rachel Larsen.