Chemguide: Kernekemi 14 – 16
dobbelt og tredobbelt kovalente bindinger
denne side introducerer muligheden for flere (dobbelt eller tredobbelt) kovalente bindinger mellem atomer ved hjælp af ilt, nitrogen, kulsyre og ethen som eksempler. Disse vælges, fordi de alle ofte er specificeret på britiske pensum for 14-16-årige.
Jeg antager, at du har læst siden indføre kovalent limning og har adgang til en periodisk tabel som den, du kan hente fra dette site.
dobbeltbinding i ilt
Hvis du kigger op ilt på det periodiske bord, vil du opdage, at det har et atomnummer på 8 – og så har det neutrale atom 8 protoner og 8 elektroner. Disse vil blive arrangeret 2,6.
så du har to atomer som dette:
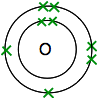
hver har to uparrede elektroner. For at få den maksimale energiske stabilitet skal alle disse parres.
så iltene deler to par elektroner:
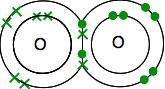
Dette er meget lettere at se ved hjælp af linjer til at repræsentere par af delte elektroner:
![]()
tredobbelt binding i nitrogen
Hvis du finder kvælstof i det periodiske system vil du være i stand til at finde ud af, at dens elektroniske struktur er 2,5. Sammenligner det med ilt, har det derfor et par elektroner og tre uparrede elektroner i dets ydre niveau.
for at gøre det så energisk stabilt som muligt skal det parre alle disse i kovalente bindinger. To nitrogenatomer kombineres derfor på denne måde:
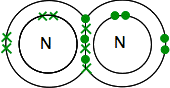
igen er dette meget lettere at se ved hjælp af linjer til at repræsentere par af delte elektroner:
![]()
dobbeltbinding i carbon ‘ S elektroniske struktur er 2,4 med 4 uparrede elektroner i det ydre niveau.
ilt er 2,6 med 2 par elektroner og 2 uparrede elektroner i det ydre niveau.
Du skal ende med alle elektronerne parret – og der er kun en måde at gøre det på.
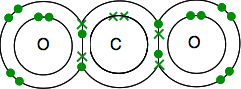
som før er bindingen lettere at se ved hjælp af linjer til binding af par af elektroner.
![]()
Hvis der er to bindingspar af elektroner mellem to atomer, kaldes det ikke overraskende en dobbeltbinding. Så hvert ilt er forbundet med carbonatomet i midten ved en dobbeltbinding.
dobbeltbinding i ethen, C2H4
Ethen og andre lignende forbindelser med dobbeltbindinger mellem carbonatomer er vigtige stoffer i kemi. Du vil møde dem mere detaljeret senere på kurset.
se nøje på dots-and-crosses-diagrammet, og vær sikker på at du forstår, hvordan det hele passer sammen. Det skal være på denne måde, så alle de enkelte elektroner i både kulstofferne og hydrogener parres i bindingspar.
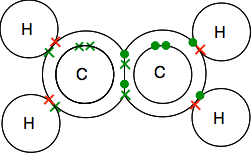
Hvis du støder på diagrammer, der viser bindingsparene som linjer, kan du finde en af to versioner.
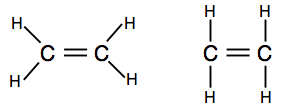
den første viser molekylets faktiske form bedre, men den anden er også helt acceptabel på dette niveau.
hvor vil du gerne gå nu?
til næste side i dette afsnit om kovalent binding . . .
til menuen atomstruktur og binding . . .
til kemi 14-16 menuen . . .
til Chemguide hovedmenu . . .