Hvad er ionbinding?
kemiske bindinger dannes, når den samlede energi af de bundne atomer er lavere end den samlede energi af de separate atomer.Den form, bindingen tager, bestemmes af elektronarrangementet, der minimerer energien.
i nogle tilfælde deles elektroner mellem atomer – dette kaldes kovalent binding.
i andre tilfælde er der en fuldstændig overførsel af en eller flere elektroner fra et atom til et andet.Atomet, der mister elektroner, bliver en positivt ladet ion.Atomet, der modtager elektroner, bliver en negativt ladet ion.
dette fører til ionisk binding – den gensidige elektrostatiske tiltrækning af positiv og negativ charges.In dens reneste form, ionisk binding er ikke retningsbestemt. Det kan betragtes som simpel Coulombic tiltrækning mellem punktafgifter.Dette adskiller sig fra kovalent binding, hvor deling af elektroner resulterer i retningsbestemte bindinger.
Electron Transfer
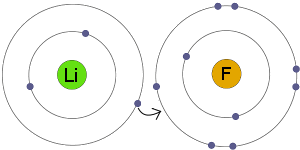
Li overfører en elektron til F. resultatet er, at både den resulterende elektron til ioner bliver elektrisk ladede og har komplette, stabile elektronskaller.
elektrostatisk tiltrækning
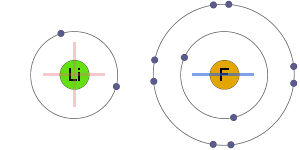
de positive og negative ioner tiltrækkes elektrostatisk til hinanden, hvilket resulterer i en ionbinding.
den coulombiske kraft har ingen foretrukken retning, med det resultat, at ioniske forbindelser har tendens til at eksistere som gigantiske krystalgitterstrukturer af ioner pakket sammen.
en prøve af Lithiumfluoridets krystalgitter

elektronegativitet og ionbinding
to elementer vil have tendens til at binde ionisk, når de adskiller sig meget i elektronegativitet.
Periodisk Tabel over elektronegativitet
jo lysere skyggen af grønt er, desto højere er elektronegativiteten. Grå betyder ingen værdi er kendt. (Klik på billedet for større visning.)

kovalent Bindingskarakter
absolut rene ionbundne forbindelser eksisterer ikke virkelig, fordi den positivt ladede ion polariserer den negative ion ‘ s elektronsky.Dette bemærkes især, når man beskæftiger sig med små, stærkt ladede metalioner, såsom Al3+, skønt den polariserende virkning til en vis grad er til stede i alle ioniske forbindelser.Polarisering er effektivt en retningsbestemt, elektrondelingseffekt, derfor introducerer den en lille mængde kovalens i ioniske forbindelser.
andelen af ionisk / kovalent opførsel i en binding kan vurderes meget groft ved hjælp af Pauling-skalaen for elektronegativitet.Linus Pauling anslog, at en elektronegativitetsforskel på 1,7 mellem elementer fører til binding, der er 50 procent ionisk.
værdier under 1 svarer til kovalent binding dominerende og værdier over 2 til ionbinding dominerende.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
C-H-bindingen med en forskel på 0,35 vil være kovalent, mens NaCl-binding ved 2,23 vil være ionisk.HCl-binding ved 0,96 vil være polær kovalent, og LiI-binding ved 1,68 vil være 50/50 ionisk/kovalent.
den største elektronegativitetsforskel er 3,19, mellem cæsium (0,79) og fluor (3,98). Den resulterende binding er omkring 95 procent ionisk karakter.
