Antiaromatiske forbindelser er usædvanligt ustabile
Hvad er de vigtigste faktorer, der bestemmer, om et molekyle er antiaromatisk?
i vores tidligere indlæg i vores serie om aromaticitet så vi, at aromatiske molekyler er usædvanligt stabile. De har især store resonansenergier, har tendens til at gennemgå substitution snarere end additionsreaktioner og har delokaliserede pi-elektroner (alle C-C-bindingslængderne i bensene er f.eks.
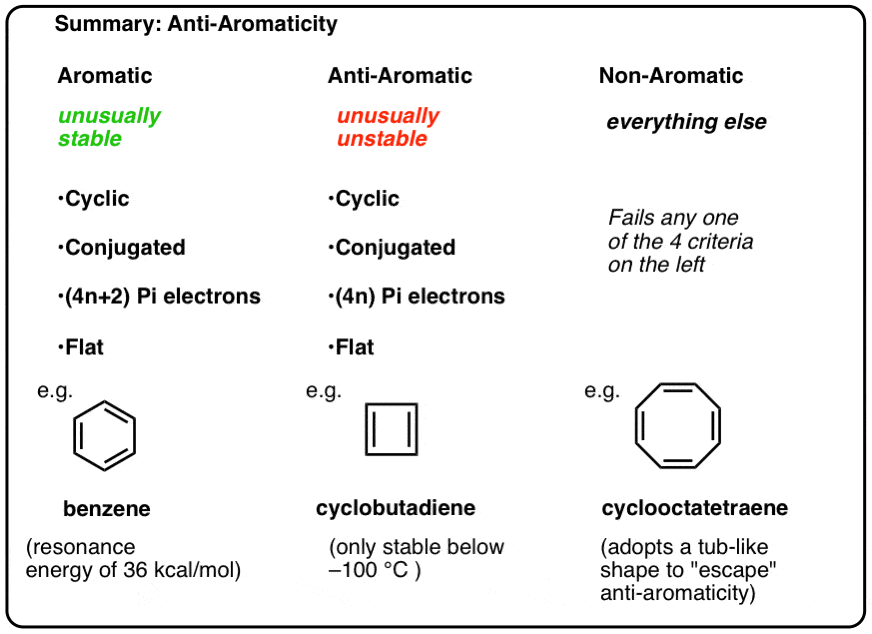
for at være aromatisk skal et molekyle have følgende fire strukturelle egenskaber:
- cyklisk
- konjugeret rundt om ringen
- har pi-elektroner
- flad (plan)
Hvis disse fire betingelser er opfyldt, er molekylet aromatisk.
hvis det flunks selv et spørgsmål på testen, er det ikke-aromatisk.
det ser ud til at være ret klart. Eller er det?
Du kan gætte fra den måde, jeg indrammer dette spørgsmål på, at svaret er “ikke helt”. : – )
Indholdsfortegnelse
- nogle molekyler er så spektakulært og usædvanligt ustabile og svære at isolere, at de fortjener deres egen kategori:Antiaromatisk
- Cyclopentadienyl kation: den “Resonanstabiliserede” Carbocation, der ikke er stabil
- Antiaromatiske Treledede ringe: Oksiren, 1h-Asiren, Thiiren
- Cyclobutadien er Antiaromatisk
- li >
- et 8 pi-elektroneksempel på en antiaromatisk forbindelse: Pentalen
- hvad gør et molekyle Anti-aromatisk?
- Cyclooctatetraene “undslipper” Anti-aromaticitet gennem vridning ud af fladhed
- konklusion: Antiaromatiske forbindelser
- noter
- avanceret: referencer og yderligere læsning
1. Spektakulært ustabile molekyler, der danner en kategori for sig selv:”Anti-aromatisk”
Her er sagen. Der er et lille antal molekyler, der dumpede aromaticitetstesten, der ikke kun er ikke-aromatisk: de har egenskaben at være så spektakulært og usædvanligt ustabile og vanskelige at isolere, at de fortjener et andet navn.
vi kalder disse molekyler “anti-aromatiske”.
det interessante er, at molekylerne i mange tilfælde ikke ser ud til at være særlig ustabile fra de første principper, i modsætning til f.eks. Sjovt nok kan du købe cubane (mere eller mindre) fra Aldrich, men de fleste af de anti-aromatiske molekyler, vi diskuterer nedenfor, er kun stabile ved ekstremt lave temperaturer – hvis de overhovedet kan isoleres!
2. Cyclopentadienylkation: Den” Resonansstabiliserede ” Carbocation, der ikke er stabil
lad os starte vores rejse ned i kaninhullet med et simpelt eksempel, der burde virke kendt fra organisk kemi i første semester.
husk SN1-reaktionen? Katten, der forlader den behagelige stol først?
hurtig gennemgang: Start med et alkylhalogenid. Forlader gruppe blade, der danner en carbocation. Nukleofile angreb. Det kaldes SN1, fordi det hastighedsbestemmende trin (carbocation formation) er unimolekylært. Bundlinie: jo mere stabil carbocation, jo hurtigere fortsætter reaktionen. Derfor er reaktionshastigheden for alkylhalogenider tertiær > sekundær > primær, og carbokationen får særlige bonuspoint, hvis den stabiliseres ved resonans.
se på disse to SN1-reaktioner. Hvilken tror du ville ske hurtigere – SN1-reaktionen, der går gennem en sekundær carbocation (a), eller SN1-reaktionen, der går gennem en sekundær carbocation og kan danne flere resonansformer (B)?
fra alt hvad du har lært hidtil, ville du forvente, at svaret er B).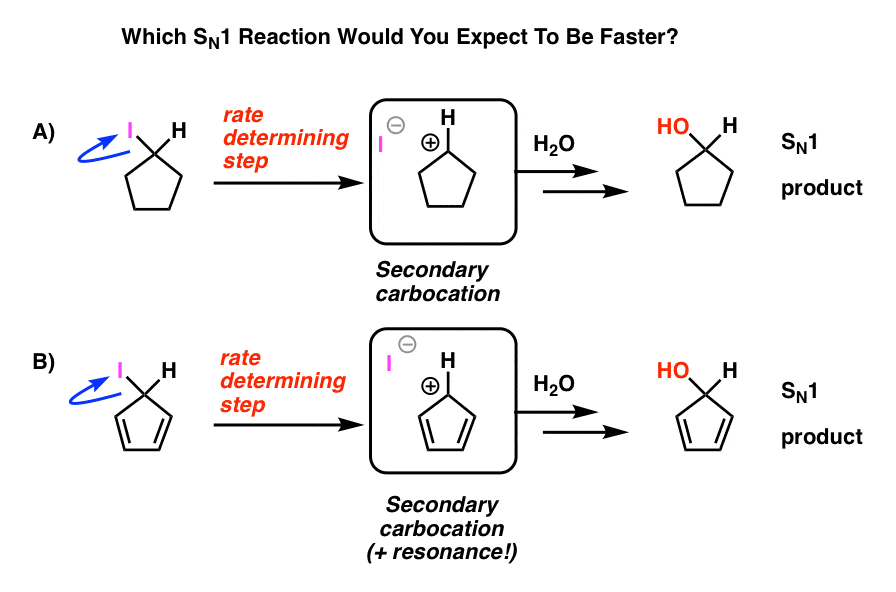
Det er ikke.
svaret er, at reaktion a) sker hurtigere. Reaktion B sker slet ikke.
Dette burde slå dig så dybt underligt.
det er det!
hvordan er det, at denne angiveligt resonanstabiliserede carbocation er mindre stabil end en sekundær carbocation?
Når alt kommer til alt, hvor mange gange bores det i dit hoved, at resonans stabiliserer molekyler, især carbocations?
men her ser det ud til at være destabiliserende. Det er… det er…

men ustabil er det! Cyclopentadienylkationen er utrolig ustabil og vanskelig at lave – og det er ikke på grund af manglende forsøg. Der er noget meget mærkeligt om strukturen af cyclopentadienyl kation, der giver det usædvanlig ustabilitet.

cyklisk, konjugeret, flad…. og har 4 pi elektroner. Interessant!
3. Antiaromatiske Treledede ringe: Oksiren, 1h-Asiren, Thiiren
en anden klasse af “undvigende” molekyler er en familie af treledede ringe. Du kan huske fra Org 1, at det er nemt at lave alkener ved hjælp af et oksidant som m-CPBA.
har du nogensinde spekuleret på, hvorfor vi aldrig dækkede den samme reaktion for alkyner?
Nå, det er ikke for manglende forsøg. Kemikere har prøvet alle slags metoder til epoksidisering af alkyner, og ved du hvad? Reaktionen virker bare ikke.
for eksempel ville epoksidering af acetylen give molekylet nedenfor (oksiren).
Oksiren selv er aldrig blevet observeret, selv om der er fristende spor af dets flygtige eksistens. Og forresten har heller ikke nitrogenanalogen, 1h-aciren eller thiiren.
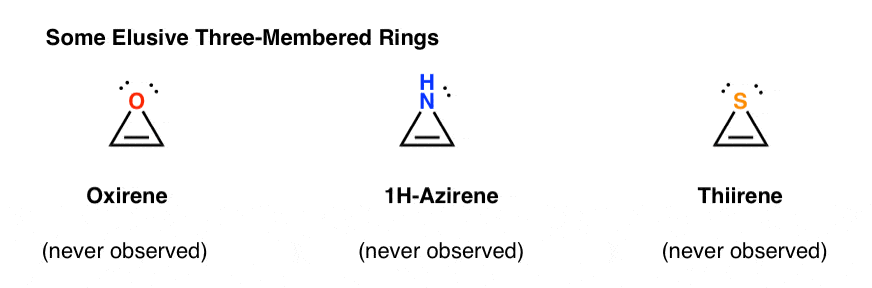
hvorfor ikke? Hvad er specielt ved hver af disse sager?
du bemærker måske, at ligesom cyclopentadienylkationen er disse molekyler cykliske, konjugerede, flade og har 4 pi-elektroner (to i pi-bindingen og to fra et ensomt par).
OK. Hvad ellers kan være cyklisk, konjugeret, fladt og have 4 pi-elektroner?
4. Cyclobutadien er Antiaromatisk
Cyclobutadien ligner et simpelt nok molekyle, men det blev faktisk ikke syntetiseret før i 1965. Og selv da blev det konstateret, at det ikke er stabilt ved temperaturer over 35 Kelvin.
spørgsmålet er, hvorfor?

sikker på, det er en fireleddet ring, og ja, det har en masse ringstamme, men der er lavet mere anstrengte molekyler, der faktisk er stabile ved stuetemperatur.
Du kan også bemærke, at cyclobutadien ligesom ovenstående eksempler er et andet eksempel på et molekyle, der er cyklisk, konjugeret, har 4 pi-elektroner og er fladt.
hvad der er endnu mere interessant er, hvad der blev lært om geometrien af cyclobutadien. I stedet for at være et molekyle med identiske bindingslængder, cyclobutadien viste sig at have en rektangulær form, hvilket indikerer, at elektronerne ikke blev delokaliseret.
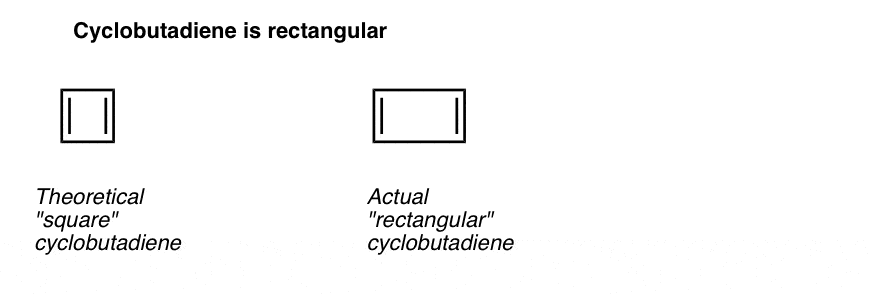
hvad dette fortæller os er, at selv når et molekyle opfylder alle betingelserne (cykliske, konjugerede, flade, 4 pi elektroner), er den symmetriske geometri særlig ustabil. . Meget interessant!
et 8 Pi-Elektroneksempel på en Antiaromatisk forbindelse: Pentalen
indtil videre havde alle de eksempler, vi hidtil har set, 4 pi-elektroner. Du undrer dig måske: er der nogen eksempler på anti-aromatiske molekyler, der har mere end 4 pi-elektroner? Hvorfor, ja.
molekylet nedenfor kaldes “Pentalen”. Det er blevet syntetiseret, men er kun stabilt under -100 liter C. over denne temperatur kombineres det med et andet molekyle af sig selv (reference). Et andet eksempel på spektakulær ustabilitet.

Pentalen har 8 pi elektroner. Dette kan udløse nogle alarmklokker af anerkendelse. Husk, hvordan antallet af pi-elektroner i aromatiske molekyler fulgte sekvensen (2, 6, 10, 14….) ?
dette eksempel antyder, at antallet af pi-elektroner i anti-aromatiske molekyler følger sekvensen (4, 8, 12…)
Hvad gør et molekyle Anti-aromatisk?
så hvad har alle disse molekyler i dette rogues’ galleri til fælles?
hver af dem er cyklisk, konjugeret og flad – og når du tæller antallet af pi-elektroner, er det multipler på 4. Så mens aromatiske molekyler har (4n + 2) pi-elektroner, er “reglen” for anti-aromatiske molekyler (4n). (en anden måde at se på det: antallet af pi-elektroner vil være to gange et lige antal).
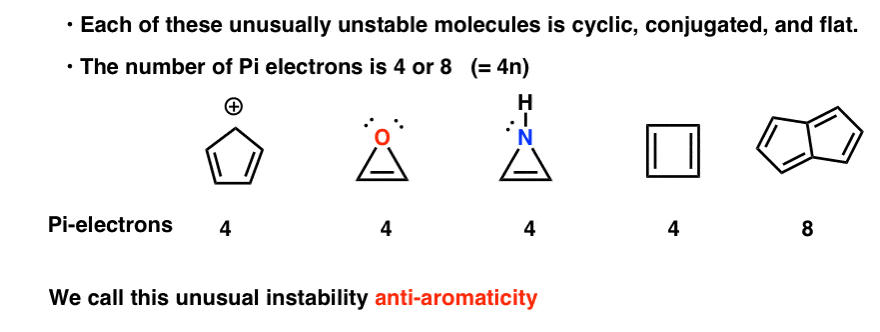
denne usædvanlige ustabilitet kaldes “anti-aromaticitet”.
dette betyder, at vi nu kan udarbejde tre kategorier for molekyler i henhold til følgende kriterier:
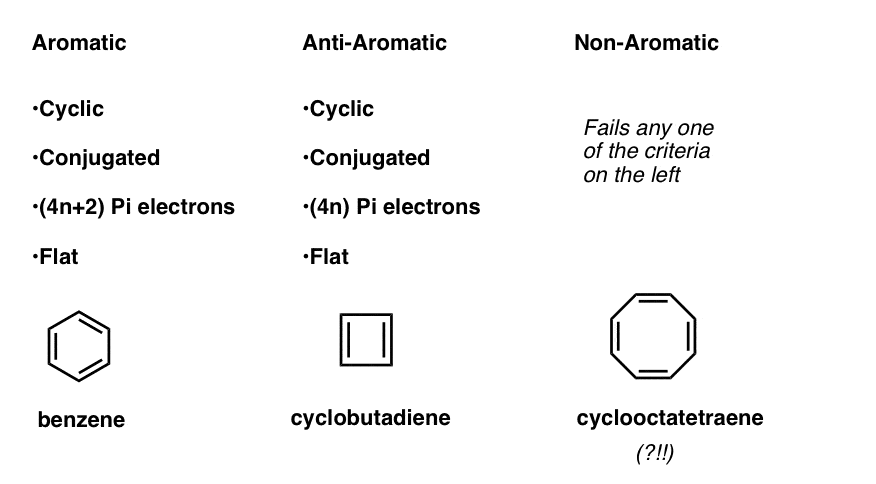
- aromatiske molekyler er cykliske, konjugerede, har (4n+2) pi-elektroner og er flade.
- anti-aromatiske molekyler er cykliske, konjugerede, har (4n) pi-elektroner og er flade.
- ikke-aromatiske molekyler er alle andre molekyler, der fejler en af disse betingelser.
vent et øjeblik – du undrer dig måske over, hvorfor cyclooctatetraen er klassificeret som “ikke-aromatisk”. Med 8 pi-elektroner (to gange et lige antal) skal det ikke være “anti-aromatisk”?
Cyclooctatetraene “undslipper” Anti-aromaticitet gennem vridning ud af fladhed
tænk på at opfylde betingelserne for “anti-aromaticitet” som lidt som at kvalificere sig til en ekstremt straffende indkomstskat. I betragtning af muligheden for at finde et smuthul for at komme ud af skatten, ville du gøre det? Sandsynligvis.
Cyclooctatetraen er kun anti-aromatisk, hvis den er flad. Imidlertid giver den relativt “floppy” struktur af cyclooctatetraen mulighed for en vis fleksibilitet. Bindingerne kan rotere væk fra fladhed, således at molekylet vedtager en “kar-lignende” form og derved undgår “antiaromaticitetsskatten” på 18 12 kcal/mol, der ville blive betalt, hvis alle p-orbitalerne på molekylet blev konjugeret med hinanden.
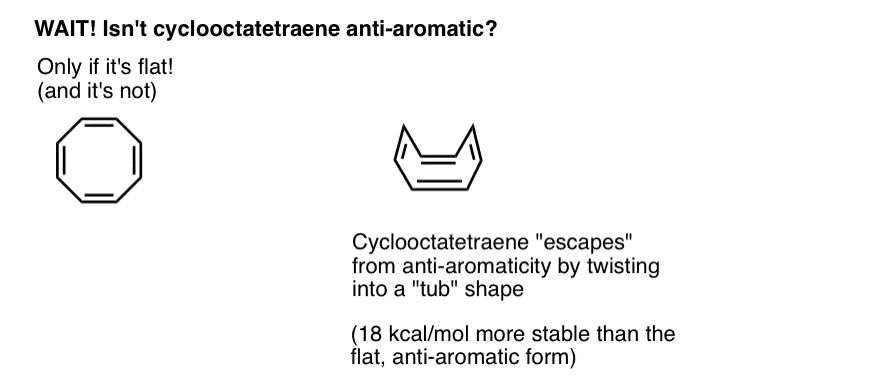
det viser sig, at cyclooctatetraen er blevet syntetiseret, er stabil (du kan f.eks.
Pentalen (ovenfor), som også har 8 pi-elektroner, har en meget stiv bicyklisk struktur, der forhindrer binding-rotation væk fra fladhed. Derfor sidder den fast i sin anti-aromatiske konformation.
Anti-aromaticitet for molekyler med mere end 8 pi-elektroner er kendt, men meget usædvanligt. (Her er et sjovt eksempel på en anden “flugt” fra aromaticitet for et molekyle med 18 pi elektroner.)
konklusion: Antiaromatiske forbindelser
indtil videre har vores behandling af aromaticitet og anti-aromaticitet været rent beskrivende og empirisk. Vi har vist masser af eksempler, og givet masser af regler, men mangler fra diskussionen har været nogen dyb forklaring på “hvorfor”.
Hvad er så specielt ved ringen, der gør den så stabil? Hvorfor er det stabilt?
Hvad er så specielt ved cyclobutadiensystemet, der gør det så ustabilt. Hvorfor er det ustabilt?
for at besvare disse dybere spørgsmål bliver vi nødt til at træde tilbage og undersøge de molekylære orbitaler af disse to molekyler og derefter komme til en dybere forståelse af aromaticitet og anti-aromaticitet.
det er hvad vi vil gøre i vores næste indlæg.
tak for hjælp til at forberede dette indlæg.
noter
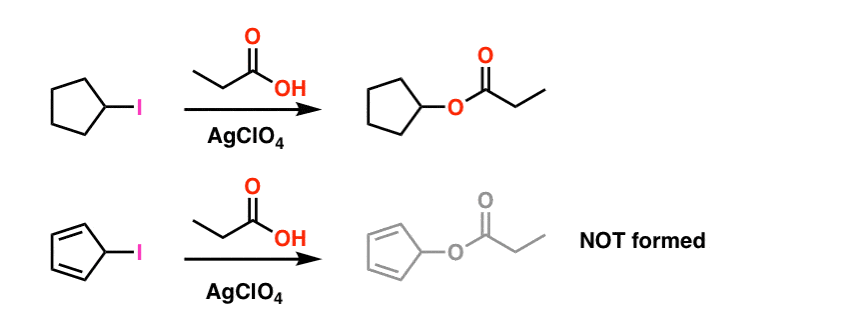
fodnote 1. For enkelhed fudges billedet vist i hovedartiklen på de faktiske reaktionsbetingelser. De faktiske eksperimentelle forhold er vist nedenfor. Opløsningsmidlet er propionsyre, og Sølvperchloratet tilsættes for at hjælpe med at trække iodet af. .
selv under disse betingelser er cyclopentadienylcarbocation ikke dannet, hvilket er et bevis på dets ekstreme ustabilitet.
fodnote 2. Epoksidering på ethen (aka ethylen) udføres til en værdi af 15 millioner tons årligt. Epoksidering af acetylen til dannelse af oksiren er ukendt.
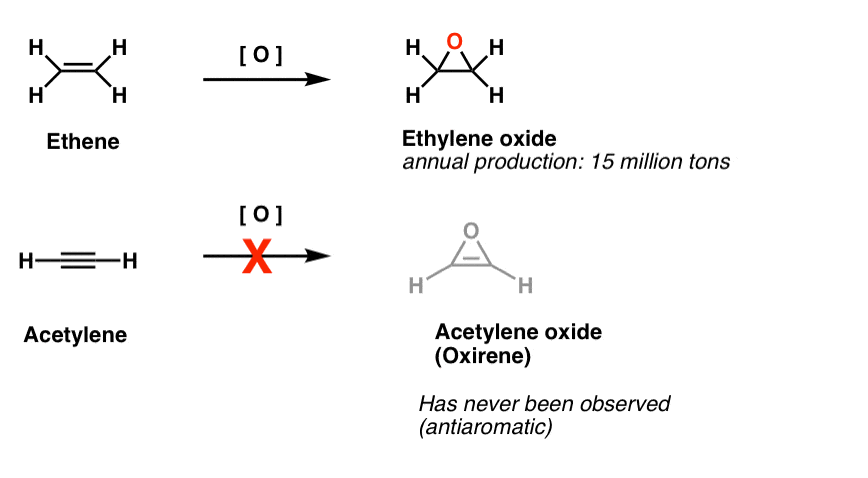
flygtig bevis for eksistensen af oksirener er fundet. Der er gode beviser fra isotopmærkningsundersøgelser for, at iltninger er Flygtige mellemprodukter i visse Ulveomlægninger. Der er også to eksempler på iltninger, der er blevet fanget ved ekstremt lav temperatur, men nedbrydes over 35 Kelvin.
den flygtige eksistens af en 1h-acirin er blevet postuleret i tilsætningen af en nitren til en acetylen, som hurtigt omarrangeres til en (stabil) 2h-aciren (nedenfor).
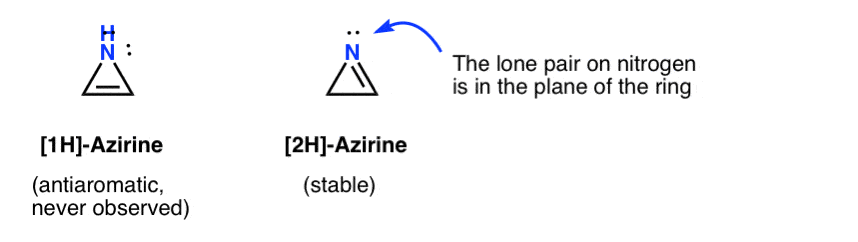
Bemærk, at i 2H-asiren er det ensomme par på nitrogenet vinkelret på pi-systemet, så dette system er ikke-aromatisk i modsætning til anti-aromatisk.
For mere diskussion, se Marts ‘ s Advanced Organic Chemistry. Jeg har arbejdet på 5. udgave, side 62-63.
. Fodnote 3. Et meget smart eksperiment fastslog, at 1,2-dideutero cyclobutadien har to isomerer, ikke en (se nedenfor). Dette indikerer, at dobbeltbindingerne i cyclobutadien ikke er delokaliseret, som de er i bensene, men er mere som dobbeltbindinger i en konventionel Dien.
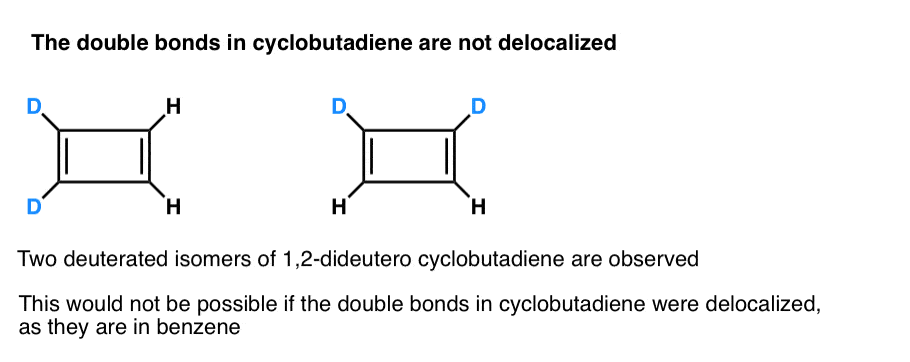
Cyclobutadien reagerer med sig selv ved 35 K for at danne en “dimer” i et eksempel på en Diels-Alder-reaktion.
fodnote 4. Ja, det er rigtigt, at det ensomme par i Airen kan sættes i en sp3 hybrid orbital (nedenfor). Dette reducerer sandsynligvis den anti-aromatiske” straf ” noget, men molekylet er stadig utroligt ustabilt. Anti-aromaticitet er den enkleste måde at redegøre for dette på.

fodnote 5. Den rektangulære geometri skyldes en effekt kendt som Jahn-Teller-effekten. Husk Pauli-udelukkelsesprincippet, hvor elektroner ikke kan have det samme kvantetal? Nå, som vi vil se, når vi ser på det molekylære kredsløbsdiagram af cyclobutadien, har “firkantet” cyclobutadien to “degenererede” elektroner, dvs.de har de samme energier og kvantetal. Dette fører til et fænomen kendt som “Pauli frastødning”, hvor forlængelse af bindingerne forekommer, indtil energiniveauerne for de to elektroner er differentieret. Absolut et avanceret emne.
(avanceret) referencer og yderligere læsning
- Transition-State Spektroskopi af Cyclooctatetraene
Paul G. Vihold, David A. Hrovat, veston T. Borden, vi Lineberger.
videnskab, 1996, 272, 1456-1459.
DOI: 10.1126/videnskab.272.5267.1456
denne undersøgelse er grundlaget for udsagnet om, at den ikke-aromatiske grundtilstand af cyclooctatetraen er 12 kcal/mol under den “antiaromatiske” konformation. - Taming af Cyclobutadiene
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
dette papir af Nobelpristager Prof. Donald J. Cram (UCLA) beskriver den første spektroskopiske karakterisering af cyclobutadien. Dette opnås ved at omslutte forløberen i en hemicarcerand (burkompleks) og derefter bestråle den med UV-lys og således skabe cyclobutadien, som ikke er i stand til at gøre noget, da det er fanget. - Cyclobutadien
Thomas Bally, Satoru Masamune
Tetrahedron 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
dette papir fra 1980 gennemgår arbejde udført på cyclobutadien indtil det tidspunkt. Dette er opdelt i 2 dele – eksperimentel syntetisk indsats og teoretiske beregninger. - Tetrahedran og Cyclobutadien
g Larsnther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
dette papir gennemgår syntetiske bestræbelser mod tetraeder og cyclobutadien – begge molekyler har en formel af C4H4. Kun substituerede (tetra t-butyl og tetra trimethylsilyl) tetraeder er med succes blevet syntetiseret og isoleret til dato. - Cyclobutadien – og Jerntricarbonylkomplekser
F. Emerson og R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Cyclobutadieneiron Tricarbonyl. Et nyt aromatisk System
D. Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
et bonusemne: cyclobutadien kan stabiliseres med metaller – det organometalliske kompleks cyclobutadien jerntricarbonyl er et stabilt, krystallinsk fast stof. Som forfatterne nævner, er det usandsynligt, at fri cyclobutadien genereres i syntesen. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
den antipsykotiske olanapin vedtager en “sommerfugl” – form for at undgå antiaromatiske virkninger, der ligner cyclooctatetraen. Dette er tilsyneladende kritisk for dets funktion. - Antiaromaticitet
Ronald Breslav
regnskaber for kemisk forskning 1973, 6 (12), 393-398
DOI: 1021 / ar50072a001
interessant nok siger Prof. Breslav (Columbia) i denne konto, at han var den person, der først foreslog udtrykket “antiaromatisk” for særligt destabiliserede cykliske forbindelser med 4N p elektroner. Han citerer også andet arbejde af Prof. M. J. S. Devar og andre, hvor den antiaromatiske destabilisering af cyclobutadien beregnes til at være mellem 18-33 kcal/mol i forhold til lineær butadien. - eksperimentel bestemmelse af Antiaromaticiteten af Cyclobutadien
Ashok A. Denis, Kevin S. Peters, Gary J. Snyder
videnskab 1999, 286 (5442), 1119-1122
DOI: 1126/videnskab.286.5442.1119
dette er et meget stringent papir, der bruger nye spektroskopiske teknikker til at bestemme antiaromatisk destabilisering af cyclobutadien. I forhold til en hypotetisk stamme-mindre, konjugeret dienreference destabiliseres cyclobutadien med i alt 87 kcal/mol, hvoraf 32 kcal/mol kan tilskrives ringstamme og 55 kcal/mol til antiaromaticitet (sammenlignet med 21 kcal/mol til aromatisk stabilisering af bensene). - Unsubstitueret cyclopentadienyl kation, en grundstat triplet
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ‘ Neill, R. M. Hoffmann, C. Perchonock, E. Vasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
doi: 10.1021 / ja00790a049
cyclopentadienylkationen kan kun fremstilles med vanskeligheder, som dette papir beskriver. Når den først er dannet, har den en triplet elektronisk jordtilstand (med 2 uparrede elektroner) og kan karakteriseres ved EPR (elektronparamagnetisk resonans) spektroskopi. - Oksirener
Errol G. Leviars
kemiske anmeldelser 1983, 83 (5), 519-534
DOI: 10.1021/cr00057a002