periodiske tendenser og opløsningsmiddeleffekter i nukleofilicitet
der er forudsigelige periodiske tendenser i nukleofilicitet. Bevæger sig vandret over den anden række af tabellen, er tendensen i nukleofilicitet parallel med tendensen i basicitet:
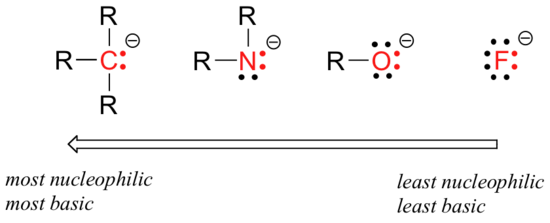
ræsonnementet bag den vandrette nukleofilicitetstendens er den samme som ræsonnementet bag basicitetstendensen: flere elektronegative elementer holder deres elektroner tættere og er mindre i stand til at donere dem for at danne en ny binding.
denne vandrette tendens fortæller os også, at aminer er mere nukleofile end alkoholer, selvom begge grupper ofte fungerer som nukleofiler i både laboratorie-og biokemiske reaktioner.
Husk at atomernes basicitet falder, når vi bevæger os lodret ned ad en kolonne på det periodiske bord: thioladioner er mindre basiske end f.eks. bromidioner, og bromidion er mindre basisk end chloridion, hvilket igen er mindre basisk end fluoridion. Husk også, at denne tendens kan forklares ved at overveje den stigende størrelse af ‘elektronskyen’ omkring de større ioner: elektrondensiteten, der er forbundet med den negative ladning, spredes omkring et større område, hvilket har tendens til at øge stabiliteten (og dermed reducere basiciteten).
den vertikale periodiske tendens for nukleofilicitet er noget mere kompliceret end den for basicitet: afhængigt af det opløsningsmiddel, som reaktionen finder sted i, kan nukleofilicitetstendensen gå i begge retninger. Lad os tage det enkle eksempel på SN2-reaktionen nedenfor:
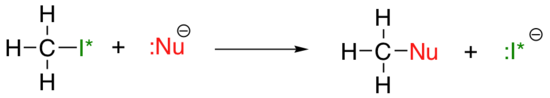
. . .hvor Nu – er en af halogenidionerne: fluor, chlorid, bromid eller iodid, og den forlader gruppe i* er en radioaktiv isotop af jod (som gør det muligt for os at skelne den forlader gruppe fra nukleofilen i det tilfælde, hvor begge er iodid). Hvis denne reaktion forekommer i et protisk opløsningsmiddel (det vil sige et opløsningsmiddel, der har et brint bundet til et ilt eller nitrogen – vand, methanol og ethanol er de vigtigste eksempler), vil reaktionen gå hurtigst, når iodid er nukleofilen, og langsomst, når fluor er nukleofilen, hvilket afspejler den relative styrke af nukleofilen.

relativ nukleofilicitet i et protisk opløsningsmiddel
Dette er naturligvis modsat den lodrette periodiske tendens for basicitet, hvor iodid er den mindst basale. Hvad foregår der her? Bør ikke den stærkere base med sine mere reaktive ubundne valenselektroner også være den stærkere nukleofil?
som nævnt ovenfor har det hele at gøre med opløsningsmidlet. Husk, vi taler nu om reaktionen, der kører i et protisk opløsningsmiddel som ethanol. Protiske opløsningsmiddelmolekyler danner meget stærke ion-dipol-interaktioner med den negativt ladede nukleofil, hvilket i det væsentlige skaber et ‘opløsningsmiddelbur’ omkring nukleofilen:

for at nukleofilen skal angribe elektrofilen, skal den i det mindste delvist bryde fri fra sit opløsningsmiddelbur. De ensomme parelektroner på den større, mindre basiske iodidion interagerer mindre tæt med protonerne på de protiske opløsningsmiddelmolekyler – således er iodidnukleofilen bedre i stand til at bryde fri fra sit opløsningsmiddelbur sammenlignet med den mindre, mere basiske fluoridion, hvis ensomme parelektroner er bundet tættere på burets protoner.
billedet ændres, hvis vi skifter til et polært aprotisk opløsningsmiddel, såsom acetone, hvor der er en molekylær dipol, men ingen hydrogener bundet til ilt eller nitrogen. Nu er fluor den bedste nukleofil, og iodid den svageste.
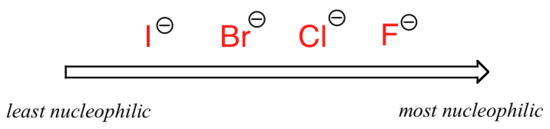
relativ nukleofilicitet i et polært aprotisk opløsningsmiddel nucleophile er meget svagere: den positive ende af opløsningsmidlets dipol er skjult i det indre af molekylet, og det er således afskærmet fra nukleofilens negative ladning.
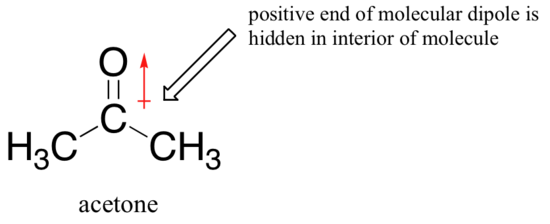
en svagere opløsningsmiddel-nukleofil interaktion betyder et svagere opløsningsmiddelbur for nukleofilen at bryde igennem, så opløsningsmiddeleffekten er meget mindre vigtig, og jo mere basisk fluoridion er også den bedre nukleofil.
hvorfor ikke bruge et fuldstændigt ikke-polært opløsningsmiddel, såsom heksan, til denne reaktion, så opløsningsmiddelburet elimineres fuldstændigt? Svaret på dette er simpelt – nukleofilen skal være i opløsning for at reagere med en mærkbar hastighed med elektrofilen, og et opløsningsmiddel som f.eks. Derfor bruger kemikere polære aprotiske opløsningsmidler til nukleofile substitutionsreaktioner i laboratoriet: de er polære nok til at solvere nukleofilen, men ikke så polære at låse den væk i et uigennemtrængeligt opløsningsmiddelbur. Ud over acetone er tre andre almindeligt anvendte polære aprotiske opløsningsmidler acetonitril, dimethylformamid (DMF) og dimethylsulfoksid (DMSO).
i biologisk kemi, hvor opløsningsmidlet er protisk (vand), er den vigtigste implikation af de periodiske tendenser i nukleofilicitet, at thioler er kraftigere nukleofiler end alkoholer. Thiolgruppen i en cysteinaminosyre er for eksempel en kraftig nukleofil og fungerer ofte som en nukleofil i ensymatiske reaktioner, og selvfølgelig er negativt ladede thiolater (RS -) endnu mere nukleofile. Dette er ikke at sige, at hydroksyl-grupperne på serin, threonin og tyrosin ikke også fungerer som nukleofiler – de gør det.