Video \(\Sideindeks{1}\): en kort introduktion til Mendeleevs geni.
da tidlige kemikere arbejdede for at rense malm og opdagede flere elementer, indså de, at forskellige elementer kunne grupperes sammen efter deres lignende kemiske opførsel. En sådan gruppering omfatter lithium (Li), natrium (Na) og kalium (K): Disse elementer er alle skinnende, leder varme og elektricitet godt og har lignende kemiske egenskaber. En anden gruppering inkluderer calcium (Ca), strontium (Sr) og barium (Ba), som også er skinnende, gode ledere af varme og elektricitet og har kemiske egenskaber til fælles. Imidlertid er de specifikke egenskaber ved disse to grupperinger især forskellige fra hinanden. For eksempel: Li, Na og K er meget mere reaktive end Ca, Sr og Ba; Li, Na og K danner forbindelser med ilt i et forhold på to af deres atomer til et iltatom, hvorimod Ca, Sr og Ba danner forbindelser med et af deres atomer til et iltatom. Fluor (F), chlor (Cl), brom (Br) og jod (i) udviser også lignende egenskaber til hinanden, men disse egenskaber er drastisk forskellige fra dem af nogen af elementerne ovenfor.
Dimitri Mendeleev i Rusland (1869) og Lothar Meyer i Tyskland (1870) erkendte uafhængigt, at der var et periodisk forhold mellem egenskaberne af de elementer, der var kendt på det tidspunkt. Begge offentliggjorte tabeller med elementerne arrangeret efter stigende atommasse. Men Mendeleev gik et skridt videre end Meyer: han brugte sit bord til at forudsige eksistensen af elementer, der ville have egenskaberne svarende til aluminium og silicium, men endnu ikke var kendt. Opdagelserne af gallium (1875) og germanium (1886) gav stor støtte til Mendeleevs arbejde. Selvom Mendeleev og Meyer havde en lang tvist om prioritet, er Mendeleevs Bidrag til udviklingen af det periodiske system nu mere bredt anerkendt (figur \(\Sideindeks{1}\)).
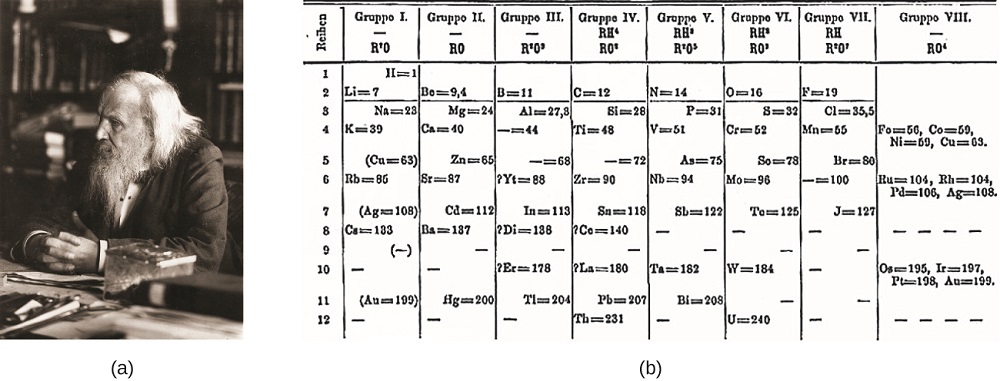
figur \(\Sideindeks{1}\): (a) Dimitri Mendeleev er bredt krediteret med at skabe (b) den første periodiske tabel over elementerne. (credit a: ændring af arbejde af Serge Lachinov; credit b: ændring af arbejde af “den fj larttrade ankan”/Commons)
Video \(\Sideindeks{2}\): En introduktion til organiseringen af det periodiske system i perioder og grupper. Denne organisation vil være vigtig, da vi fortsætter med at bygge videre på principperne om kemi.
i det tyvende århundrede blev det tydeligt, at det periodiske forhold involverede atomnumre snarere end atommasser. Den moderne erklæring om dette forhold, den periodiske lov, er som følger: elementernes egenskaber er periodiske funktioner af deres atomnumre. Et moderne periodisk system arrangerer elementerne i stigende rækkefølge af deres atomnumre og grupperer atomer med lignende egenskaber i den samme lodrette søjle (figur \(\Sideindeks{2}\)). Hver boks repræsenterer et element og indeholder dets atomnummer, symbol, gennemsnitlige atommasse og (undertiden) navn. Elementerne er arrangeret i syv vandrette rækker, kaldet perioder eller serier, og 18 lodrette kolonner, kaldet grupper. Grupper er mærket øverst i hver kolonne. I USA var etiketterne traditionelt tal med store bogstaver. IUPAC anbefaler dog, at tallene 1 til 18 bruges, og disse etiketter er mere almindelige. For at tabellen skal passe på en enkelt side, skrives dele af to af rækkerne, i alt 14 kolonner, normalt under bordets hoveddel.

figur \(\Sideindeks{2}\): elementer i det periodiske system er organiseret efter deres egenskaber.
mange elementer adskiller sig dramatisk i deres kemiske og fysiske egenskaber, men nogle elementer er ens i deres adfærd. For eksempel ser mange elementer skinnende ud, er formbare (kan deformeres uden at gå i stykker) og duktile (kan trækkes ind i ledninger) og leder varme og elektricitet godt. Andre elementer er ikke skinnende, formbare eller duktile og er dårlige ledere af varme og elektricitet. Vi kan sortere elementerne i store klasser med fælles egenskaber: metaller (elementer, der er skinnende, formbare, gode ledere af varme og elektricitet—skyggefuld gul); ikke-metaller (elementer, der ser kedelige ud, dårlige ledere af varme og elektricitet—skyggefuld grøn); og metalloider (elementer, der udfører varme og elektricitet moderat godt, og besidder nogle egenskaber af metaller og nogle egenskaber af ikke—metaller-skyggefulde lilla).
elementerne kan også klassificeres i hovedgruppeelementerne (eller repræsentative elementer) i kolonnerne mærket 1, 2 og 13-18; overgangsmetallerne i kolonnerne mærket 3-12; og indre overgangsmetaller i de to rækker nederst i tabellen (elementerne i øverste række kaldes lanthanider, og elementerne i nederste række er actinider; figur \(\Sideindeks{3}\)). Elementerne kan opdeles yderligere ved mere specifikke egenskaber, såsom sammensætningen af de forbindelser, de danner. For eksempel danner elementerne i gruppe 1 (Den første kolonne) forbindelser, der består af et atom af elementet og et atom af hydrogen. Disse elementer (undtagen hydrogen) er kendt som alkalimetaller, og de har alle lignende kemiske egenskaber. Elementerne i gruppe 2 (den anden kolonne) danner forbindelser bestående af et atom af elementet og to atomer af hydrogen: disse kaldes jordalkalimetaller med lignende egenskaber blandt medlemmer af denne gruppe. Andre grupper med specifikke navne er pnictogener (gruppe 15), chalcogener (gruppe 16), halogener (gruppe 17) og ædelgasser (gruppe 18, også kendt som inerte gasser). Grupperne kan også henvises til af det første element i gruppen: for eksempel kan chalcogener kaldes iltgruppen eller iltfamilien. Hydrogen er et unikt, ikke-metallisk element med egenskaber svarende til både gruppe 1 og gruppe 17 elementer. Af den grund kan brint vises øverst i begge grupper eller i sig selv.
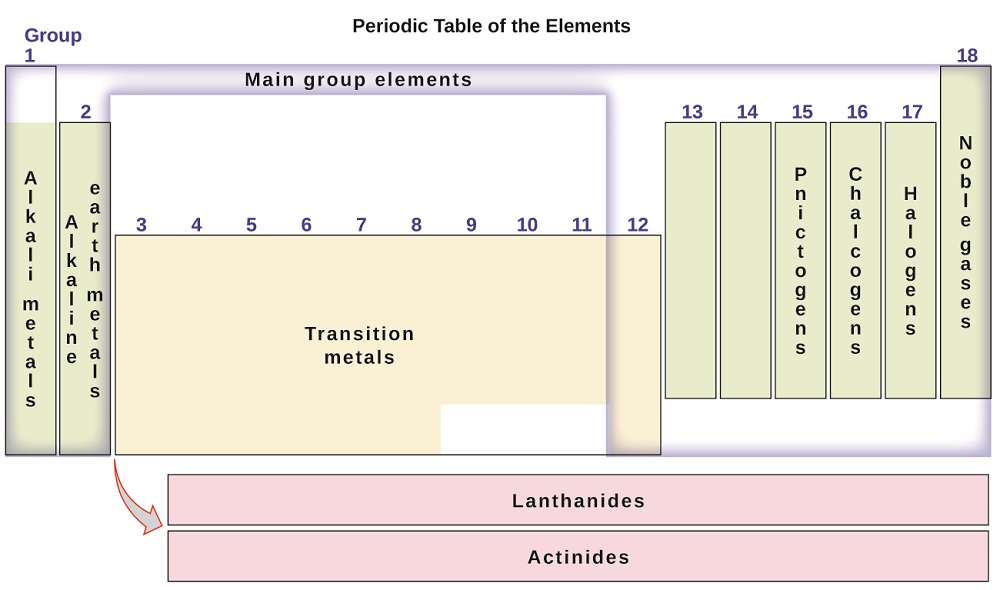
figur \(\Sideindeks{3}\): det periodiske system organiserer elementer med lignende egenskaber i grupper.
eksempel \(\Sideindeks{1}\): navngivning af grupper af elementer
atomer af hvert af følgende elementer er afgørende for livet. Giv gruppenavnet for følgende elementer:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selen
- barium
- lithium
svar a
ædelgas
svar b
chalcogen
svar c
jordalkalimetal
svar d
alkalimetal
ved at studere det periodiske system har du måske bemærket noget om atommasserne i nogle af elementerne. Element 43 (technetium), element 61 (promethium) og de fleste af elementerne med atomnummer 84 (polonium) og højere har deres atommasse angivet i firkantede parenteser. Dette gøres for elementer, der udelukkende består af ustabile, radioaktive isotoper (du vil lære mere om radioaktivitet i kapitlet om nuklear Kemi). En gennemsnitlig atomvægt kan ikke bestemmes for disse elementer, fordi deres radioisotoper kan variere betydeligt i relativ overflod afhængigt af kilden eller måske ikke engang findes i naturen. Tallet i firkantede parenteser er atommassenummeret (og den omtrentlige atommasse) for den mest stabile isotop af dette element.
Resume
Video \(\Sideindeks{3}\): En oversigt over opdagelsen Og egenskaberne af det periodiske system.
opdagelsen af den periodiske gentagelse af lignende egenskaber blandt elementerne førte til formuleringen af det periodiske system, hvor elementerne er arrangeret i rækkefølge efter stigende atomnummer i rækker kendt som perioder og kolonner kendt som grupper. Elementer i samme gruppe i det periodiske system har lignende kemiske egenskaber. Elementer kan klassificeres som metaller, metalloider og ikke-metaller eller som hovedgruppeelementer, overgangsmetaller og indre overgangsmetaller. Grupper er nummereret 1-18 fra venstre mod højre. Elementerne i gruppe 1 er kendt som alkalimetallerne; dem i gruppe 2 er jordalkalimetallerne; dem i 15 er pnictogener; dem i 16 er chalcogener; dem i 17 er halogener; og dem i 18 er ædelgasserne.