læringsmål
Ved udgangen af dette afsnit vil du være i stand til:
- Forklar forholdet mellem mikroskopiske og makroskopiske mængder i en gas
- Løs problemer, der involverer blandinger af gasser
- Løs problemer, der involverer afstanden og tiden mellem et gasmolekyls kollisioner
Vi har undersøgt tryk og temperatur baseret på deres makroskopiske definitioner. Tryk er kraften divideret med det område, hvor kraften udøves, og temperaturen måles med et termometer. Vi kan få en bedre forståelse af tryk og temperatur fra den kinetiske teori om gasser, teorien, der relaterer gassernes makroskopiske egenskaber til bevægelsen af de molekyler, de består af. For det første gør vi to antagelser om molekyler i en ideel gas.
- Der er et meget stort antal n molekyler, alle identiske og hver med masse m.molekylerne adlyder Nytons love og er i kontinuerlig bevægelse, hvilket er tilfældigt og isotrop, det vil sige det samme i alle retninger.
for at udlede den ideelle gaslov og forbindelsen mellem mikroskopiske mængder, såsom energien i et typisk molekyle og makroskopiske mængder, såsom temperatur, analyserer vi en prøve af en ideel gas i en stiv beholder, som vi laver to yderligere antagelser om:
- molekylerne er meget mindre end den gennemsnitlige afstand mellem dem, så deres samlede volumen er meget mindre end deres beholder (som har volumen V). Med andre ord tager vi varevognen konstant B, volumenet af en mol gasmolekyler, for at være ubetydelig sammenlignet med volumenet af en mol gas i beholderen.
- molekylerne gør perfekt elastiske kollisioner med beholderens vægge og med hinanden. Andre kræfter på dem, herunder tyngdekraften og attraktionerne repræsenteret af Van Der Vaals konstant A, er ubetydelige (som det er nødvendigt for antagelsen om isotropi).
kollisionerne mellem molekyler forekommer ikke i afledningen af den ideelle gaslov. De forstyrrer heller ikke afledningen, da kollisioner mellem molekyler, der bevæger sig med tilfældige hastigheder, giver nye tilfældige hastigheder. Desuden, hvis hastighederne for gasmolekyler i en beholder oprindeligt ikke er tilfældige og isotrope, er molekylære kollisioner det, der gør dem tilfældige og isotrope.
vi gør endnu flere antagelser, der forenkler beregningerne, men påvirker ikke resultatet. Først lader vi beholderen være en rektangulær kasse. For det andet begynder vi med at overveje monatomiske gasser, dem, hvis molekyler består af enkeltatomer, såsom helium. Derefter kan vi antage, at atomerne ikke har nogen energi undtagen deres translationelle kinetiske energi; for eksempel har de hverken rotations-eller vibrationsenergi. (Senere diskuterer vi gyldigheden af denne antagelse for ægte monatomiske gasser og undgår det at overveje diatomiske og polyatomiske gasser.
figur \(\Sideindeks{1}\) viser en kollision af et gasmolekyle med en beholders væg, så det udøver en kraft på væggen (ved Nytons tredje lov). Disse kollisioner er kilden til tryk i en gas. Når antallet af molekyler stiger, øges antallet af kollisioner og dermed trykket. Tilsvarende, hvis molekylernes gennemsnitshastighed er højere, er gastrykket højere.
i en prøve af gas i en beholder forårsager tilfældigheden af molekylær bevægelse antallet af kollisioner af molekyler med en hvilken som helst del af væggen i en given tid til at svinge. Men fordi et stort antal molekyler kolliderer med væggen på kort tid, svinger antallet af kollisioner på skalaen af tid og rum, vi måler, kun med en lille, normalt ikke observerbar fraktion fra gennemsnittet. Vi kan sammenligne denne situation med et casino, hvor resultaterne af væddemålene er tilfældige, og kasinoets optagelser svinger i minuttet og timen. Men over lange tider som et år er kasinoets indtægter meget tæt på de forventede gennemsnit fra oddsene. En tank af gas har enormt flere molekyler end et kasino har vædder i et år, og molekylerne gøre enormt flere kollisioner i en anden end et kasino har indsatser.
en beregning af den gennemsnitlige kraft, der udøves af molekyler på kassens vægge, fører os til den ideelle gaslov og til forbindelsen mellem temperatur og molekylær kinetisk energi. (Faktisk vil vi tage to gennemsnit: en over tid for at få den gennemsnitlige kraft, der udøves af et molekyle med en given hastighed, og derefter et andet gennemsnit over molekyler med forskellige hastigheder.) Denne tilgang blev udviklet af Daniel Bernoulli (1700-1782), der er bedst kendt i fysik for sit arbejde med væskestrøm (hydrodynamik). Bemærkelsesværdigt gjorde Bernoulli dette arbejde, før Dalton etablerede synspunktet om stof som bestående af atomer.
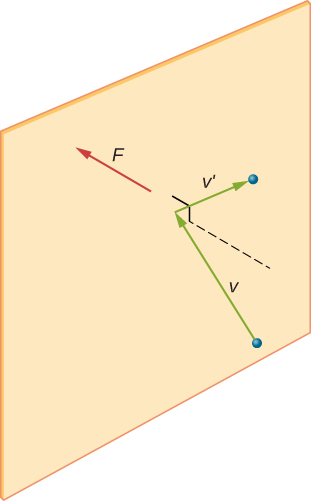
figur \(\Sideindeks{2}\) viser en beholder fuld af gas og et udvidet billede af en elastisk kollision af et gasmolekyle med en væg af beholderen, opdelt i komponenter. Vi har antaget, at et molekyle er lille sammenlignet med adskillelsen af molekyler i gassen, og at dets interaktion med andre molekyler kan ignoreres. Under disse forhold er den ideelle gaslov eksperimentelt gyldig. Fordi vi også har antaget, at væggen er stiv, og partiklerne er punkter, er kollisionen elastisk (ved bevarelse af energi—der er ingen steder for en partikels kinetiske energi at gå). Derfor forbliver molekylets kinetiske energi konstant, og dermed forbliver dens hastighed og størrelsen af dens momentum også konstant. Denne antagelse er ikke altid gyldig, men resultaterne i resten af dette modul opnås også i modeller, der lader molekylerne udveksle energi og momentum med væggen.
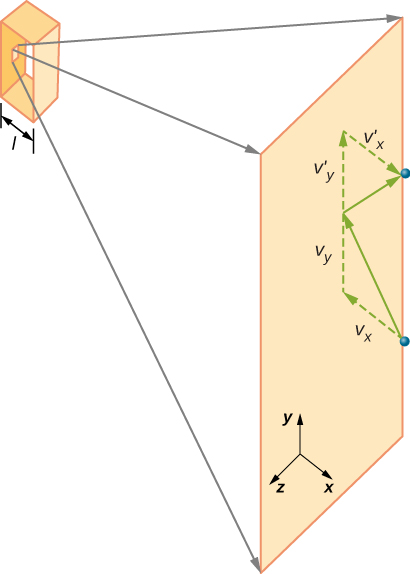
Hvis molekylets hastighed ændres i retning, ændres dens momentum fra \(- m_h\) til \(+mv_h\). Således er dens ændring i momentum \(\Delta mv = + mv_h – (- mv_h) = 2mv_h\). I henhold til impulsmomentets sætning, der er givet i kapitlet om lineær momentum og kollisioner, er den kraft, der udøves på Ith-molekylet, hvor jeg mærker molekylerne fra 1 til N, givet af \
(i denne ligning alene repræsenterer p momentum, ikke tryk.) Der er ingen kraft mellem væggen og molekylet undtagen mens molekylet rører væggen. I løbet af kollisionens korte tid er kraften mellem molekylet og væggen relativt stor, men det er ikke den kraft, vi leder efter. Vi leder efter den gennemsnitlige kraft, så vi tager \(\Delta t\) for at være den gennemsnitlige tid mellem kollisioner af det givne molekyle med denne væg, hvilket er den tid, hvor vi forventer at finde en kollision. Lad l repræsentere længden af kassen i h-retning. Så er \(\Delta t\) den tid molekylet ville tage for at gå over boksen og tilbage, en afstand 2l, med en hastighed på \(v_h\). Således \(\delta t = 2L/v_h\), og udtrykket for kraften bliver
\
denne kraft skyldes et molekyle. For at finde den samlede kraft på væggen, F, skal vi tilføje bidragene fra alle n molekyler:
\
Vi bruger nu definitionen af gennemsnittet, som vi betegner med en bar, for at finde kraften:
\
Vi vil have kraften med hensyn til hastigheden v, snarere end h-komponenten af hastigheden. Bemærk, at den samlede hastighed kvadreret er summen af kvadraterne af dens komponenter, således at
\
med antagelsen om isotropi er de tre gennemsnit på højre side ens, så
\
at erstatte dette i udtrykket for F giver
\
trykket er F/A, så vi opnår
\ hvor vi brugte \(V = Al\) til lydstyrken. Dette giver det vigtige resultat
\
Ved at kombinere denne ligning med \(pV = Nk_BT\) giver
\
Vi kan få den gennemsnitlige kinetiske energi af et molekyle, \(\frac{1}{2}m\overline{v}^2\), fra venstre side af ligningen ved at dividere N og multiplicere med 3/2.
gennemsnitlig kinetisk energi pr.molekyle
den gennemsnitlige kinetiske energi af et molekyle er direkte proportional med dets absolutte temperatur:
\
ligningen \(\overline{K} = \frac{3}{2} k_BT\) er den gennemsnitlige kinetiske energi pr. molekyle. Bemærk især, at intet i denne ligning afhænger af gasens molekylmasse (eller enhver anden egenskab), trykket eller andet end temperaturen. Hvis prøver af helium og ksenongas med meget forskellige molekylmasser har samme temperatur, har molekylerne den samme gennemsnitlige kinetiske energi.
den indre energi i et termodynamisk system er summen af de mekaniske energier af alle molekylerne i det. Vi kan nu give en ligning for den indre energi af en monatomisk ideel gas. I en sådan gas er molekylernes eneste energi deres translationelle kinetiske energi. Derfor betegner vi den interne energi med \(e_{int}\) vi har simpelthen \(e_{int} = N\overline{K}\) eller
\
ofte vil vi gerne bruge denne ligning i form af mol:
\
Vi kan løse \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_bt\) for en typisk hastighed af et molekyle i en ideel gas med hensyn til temperatur for at bestemme, hvad der er kendt som rod-middel-kvadrat (RMS) hastighed af et molekyle.
RMS-hastighed for et molekyle
et molekyls rod-middel-kvadrat (rms) hastighed eller kvadratroden af gennemsnittet af kvadratet af hastigheden \(\overline{v}^2\), er
\
rms-hastigheden er ikke gennemsnittet eller den mest sandsynlige hastighed for molekyler, som vi vil se i fordelingen af Molekylhastigheder, men det giver et let beregnet skøn over molekylernes hastighed, der er den mest sandsynlige hastighed for relateret til deres kinetiske energi. Igen kan vi skrive denne ligning med hensyn til gaskonstanten R og den molære masse M i kg / mol:
\
vi afviger et øjeblik for at besvare et spørgsmål, der kan have fundet sted for dig: når vi anvender modellen på atomer i stedet for teoretiske punktpartikler, ændrer roterende kinetisk energi vores resultater? For at besvare dette spørgsmål skal vi appellere til kvantemekanik. I kvantemekanik kan roterende kinetisk energi ikke påtage sig nogen værdi; det er begrænset til et diskret sæt værdier, og den mindste værdi er omvendt proportional med rotationsinertien. Et atoms roterende inerti er lille, fordi næsten hele dets masse er i kernen, som typisk har en radius mindre end \(10^{-14} m\). Således er et atoms minimale rotationsenergi meget mere end \(\frac{1}{2}k_BT\) for enhver opnåelig temperatur, og den tilgængelige energi er ikke nok til at få et atom til at rotere. Vi vender tilbage til dette punkt, når vi diskuterer diatomiske og polyatomiske gasser i næste afsnit.
eksempel \(\Sideindeks{1}\): Beregning af kinetisk energi og hastighed for et gasmolekyle
- hvad er den gennemsnitlige kinetiske energi for et gasmolekyle ved \(20,0^oC\) (stuetemperatur)?
- Find RMS-hastigheden for et nitrogenmolekyle (\(N_2\)) ved denne temperatur.
strategi
(A) den kendte i ligningen for den gennemsnitlige kinetiske energi er temperaturen:
\
før vi erstatter værdier i denne ligning, skal vi konvertere den givne temperatur til kelvin: \(T = (20,0 + 273)\, K = 293 \, K\). Vi kan finde RMS-hastigheden for et nitrogenmolekyle ved hjælp af ligningen
\
men vi skal først finde massen af et nitrogenmolekyle. Opnåelse af den molære masse af nitrogen \(N_2\) fra det periodiske system finder vi
\
opløsning
- temperaturen alene er tilstrækkelig til, at vi finder den gennemsnitlige translationelle kinetiske energi. At erstatte temperaturen i den translationelle kinetiske energiligning giver \
- at erstatte denne masse og værdien for \(k_B\) i ligningen for \(v_{RMS}\) giver \
betydning
Bemærk, at molekylets gennemsnitlige kinetiske energi er uafhængig af typen af molekyle. Den gennemsnitlige translationelle kinetiske energi afhænger kun af absolut temperatur. Den kinetiske energi er meget lille sammenlignet med makroskopiske energier, så vi ikke føler, når et luftmolekyle rammer vores hud. På den anden side er det meget større end den typiske forskel i gravitationspotentiel energi, når et molekyle bevæger sig fra, siger toppen til bunden af et rum, så vores forsømmelse af gravitation er berettiget i typiske virkelige situationer. Nitrogenmolekylets RMS-hastighed er overraskende stor. Disse store molekylhastigheder giver ikke makroskopisk bevægelse af luft, da molekylerne bevæger sig i alle retninger med lige sandsynlighed. Den gennemsnitlige frie vej (afstanden et molekyle bevæger sig i gennemsnit mellem kollisioner, diskuteret lidt senere i dette afsnit) af molekyler i luft er meget lille, så molekylerne bevæger sig hurtigt, men kommer ikke meget langt om et sekund. Den høje værdi for RMS-hastighed afspejles i lydens hastighed, som er omkring 340 m/s ved stuetemperatur. Jo højere RMS-hastighed af luftmolekyler, jo hurtigere lydvibrationer kan overføres gennem luften. Lydens hastighed stiger med temperaturen og er større i gasser med små molekylmasser, såsom helium (se figur \(\Sideindeks{3}\)).
eksempel \(\Sideindeks{2}\): Beregning af temperatur: flugthastighed for heliumatomer
for at undslippe Jordens tyngdekraft skal et objekt nær toppen af atmosfæren (i en højde af 100 km) rejse væk fra jorden med 11,1 km / s. denne hastighed kaldes flugthastigheden. Ved hvilken temperatur ville heliumatomer have en RMS-hastighed svarende til flugthastigheden?
strategi
Identificer de kendte og ukendte og bestem hvilke ligninger der skal bruges til at løse problemet.
løsning
- Identificer de kendte: v er flugthastigheden, 11,1 km/s.
- Identificer de ukendte: vi skal løse for temperatur, T. vi skal også løse for massen m af heliumatomet.
- Bestem hvilke ligninger der er behov for.
- for at få massen m af heliumatomet kan vi bruge information fra det periodiske system: \
- for at løse for temperatur T kan vi omarrangere \ for at give \
- erstatte de kendte værdier i ligningerne og løse for de ukendte, \ og \
betydning
denne temperatur er meget højere end atmosfærisk temperatur, hvilket er cirka 250 K (\(-25^oC\) eller \(-10^of\)) ved høj højde. Meget få heliumatomer er tilbage i atmosfæren, men mange var til stede, da atmosfæren blev dannet, og flere skabes altid ved radioaktivt henfald (se kapitlet om atomfysik). Årsagen til tabet af heliumatomer er, at et lille antal heliumatomer har hastigheder højere end Jordens flugthastighed selv ved normale temperaturer. Hastigheden af et heliumatom ændres fra en kollision til den næste, så der på ethvert øjeblik er en lille, men ikke-nul chance for, at atomets hastighed er større end flugthastigheden. Chancen er høj nok til, at næsten alle heliumatomer, der har været i atmosfæren, i løbet af Jordens levetid har nået flugthastighed i store højder og undslap fra Jordens tyngdekraft. Tungere molekyler, såsom ilt, nitrogen og vand, har mindre RMS-hastigheder, og det er derfor meget mindre sandsynligt, at nogen af dem vil have hastigheder, der er større end flugthastigheden. Faktisk er sandsynligheden så lille, at milliarder af år er forpligtet til at miste betydelige mængder tungere molekyler fra atmosfæren. Figur \(\Sideindeks{4}\) viser effekten af manglende atmosfære på Månen. Fordi Månens tyngdekraft er meget svagere, har den mistet næsten hele sin atmosfære. Atmosfærerne på jorden og andre kroppe sammenlignes i dette kapitels øvelser.

øvelse \(\Sideindeks{2}\)
Hvis du overvejer en meget lille genstand, såsom et pollenkorn, i en gas, ville antallet af molekyler, der rammer dens overflade, også være relativt lille. Ville du forvente, at pollenkornet oplever udsving i tryk på grund af statistiske udsving i antallet af gasmolekyler, der rammer det i en given tid?
svar
Ja. Sådanne udsving forekommer faktisk for et legeme af enhver størrelse i en gas, men da antallet af molekyler er enormt for makroskopiske legemer, er svingningerne en lille procentdel af antallet af kollisioner, og De gennemsnit, der tales om i dette afsnit, varierer umærkeligt. Groft sagt er udsvingene omvendt proportional med kvadratroden af antallet af kollisioner, så for små kroppe kan de blive betydelige. Dette blev faktisk observeret i det nittende århundrede for pollenkorn i vand og er kendt som brunisk bevægelse.
damptryk, partialtryk og Daltons lov
det tryk, en gas ville skabe, hvis den besatte det samlede tilgængelige volumen, kaldes gasens partialtryk. Hvis to eller flere gasser blandes, vil de komme til termisk ligevægt som følge af kollisioner mellem molekyler; processen er analog med varmeledning som beskrevet i kapitlet om temperatur og varme. Som vi har set fra kinetisk teori, når gasserne har den samme temperatur, har deres molekyler den samme gennemsnitlige kinetiske energi. Således overholder hver gas den ideelle gaslov separat og udøver det samme tryk på væggene i en beholder, som den ville, hvis den var alene. Derfor er det samlede tryk i en blanding af gasser summen af deltryk af komponentgasserne under forudsætning af ideel gasadfærd og ingen kemiske reaktioner mellem komponenterne. Denne lov er kendt som Daltons lov om delvis pres, efter den engelske videnskabsmand John Dalton (1766-1844), der foreslog den. Daltons lov er i overensstemmelse med det faktum, at pres tilføjer i henhold til Pascals princip.
i en blanding af ideelle gasser i termisk ligevægt er antallet af molekyler af hver gas proportional med dets partialtryk. Dette resultat følger af at anvende den ideelle gaslov på hver i formularen \(p / n = RT / V\). Fordi højre side er den samme for enhver gas ved en given temperatur i en beholder med et givet volumen, er venstre side også den samme.
- partialtryk er det tryk, en gas ville skabe, hvis den eksisterede alene.
- Daltons lov siger, at det samlede tryk er summen af partialtrykket af alle de tilstedeværende gasser.
- for to gasser (mærket 1 og 2) i ligevægt i en beholder, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
en vigtig anvendelse af partialtryk er, at det i kemi fungerer som koncentrationen af en gas til bestemmelse af reaktionshastigheden. Her nævner vi kun, at partialtrykket af ilt i en persons lunger er afgørende for liv og sundhed. Åndedrætsluft, der har et partielt ilttryk under 0,16 atm, kan forringe koordination og dømmekraft, især hos mennesker, der ikke er akklimatiseret til en høj højde. Lavere deltryk på \(O_2\) har mere alvorlige virkninger; deltryk under 0,06 atm kan hurtigt være dødelig, og permanent skade er sandsynligvis, selvom personen reddes. Men følelsen af at skulle trække vejret, som når man holder vejret, skyldes meget mere af høje koncentrationer af kulsyre i blodet end ved lave koncentrationer af ilt. Således, hvis et lille rum eller skab er fyldt med luft med en lav koncentration af ilt, måske fordi en lækker cylinder af en komprimeret gas opbevares der, vil en person ikke føle nogen “kvælende” fornemmelse og kan gå i kramper eller miste bevidstheden uden at bemærke noget galt. Sikkerhedsingeniører lægger stor vægt på denne fare.
en anden vigtig anvendelse af partialtryk er damptryk, som er partialtrykket af en damp, hvor den er i ligevægt med væsken (eller fast, i tilfælde af sublimering) fase af det samme stof. Ved enhver temperatur kan partialtrykket af vandet i luften ikke overstige vandets damptryk ved den temperatur, fordi når partialtrykket når damptrykket, kondenserer vand ud af luften. Dug er et eksempel på denne kondens. Den temperatur, ved hvilken der opstår kondens for en prøve af luft, kaldes dugpunktet. Det måles let ved langsomt at afkøle en metalkugle; dugpunktet er den temperatur, hvor kondens først vises på kuglen.
damptrykket af vand ved nogle temperaturer af interesse for meteorologi er angivet i tabel\(\Sideindeks{1}\).
| T(\(^oC\)) | damptryk (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) ved en temperatur T er defineret af
\
en relativ fugtighed på \(100\%\) betyder, at partialtrykket af vand er lig med damptrykket; med andre ord er luften mættet med vand.
eksempel \(\Sideindeks{3}\): Beregning af relativ fugtighed
Hvad er den relative fugtighed, når lufttemperaturen er \(25^oC\) og dugpunktet er \(15^oC\)?
strategi
Vi slår simpelthen damptrykket op ved den givne temperatur og det ved dugpunktet og finder forholdet.
løsning
\
Betydning
R. H. er vigtig for vores komfort. Værdien af \(53,8\%\) ligger inden for området \(40\%\) til \(60\%\) anbefales til komfort indendørs.
som nævnt i kapitlet om temperatur og varme falder temperaturen sjældent under dugpunktet, fordi når det når dugpunktet eller frostpunktet, kondenserer vand og frigiver en relativt stor mængde latent fordampningsvarme.
gennemsnitlig fri sti og gennemsnitlig fritid
vi overvejer nu kollisioner eksplicit. Det sædvanlige første skridt (som er alt, hvad vi tager) er at beregne den gennemsnitlige frie vej, \(\lambda\), den gennemsnitlige afstand et molekyle bevæger sig mellem kollisioner med andre molekyler og den gennemsnitlige fritid \(\tau\), den gennemsnitlige tid mellem kollisionerne af et molekyle. Hvis vi antager, at alle molekylerne er kugler med en radius \(r\), kolliderer et molekyle med et andet, hvis deres Centre er inden for en afstand 2R af hinanden. For en given partikel siger vi, at området af en cirkel med den radius, \(4\pi r^2\), er “tværsnittet” for kollisioner. Når partiklen bevæger sig, sporer den en cylinder med det tværsnitsareal. Den gennemsnitlige frie vej er længden \(\lambda\) således at det forventede antal andre molekyler i en cylinder med længde \(\lambda\) og tværsnit \(4\pi r^2\) er 1. Hvis vi midlertidigt ignorerer bevægelsen af andre molekyler end den, vi ser på, er det forventede tal antallet af molekyler, N / V, gange volumenet, og volumenet er \(4 \ pi r^2\ lambda\), så vi har \((N/V)4 \ pi r^2\ lambda = 1\) eller
\
under hensyntagen til bevægelsen af alle molekylerne gør beregningen meget sværere, men den eneste ændring er en faktor på\( \ }\). Resultatet er
\
i en ideel gas kan vi erstatte \(V/N = k_BT/p\) for at opnå
\
den gennemsnitlige fritid \(\tau\) er simpelthen den gennemsnitlige frie sti divideret med en typisk hastighed, og det sædvanlige valg er rms-hastigheden. Derefter
\
beregning af gennemsnitlig fritid
Find den gennemsnitlige fritid for argonatomer (\(M = 39,9 \, g/mol\)) ved en temperatur på \(0^oC\) og et tryk på 1,00 atm. Tag radius af et argonatom til at være \(1,70\gange 10^{-10}\mellemrum m\).
løsning
- Identificer de kendte og konverter til SI-enheder. Vi ved, at molmassen er 0.0399 kg/mol, temperaturen er 273 K, trykket er \(1,01 \gange 10^5 \, Pa\), og radius er \(1,70 \gange 10^{-10} \, m\).
- Find RMS-hastigheden: \(v_{rms} = \ frac {3RT}{M}} = 413\, m/s\).
- erstatning i ligningen for den gennemsnitlige fritid: \
betydning
Vi kan næppe sammenligne dette resultat med vores intuition om gasmolekyler, men det giver os et billede af molekyler, der kolliderer med ekstremt høj frekvens.
øvelse \(\Sideindeks{4}\)
som har en længere gennemsnitlig fri vej, flydende vand eller vanddamp i luften?
svar
i en væske er molekylerne meget tæt sammen og kolliderer konstant med hinanden. For at en gas skal være næsten ideel, da luft er under almindelige forhold, skal molekylerne være meget langt fra hinanden. Derfor er den gennemsnitlige frie vej meget længere i luften.
bidragydere og tilskrivninger
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) og Bill Moebs med mange bidragende forfattere. Dette værk er licenseret af
under en Creative Commons Attribution License (af 4.0).