molekylære orbitaler af en allylisk Carbocation
stabiliteten af carbocation af propen skyldes et konjugeret karruselelektronsystem. En “dobbeltbinding” eksisterer ikke rigtig. I stedet, det er en gruppe af 3 tilstødende, overlappende, ikke-hybridiserede p-orbitaler, vi kalder et konjugeret kursistelektronsystem. Du kan tydeligt se interaktionerne mellem alle tre af p-orbitalerne fra de tre carbonatomer, hvilket resulterer i en virkelig stabil kation. Det hele kommer ned til, hvor placeringen af det elektronmangel kulstof er.
molekylære orbitalbeskrivelser kan forklare allylisk stabilitet på endnu en måde ved hjælp af 2-propenyl. Fig.6
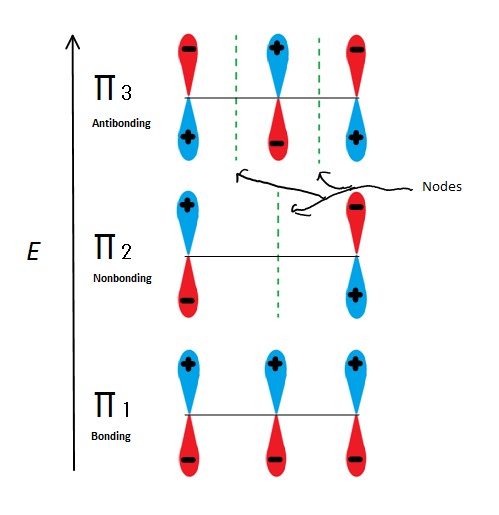
Fig.6 viser de 3 mulige molekylære orbitaler af 2-propenyl
hvis vi bare tager den primære molekylære orbital og ikke nogen af s, får vi tre af dem. prit1 binder uden noder, prit2 er ikke-bindende (med andre ord den samme energi som en almindelig p-orbital) med en knude, og prit3 er antibonding med 2 noder (ingen af orbitalerne interagerer). De to første elektroner vil gå ind i den molekylære orbital, uanset om det er en kation, radikal eller anion. Hvis det er en radikal eller anion, går den næste elektron ind i den molekylære orbital i LR2. Den sidste anionelektron går også ind i den ikke-bindende orbital. Så uanset hvilken slags kulstofcenter der findes, vil ingen elektron nogensinde gå ind i antibonding orbital.
Bindingsorbitalerne er de laveste energiorbitaler og er gunstige, hvorfor de først fyldes. Selvom de ikke-bindende orbitaler kan fyldes, er systemets samlede energi stadig lavere og mere stabil på grund af de fyldte bindingsmolekylære orbitaler.
dette tal viser også, at lus2 er den eneste molekylære orbital, hvor elektrionen adskiller sig, og det er også hvor en enkelt knude passerer gennem midten. På grund af dette er ladningerne af molekylet hovedsageligt på de to terminale carbonatomer og ikke det midterste carbon.
denne molekylære orbitalbeskrivelse kan også illustrere stabiliteten af allyliske carboncentre i figur 7.
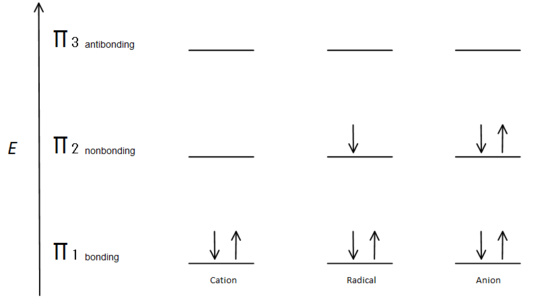
Fig.7 diagram, der viser, hvordan elektronerne fyldes ud fra Aufbau-princippet.
den prisbindende orbital er lavere i energi end den ikke-bindende p-orbital. Da hvert vist kulstofcenter har to elektroner i den lavere energi, der binder kur-orbitaler, sænkes energien i hvert system samlet (og dermed mere stabilt), uanset kation, radikal eller anion.