Ziprasidon oproti Olanzapinu v přibývání na váze spojené s léčbou schizofrenie: šestiměsíční dvojitě zaslepené randomizované paralelní skupinová studie,
Enric Álvarez*; Miguel Bernardo**; José Ramón Gutiérrez Casares***; Ángel L Montejo****
* Oddělení Psychiatrie. Nemocnice de La Santa Creu i Sant Pau. CIBERSAM, Universitat Autónoma de Barcelona, IBSantpau Barcelona. Španělsko
* * oddělení psychiatrie, Hospital Clinic de Barcelona, CIBERSAM, University of Barcelona, IDIBAPS, Barcelona. Španělsko
* * * Univerzitní nemocniční komplex Badajoz. Extremadura Health Service, Badajoz. Španělsko
* * * * Fakultní nemocnice v Salamance. Lékařská fakulta, Univerzita v Salamance, Salamanca. Španělsko
tato studie byla financována společností Pfizer.
korespondence
abstrakt
pozadí a cíle: Předchozí údaje z bezpečnostní analýzy naznačují, že olanzapin může vést k podstatnému zvýšení tělesné hmotnosti, zatímco u ziprasidonu nebyla pozorována žádná změna. Obezita může být hrozbou pro zdraví a způsobit, že subjekty přestanou antipsychotické léky. Dále zhodnotit diferenciální účinky a olanzapin, ziprasidon na váze, studie byla provedena s tělesné hmotnosti jako primární endpoint účinnosti.
metody: Šestiměsíční randomizované, dvojitě zaslepené, paralelní studie byla provedena v mužských a ženských subjektů ve věku 18-70 let s primární diagnózou schizofrenie (DSM-IV-TR) a klinického stavu vyžadující zahájení léčby s novým antipsychotika, ziprasidon nebo olanzapin 1:1, posoudit související s léčbou změny hmotnosti. Bylo zahrnuto padesát pacientů. Výsledky účinnosti byly hodnoceny na začátku a v týdnech 1, 4, 12, 18 a 24. Primárním cílovým parametrem účinnosti byla procentuální změna tělesné hmotnosti ve 24. týdnu od výchozí hodnoty. Byla také hodnocena bezpečnost.
výsledky: Ve 24. týdnu, byla významně větší nárůst tělesné hmotnosti (7.5%, p <0.0001) u pacientů léčených olanzapinem než u pacientů léčených s ziprasidon a počet jedinců, kteří měli přibývání na váze > 7%, byl významně vyšší v olanzapinem ve srovnání s ziprasidon skupiny (n = 11 ) vs n = 3 ; NEBO = 6.246, p-hodnota = 0.0150). PANNS-N se v obou skupinách významně snížil. Většina nežádoucích účinků byla v obou skupinách středně závažná nebo mírná.
závěry: olanzapin ve 24. týdnu významně zvyšuje tělesnou hmotnost oproti ziprasidonu. Léčba ziprasidonem nebo olanzapinem však zlepšila pozitivní, negativní a celkové psychopatologické skóre PANSS a byla dobře snášena.
klíčová slova: antipsychotika; přibývání na váze; ziprasidon; olanzapin; obezita.
Úvod
Schizofrenní pacienti vykazují vyšší výskyt obezity, poruch glukózové tolerance a diabetes mellitus 2. typu, s genetickou odkaz na enzymy zapojené v glycolysis1,2, a vyšší míra kardiovaskulárních events3. Navíc mnoho antipsychotik druhé generace je spojeno s vyšším rizikem přírůstku hmotnosti2, 4, inzulínové rezistence, hyperglykémie a dyslipidemie5. Kombinace těchto různých faktorů, genetická predispozice, sedavý způsob života a špatná strava a nežádoucí vedlejší účinky antipsychotické léčby, představují důležitý rizikový faktor pro kardiovaskulární onemocnění u pacientů léčených atypickými antipsychotics6. Obezita je nejen hrozbou pro zdraví a dlouhověkost, ale může také způsobit, že subjekty přestanou své antipsychotické léky7.
ziprasidon i olanzapin jsou účinná atypická antipsychotika, která se často používají při léčbě schizofrenie a schizoidních poruch. Atypická antipsychotika vykazují lepší účinnost a méně nežádoucích vedlejších účinků než typická antipsychotika8, 9. Nicméně, oni jsou stále náchylné k způsobit nežádoucí účinky, včetně hypostatická hypotension10, somnolence11, přibývání na váze 1,2, dyslipidemia12, hyperglykémie a diabetes mellitus5 a hyperprolaktinemií, které mohou generovat problémy plodnosti, sexuální dysfunkce a snížení kostní minerální density13,14.
Předchozí studie ukázaly, žádné změny v hmotnosti nebo metabolismus u pacientů léčených s ziprasidone1,2,15, Ziprasidon vykazuje nízký sklon způsobit extrapyramidové nežádoucí účinky (EPS) nebo laboratorní abnormalities8,16,17, a nemá negativní vliv na sexuální funkce schizofrenní patients18. Bylo hlášeno, že ziprasidon způsobuje úbytek hmotnosti a snížení hladin lipidů v séru 19, 20.
Olanzapin je jedním z nejčastěji předepsané antipsychotické léky s prokázanou účinností pro schizofrenii symptoms21-23. Nicméně, olanzapin patří mezi atypickými antipsychotickými léky, které indukují hmotnost gain24,25, je také spojena s významným nárůstem celkového cholesterolu, triglyceridů, LDL a půst insulin20,26,27. V předchozí studie porovnávající ziprasidon vs. olanzapin, výhradně, nebo v kombinaci s jinou léčbou olanzapinem ukázala významně větší nárůst hmotnosti a BMI a vyšší pravděpodobnost rychlé přibývání na váze, než jakékoli jiné treatment7,20,26,27. Všechny tyto studie však měly jako primární proměnnou proměnnou účinnosti, přičemž hodnocení hmotnosti bylo pouze součástí studie bezpečnosti.
antipsychotická léčba je často dlouhodobá a je nutné zvážit zvýšené riziko metabolických změn v péči o pacienta. Proto byla tato randomizovaná, dvojitě zaslepená studie navržena tak, aby se konkrétně zabývala otázkou přírůstku hmotnosti v dlouhodobém horizontu (6 měsíců), což je primární proměnná. Také, vzhledem k tomu, že ostatní faktory jsou ve vztahu k pacientům dispozice a dodržování léčby, tato studie hodnotila kvalitu života, obecné fungování, preference a postoj k léčbě, s cílem poskytnout více informací o otázky je třeba řešit v těchto dlouhodobé léčby a diskutovat o jejich vztah s hlavní účel.
Metody
six-měsíc, randomizovaná, multicentrická, paralelní, dvojitě slepá studie byla provedena od dubna 2003 do února 2007 odhadnout a porovnat účinky ziprasidon oproti olanzapinu na tělesnou hmotnost při léčbě pacientů se schizofrenií.
studie byla provedena v 11 centrech po celém Španělsku. Muž nebo žena subjektů ve věku 18-70 let s primární diagnózou schizofrenie dle DSM-IV-TR28, a klinickém stavu vyžadující zahájení léčby s novým antipsychotické léčivo bylo zařazeno. Pacienti nebo jejich zákonný zástupce dali svůj informovaný souhlas. Kritéria pro vyloučení: historie klinicky významné fyzické nemoci nebo abnormality v EKG (např. prodloužení QTc > 500 ms), klinicky významné odchylky laboratorních hodnot, epilepsie, záchvaty, psychochirurgie, nedostatečná odpověď nebo předchozí nesnášenlivosti na olanzapin nebo ziprasidon; těhotenství nebo kojení; sérologický důkaz infekce HIV nebo hepatitidy; léčba buď s drogami v rámci 6 měsíců, předchozí vyšetření; pacient schopen nebo s obtížemi, aby v souladu s protokolem studie; bezprostřední riziko spáchání sebepoškození nebo poškození ostatních; souběžné léčbě s antipsychotiky po randomizaci; depotní antipsychotické léky do jednoho měsíce od vstupu; léčba antidepresivy nebo stabilizátory nálady během dvou týdnů, randomizace; zneužívání návykových látek během předchozích 3 měsíců; organické duševní onemocnění; léčba klinického výzkumu léků do 30 dnů před randomizací.
studie byla vyvinuta ve shodě s prohlášením o Helsinki29 a protokol studie byl schválen etickými Komisemi odpovídající center a humánních Léčivých Přípravků, Oddělení Léky a Zdravotní Produkty španělské Agentury (AEMPS).
Subjekty do studie bylo zahrnuto 12 hodin po předchozí antipsychotické dávky, s výjimkou subjektů léčených s depotní antipsychotika (viz výše), a byly náhodně přiděleny v poměru 1:1.
dávkování léčby a plán návštěv
dávkování bylo flexibilní do 3 úrovní: Nízká (ziprasidon 40 mg dvakrát denně nebo olanzapin 5 mg dvakrát denně), Střední (ziprasidon 60 mg dvakrát denně nebo olanzapin 15 mg jednou denně) a vysoká (ziprasidon 80 mg dvakrát denně nebo olanzapin 10 mg dvakrát denně). Léčba byla zahájena nízkou dávkou po dobu 1-7 dnů a od 3. dne mohla být dávka upravena.
fáze léčby (6 měsíců) zahrnovala 6 návštěv: den 1 (týden 0), týden 1, týden 4, týden 12, týden 18 a týden 24. Následná návštěva (48. týden) provedená šest měsíců po ukončení léčby. Studie medikace byla hlášena z návštěvy 1 až 6. Subjekty, které vykazovaly nedostatečnou odpověď kdykoli během studie, jak je naznačeno skóre klinického globálního dojmu zlepšení (CGI-I) ≥ 6, byly staženy.
Účinnost a bezpečnost hodnocení
účinnost výsledků měřených hmotnosti, BMI a obvodu pasu (WC); krevní tlak a puls; stupnice pozitivních a negativních syndromů (PANSS)30; celkový Klinický Dojem (CGI) scale31 a další pro zlepšení (CGI-I); pacienta fyzické aktivity, preference pacienta rozsahu (PPS), k měření pacienta spokojenost s léky; španělská verze indexu zdravotních pomůcek-Mark 3 (HUI-3)32,22. Chuť k jídlu byla měřena vizuální analogovou stupnicí (VAS), Subjektivní kvantifikační metodou. Pacient označí hladinu chuti k jídlu od poslední návštěvy na vodorovné čáře označené 0 (bez chuti k jídlu) vlevo a 10 (extrémně hladový) vpravo. Vzdálenost od 0 se pak měří v cm a kvantifikuje se hladina chuti k jídlu.
všechny výsledky účinnosti byly hodnoceny při návštěvě 1 (výchozí hodnoty) a navíc: CGI-S, CGI-i a PANSS z návštěvy od 2 do 7, chuť k jídlu a pacienta fyzické aktivity, od návštěvy 3 až 6, PPS a HUI-3 na návštěvy 4 a 6
hodnocení Bezpečnosti zahrnuty klinické monitorování elektrokardiogramy, vitální, nežádoucí příhody (AEs), a bezpečnost laboratorní testy. Hodnocení bezpečnosti byla hlášena podle požadavků Worldwide Safety Standards (WSS) verze 3.
Statistická analýza
všechny analýzy byly provedeny na populaci intent-to-treat (ITT) s použitím SAS® verze 8.2 nebo vyšší. Statistické testy byly 2 ocasní a p-hodnoty 0.05 nebo menší byly považovány za statisticky významné. Léčba byla vybavena jako kategorická. 95% intervaly spolehlivosti (CI) byly sestaveny na základě všech odhadovaných léčebných rozdílů. Všechny změny byly analyzovány analýzou kovariance (ANCOVA) včetně účinků na léčebnou skupinu a výchozí hodnotu(pokud je to možné). Popisné statistiky byly použity k shrnutí všech hodnocení bezpečnosti. Nežádoucí účinky byly kódovány podle lékařského slovníku pro regulační činnosti (MedDRA). Nebyly provedeny žádné formální statistické zkoušky bezpečnostních parametrů.
Výsledky
Předmět dispozice a dávku léku,
i když studie byla původně určena pro 112 pacientů, v období studie pouze 58 předměty byly promítány. Nakonec bylo zařazeno 50 pacientů s ITT: 27 k léčbě ziprasidonem a 23 k léčbě olanzapinem. Během sledovaného období ukončilo léčbu celkem 29 subjektů (19 ve skupině se ziprasidonem a 10 ve skupině s olanzapinem). I když většina vyřazení nebyly týkající se studijního léku, 2 (jeden v každé skupině) byly vzhledem k nedostatečné účinnosti a 7 (5 v ziprasidon a 2 v olanzapin) byly v důsledku nežádoucí události. Medián trvání léčby byla nižší pro ziprasidon (52.5 dní ), než pro olanzapin skupiny (164 dní ; 32% subjektů v ziprasidon skupiny a 58% v olanzapin studii dokončilo.
během léčebné fáze dostávali pacienti léčení ziprasidonem průměrnou dávku 107,4 ± 27,3 mg / den a pacienti léčení olanzapinem průměrnou dávku 15 ± 3,3 mg / den.
výchozí charakteristiky
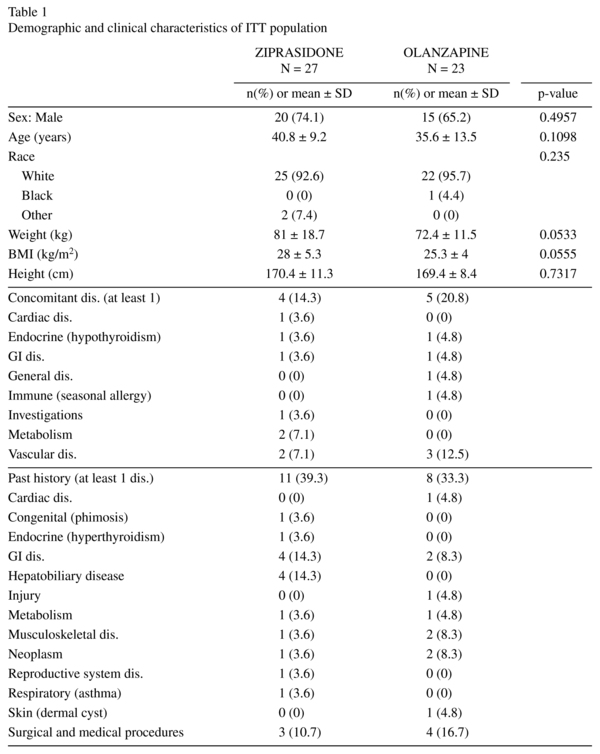
demografické charakteristiky byly mezi oběma skupinami homogenní a nevykazovaly žádné významné rozdíly. Pacienti s ITT byli ve věku 19-63 let, přičemž většina byla mezi 18-44 lety. Podrobné demografické údaje jsou uvedeny v tabulce 1. Podobné počty jedinců v obou skupinách dostávali souběžně drogové léčby v průběhu studie (26 v ziprasidon a 21 v olanzapin skupiny). Nejčastěji přijato (≥ 5 předmětů v obou léčených skupin) v obou léčebných skupinách byly lorazepam, lormetazepam, a risperidon.
Účinky na tělesné Hmotnosti
Tělesné hmotnosti byl stabilní ve 24. týdnu v ziprasidon skupiny, ukazuje žádný významný rozdíl s bazální hmotnost (-0.1% procent; pokles n.s.), zatímco došlo ke statisticky významnému zvýšení od výchozí hodnoty v olanzapin skupiny (7.4% nárůst tělesné hmotnosti od výchozí hodnoty, p < 0.0001) (Tabulka 2). Rozdíl mezi skupinami ve změně tělesné hmotnosti od výchozích hodnot byl statisticky významný ve všech časových bodech a pacientů léčených olanzapinem ukázala významné zvýšení tělesné hmotnosti od výchozích hodnot ve všech návštěv (Tabulka 2). Počet jedinců, kteří měli zvýšení tělesné hmotnosti o ≥ 7% ve 24. týdnu byl signifikantně nižší v ziprasidon (n = 3 ), než v olanzapin skupiny (n = 11 ) (NEBO = 6.246; p = 0.0150). Rozdíl mezi léčebnými skupinami byl patrný také na 12 týdnů (p = 0.0266) a 18 (p = 0.0261) (údaje nejsou uvedeny).

sekundární cílové parametry ve 24. týdnu jsou shrnuty v tabulce 3. Ziprasidon léčených pacientů nezaznamenalo žádné významné změny v WC a BMI ve 24. týdnu, zatímco olanzapinu u pacientů léčených utrpěl výrazný nárůst obou parametrů, což má za následek významný rozdíl ve 24-týdenní LSM (nejmenších čtverců) buď hodnota mezi skupinami.

Výsledky Účinnosti
Ziprasidon léčba vedla k významnému snížení (jsem. e. zlepšení) PANNS-N a př významný pokles všech PANNS podstupnic. Všechny poklesy byly významně větší ve skupině s olanzapinem než ve skupině se ziprasidonem. Nicméně, tam byl žádný významný rozdíl v počtu pacientů, že došlo ke zlepšení schizofrenie příznaky mezi skupinami, jak je hodnocena pomocí PANNS (7 ) ziprasidon vs. 11 olanzapin; p = 0.1385). Na CGI-S měřítko, 19 pacientů v ziprasidon skupina a 16 v olanzapin byly mírně až výrazně nemocný na počátku léčby; po 24 týdnech bylo 19 a 12 pacientů, respektive (data nejsou zobrazena). Na CGI-I měřítko, 5 pacientů v ziprasidon skupině a 4 v olanzapin byly „mnohem lepší“ a 1 v ziprasidon a 4 v olanzapin „velmi velké zlepšení“ na 24 týdnů (data nejsou zobrazena). Subjektů léčených olanzapinem měli lepší hodnocení pro příznakem exacerbace (CGI-S) (NEBO: 3.321, p = 0.0286) a zlepšení (CGI-I) (NEBO: 3.512, p = 0.0307) ve 24. týdnu než ti, kteří byli léčeni ziprasidonem. Nicméně, a podobně jako PANNS výsledky, nebyly zjištěny žádné významné rozdíly v počtu pacientů, které ukázaly zlepšení CGI-S (4 na ziprasidon vs. 7 na olanzapin; p = 0.2379) a CGI-I (6 na ziprasidon vs. 8 na olanzapin; p = 0.2823) mezi skupinami. Lepší spokojenost s léky, měřeno v PPS, byl pozorován v ziprasidon, než ve skupině olanzapin skupiny (p = 0.0161). Jak je uvedeno v tabulce 4, chuť k jídlu se také významně snížila u pacientů léčených ziprasidonem, zatímco ve skupině s olanzapinem se mírně zvýšila. Ačkoli zvýšení chuti k jídlu u posledně jmenovaných nedosáhlo statistické významnosti, změna byla statisticky odlišná mezi léčebnými skupinami. Nebyly zjištěny žádné významné rozdíly mezi krevním tlakem a srdeční frekvencí léčených skupin.

bezpečnostní výsledky
během této studie nebyly hlášeny žádné úmrtí. Nežádoucí účinky během této studie a laboratorní testy byly shrnuty v tabulce 5. Polovina AE události v každé skupině byly ve vztahu k léčbě (ziprasidon: útlum, úzkost, neklid, schizofrenie a hypersomnie; olanzapin: schizofrenie, neklid). Dvacet-jedno ošetření související s AEs se vyskytly u 15 jedinců (53.6%) na ziprasidon skupina a 11 o 8 subjektů (33.3%) na olanzapin skupiny.

Diskuse
Podle protokolu studie, 78 pacientů (39 v každé skupině) měly být vyhodnoceny pro statistické síle 80% pro zjištění rozdílu 5 kg, odhad SD = 7.7. Konečná populace ITT však zahrnovala 50 pacientů. Ačkoli to mohlo představovat omezení, rozdíl v tělesné hmotnosti mezi skupinami po 24 týdnech byl 7, 5% (SD = 4, 5). Výkon byl 99% a výsledek byl lepší, než se původně plánovalo.
ve shodě s předchozími studiemi byla tělesná hmotnost stabilní ve skupině se ziprasidonem, zatímco ve skupině s olanzapinem bylo statisticky významné zvýšení oproti výchozí hodnotě6, 7. Proto, ziprasidon léčených pacientů nezaznamenalo žádné významné změny v WC a BMI, zatímco pacientů léčených olanzapinem utrpěl výrazný nárůst obou parametrů a hmotnosti. V předchozím study34, procento pacientů léčených olanzapinem s ≥ 7% tělesné hmotnosti byl ještě vyšší: 60% pacientů po 3 měsících, který se zvýšil na 80% po 1 roce léčby olanzapinem. Dávkování olanzapinu v uvedené studii bylo podobné nebo nižší než v naší studii. Tato skutečnost není překvapivá, protože dávka nesouvisela s přibýváním na váze olanzapinu, ale s terapeutickou odpovědí25. Pacienti s maximálním přínosem olanzapinu z hlediska symptomů jsou také pacienti s nejvyšším rizikem významného zvýšení tělesné hmotnosti.jako možnou příčinu těchto účinků na hmotnost byly navrženy změny v příjmu potravy. V této studii významně poklesla chuť k jídlu u pacientů léčených ziprasidonem, zatímco u pacientů léčených olanzapinem nebyla hlášena žádná významná změna. Stimulace chuti k jídlu, je silně koreluje s antipsychotika drog afinitu k H1 a alfa1 adrenergních receptors35 a snížení chuti k jídlu v ziprasidon léčených pacientů je pravděpodobně spojená s drogami nízkou afinitu k H1 receptoru. Olanzapin léčených pacientů neprokázaly významné zvýšení chuti k jídlu, ale stále se ukázala významné zvýšení tělesné hmotnosti, což naznačuje, že jiné mechanismy mohou být zapojeny v olanzapin-indukované zvýšení tělesné hmotnosti. Tschoner et al. našli vyšší půstu glukózy v krvi a zvýšené skóre v inzulínová rezistence model u pacientů léčených olanzapinem, zatímco tento účinek může být pozorován v ziprasidon léčených pacientů, což naznačuje účast tohoto efektu v olanzapin indukované hmotnost gain6. Studie na zvířatech prokázaly, že olanzapin, ale nikoli ziprasidon, stimuluje konzumaci tuku36 a že chronická léčba olanzapinem zhoršuje lipolýzu adipocyty37. Předchozí studie také zjistily zvýšení cholesterolu, triglyceridů a LDL cholesterolu u pacientů léčených olanzapinem, a nikoli u jedinců léčených ziprasidonem6, 38. Fyzická aktivita je výrazně snížena v olanzapin léčených patients39,40, ale NEBO cvičení v této studii výrazně upřednostňuje olanzapin nad ziprasidon léčených pacientů, a proto nevysvětluje rozdíl v tělesné hmotnosti.
pacientů léčených Olanzapinem ukázala výrazně lepší výsledky v PANNS podstupnic, než ty pod ziprasidon léčby, což potvrzuje výsledky z předchozího study20. Účastníci této studie přerušili předchozí léčbu kvůli nesnášenlivosti, což ztěžovalo srovnání s naší současnou studií. Dávka ziprasidonu byla podobná, ale dávka olanzapinu byla vyšší. Olanzapin ukazuje zvyšující se křivky závislosti dávka-reakce pro schizofrenii symptoms21,41, což by mohlo vysvětlit větší zlepšení v PANNS ve srovnání s ziprasidon ve studii s vyšší dávkou olanzapinu. Bylo však popsáno, že dávky olanzapinu vyšší než 20 mg/den představují větší riziko významných vedlejších účinků42, 43.
naproti tomu dvě další studie nezjistily žádný rozdíl v účinnosti mezi léčbami. Studie provedená Liebermanem a kol.7 neprokázaly žádné významné rozdíly ve změně celkového skóre PANNS oproti výchozí hodnotě ani mezi olanzapinem a ziprasidonem. Stejně tak studie Simpsona a kol. neprokázaly žádné rozdíly ve zlepšení skóre PANNS mezi skupinami26, 27. Tyto studie používají podobné flexibilní dávky jako ty, kdysi jsme našli stejné účinnosti buď s olanzapinem nebo ziprasidon léčby. Věrohodné vysvětlení by mohlo být, že i když ziprasidon je indikován k léčbě schizofrenie v rozmezí 40-160 mg/den, optimální dávka je blíže k 120 mg/day44 a průměrná dávka z našich obor, mírně nižší než průměrné dávky další dvě studie, nemusí být optimální. Kromě toho mohla být biologicky dostupná dávka ještě nižší. I když ziprasidon plazmatické hladiny ukazuje významnou pozitivní korelaci s receptor obsazenost, dávka není předpovědět plazmová level44, protože jídlo může zasahovat na ziprasidon absorption45, ovlivňuje, může záviset na léky načasování.
Tam bylo 1,6 krát více ukončení léčby v ziprasidon než v olanzapin skupiny, což ukazuje na vyšší násobný rozdíl mezi oběma typy léčby než v ostatních studies7,20. Většina nežádoucích účinků byla v obou skupinách mírná nebo středně závažná a zahrnovala nežádoucí účinky obvykle pozorované u těchto léčiv20, 34. Stupnice PPS ukazuje, že pacienti dávali přednost ziprasidonu před olanzapinem.
Tato studie ukázala významně větší nárůst tělesné hmotnosti ve 24. týdnu u pacientů léčených olanzapinem ve srovnání s pacienty léčenými ziprasidon. Hlášené progresivní snížení chuti k jídlu mohlo přispět k mírnému poklesu tělesné hmotnosti pozorovanému u pacientů léčených ziprasidonem. Na druhou stranu, pacienti na olanzapin indikován určité zvýšení jejich chuť k jídlu, ale změny v této skupině nebyly významné, a ne ukázat progresivní nárůst variantu, že ziprasidon pacientů hlášeny. Vizuální analogová škála je subjektivní metoda pro měření k jídlu, a i když rozdíly v chuti jsou výrazné, a výsledky se zdálo, spočíval v průběhu studie, mírně zvýšená chuť k jídlu nebo nedostatek pohybu se neobjevují zodpovědný za zvýšení tělesné hmotnosti zkušený pacientů léčených olanzapinem, což naznačuje, že jiné mechanismy. Přednost tukových potravin a metabolická dysregulace mohou hrát roli v základní příčině. Oba ziprasidon a olanzapin skupiny byly dobře tolerovány a ukázal pokles v PANSS skóre ve 24.týdnu. Ačkoli byl pokles významně větší u všech skóre ve skupině s olanzapinem, nelze vyloučit možnost snížené biologické dostupnosti ziprasidonu.
V těch pacientů, u nichž přírůstek hmotnosti v průběhu léčby schizofrenie, může být problém, zacházení s ziprasidon by měl být souzen, protože jeho dobrý bezpečnostní profil v této oblasti.
poděkování
lékařská písemná podpora byla poskytována společností Medical Statistics Consulting a byla financována společností Pfizer.
1. Allison DB, Fontaine KR, Heo M, Mentore JL, Cappelleri JC, Chandler LP, et al. Distribuce indexu tělesné hmotnosti mezi jednotlivci se schizofrenií a bez ní. J Clin Psychiatrie 1999; 60 (4): 215-220.
2. Baptista T, De Mendoza S, Beaulieu S, Bermudez A, Martinez m. metabolický syndrom během atypické antipsychotické léčby: mechanismy a řízení. Metab Syndr Relat Disord 2004; 2 (4): 290-307.
3. Enger C, Weatherby L, Reynolds RF, Glasser DB, Walker AM. Závažné kardiovaskulární příhody a mortalita u pacientů se schizofrenií. J Nerv Ment Dis 2004; 192 (1): 19-27.
4. Allison DB, Mentore JL, Heo M, Chandler LP, Cappelleri JC, Infante MC, et al. Antipsychoticky indukovaný přírůstek hmotnosti: komplexní výzkumná syntéza. Am J Psychiatrie 1999; 156 (11): 1686-1696.
5. Kane JM, Barrett EJ, Casey DE, Correll CU, Gelenberg AJ, Klein S, et al. Metabolické účinky léčby atypickými antipsychotiky. J Clin Psychiatrie 2004; 65 (11): 1447-1455.
6. Tschoner A, Engl J, Rettenbacher M, Edlinger M, Kaser S, Tatarczyk T, et al. Účinky šesti antipsychotik druhé generace na tělesnou hmotnost a metabolismus-hodnocení rizik a výsledky prospektivní studie. Farmakopsychiatrie 2009; 42 (1): 29-34.
7. Lieberman JA, Stroup TS, McEvoy JP, Swartz MS, Rosenheck RA, Perkins DO, et al. Účinnost antipsychotik u pacientů s chronickou schizofrenií. N Engl J Med 2005; 353(12): 1209-1223.
8. Král DJ. Léčba negativních příznaků schizofrenie. Eur Neuropsychopharmacol 1998; 8 (1): 33-42.
9. Weiden P, Aquila R, Standard J. atypická antipsychotika a dlouhodobý výsledek u schizofrenie. J Clin Psychiatrie 1996; 57 (Suppl 11): 53-60.
10. Drici MD, Priori s. kardiovaskulární rizika atypické antipsychotické léčby. Farmakoepidemiol Lék Saf 2007; 16 (8): 882-890.
11. Gao K, Ganocy SJ, Gajwani P, Muzina DJ, Kemp DE, Calabrese JR. Přezkum citlivost a snášenlivost antipsychotika u pacientů s bipolární poruchou nebo schizofrenií: zaměření na somnolence. J Clin Psychiatrie 2008; 69 (2): 302-309.
12. Nasrallah HA. Atypické metabolické vedlejší účinky vyvolané antipsychotiky: poznatky z profilů vázajících receptory. Mol Psychiatrie 2008; 13 (1): 27-35.
13. Baldwin D, Mayers a. sexuální vedlejší účinky antidepresiv a antipsychotik. Adv Psychiatr Treat 2003; 9 (3): 202-210.
14. Montejo AL. Povědomí o prolaktinu: zásadní úvaha o fyzickém zdraví u schizofrenie. Eur Neuropsychopharmacol 2008; 18 (Suppl 2): S108-114.
15. Keck PE, Jr., McElroy SL, Arnold LM. Ziprasidon: nové atypické antipsychotikum. Expert Opin Pharmacother 2001; 2 (6): 1033-1042.
16. Kane JM, Khanna S, Rajadhyaksha S, Giller e. účinnost a snášenlivost ziprasidonu u pacientů se schizofrenií rezistentní na léčbu. Int Clin Psychopharmacol 2006; 21 (1): 21-28.
17. Keck P, Jr., Buffenstein A, Ferguson J, Feighner J, Jaffe W, Harrigan EP, et al. Ziprasidon 40 a 120 mg / den v akutní exacerbaci schizofrenie a schizoafektivní poruchy: 4týdenní placebem kontrolovaná studie. Psychofarmakologie (Berl) 1998; 140(2): 173-184.
18. Montejo AL, Rico-Villademoros F. Změny v sexuální funkce u ambulantních pacientů se schizofrenií nebo jiným psychotickým onemocněním léčených s ziprasidon v klinické praxi nastavení: 3-měsíc prospektivní, observační studie. J Clin Psychopharmacol 2008; 28 (5): 568-570.
19. Kingsbury SJ, Fayek M, Trufasiu D, Zada J, Simpson GM. Zjevné účinky ziprasidonu na plazmatické lipidy a glukózu. J Clin Psychiatrie 2001; 62 (5): 347-349.
20. Stroup TS, Lieberman JA, McEvoy JP, Swartz MS, Davis SM, Rosenheck RA, et al. Účinnost olanzapinu, kvetiapinu, risperidon a ziprasidon u pacientů s chronickou schizofrenií po vysazení předchozí atypické antipsychotikum. Am J Psychiatrie 2006; 163 (4): 611-622.
21. Beasley CM, Jr., Tollefson G, Tran P, Satterlee W, Sanger T, Hamilton s. olanzapin versus placebo a haloperidol: výsledky akutní fáze severoamerické dvojitě zaslepené studie olanzapinu. Neuropsychofarmakologie 1996; 14 (2): 111-123.
22. Conley RR, Mahmoud R. Randomizovaná dvojitě zaslepená studie risperidonu a olanzapinu v léčbě schizofrenie nebo schizoafektivní poruchy. Am J Psychiatrie 2001; 158 (5): 765-774.
23. Gomez JC, Crawford AM. Vyšší účinnost olanzapinu oproti haloperidolu: analýza pacientů se schizofrenií z multicentrické mezinárodní studie. J Clin Psychiatrie 2001; 62 (Suppl 2): 6-11.
24. Bobes J, Rejas J, Garcia-Garcia M, Rico-Villademoros F, Garcia-Portilla MP, Fernandez I, et al. Zvýšení tělesné hmotnosti u pacientů se schizofrenií léčených risperidonem, olanzapinem, kvetiapinem nebo haloperidolem: výsledky studie EIRE. Schizofr Res 2003; 62 (1-2): 77-88.
25. Kinon BJ, Kaiser CJ, Ahmed S, Rotelli MD, Kollack-Walker. S. Asociace mezi počátkem a rychlé přibývání na váze a změna hmotnosti v průběhu jednoho roku olanzapinu terapie u pacientů se schizofrenií a příbuznými poruchami. J Clin Psychopharmacol 2005; 25 (3): 255-258.
26. Simpson GM, Glick ID, Weiden PJ, Romano SJ, Siu CO. Randomizované, kontrolované, dvojitě zaslepené multicentrické srovnání účinnosti a snášenlivosti a olanzapin, ziprasidon u akutně nemocných hospitalizovaných pacientů se schizofrenií nebo schizoafektivní poruchou. Am J Psychiatrie 2004; 161 (10): 1837-1847.
27. Simpson GM, Weiden P, Pigott T, Murray S, Siu CO, Romano SJ. Šestiměsíční, zaslepená, multicentrická pokračující studie ziprasidonu versus olanzapinu u schizofrenie. Am J Psychiatrie 2005; 162 (8): 1535-1538.
28. Americká Psychiatrická Asociace., Americká Psychiatrická Asociace. Pracovní skupina pro DSM-IV. Diagnostický a statistický manuál duševních poruch: DSM-IV-TR. 4.vydání. Washington, DC: Americká psychiatrická asociace; 2000.
29. WMA. Deklarace Světové lékařské asociace v Helsinkách: etické principy lékařského výzkumu zahrnujícího lidské subjekty. J Postgrad Med. 2002; 48(3): 206-208.
30. Kay SR, Fiszbein A, Opler LA. Stupnice pozitivního a negativního syndromu (PANSS) pro schizofrenii. Schizofr Bull 1987; 13 (2): 261-276.
31. Guy W, Národní institut duševního zdraví (USA). Výzkumný Obor Psychofarmakologie., Early Clinical Drug Evaluation Program. Ecdeu assessment manual pro psychofarmakologii. Reverend ed. Rockville, Md.: U.S. Oddělení. zdravotnictví, alkohol, zneužívání drog a správa duševního zdraví, Národní institut duševního zdraví, výzkumná pobočka psychofarmakologie, divize Extramurálních výzkumných programů; 1976.
32. Feeny D, Furlong W, Boyle M, Torrance GW. Multi-atribut klasifikační systémy zdravotního stavu. Index Zdravotních Pomůcek. Farmakoekonomie 1995; 7 (6): 490-502.
33. Ruiz M, Rejas J, Soto J, Pardo A, Rebollo i. adaptace a validace značky Health Utilities Index 3 do španělštiny a korekční normy pro španělskou populaci. Med Clin (Barc) 2003; 120(3): 89-96.
34. McEvoy JP, Lieberman JA, Perkins DO, Hamer RM, Gu H, Lazarus A, et al. Účinnost a snášenlivost olanzapinu, kvetiapinu a risperidonu v léčbě časné psychózy: randomizované, dvojitě zaslepené 52týdenní srovnání. Am J Psychiatrie 2007; 164 (7): 1050-1060.
35. Baptista T, Zarate J, Joober R, Colasante C, Beaulieu S, Paez X, et al. Zvýšení tělesné hmotnosti vyvolané léky, překážka úspěšné farmakoterapie: zaměření na antipsychotika. Curr Drogové Cíle 2004; 5 (3): 279-299.
36. Hartfield AW, Moore NA, Clifton PG. Účinky atypických antipsychotik na příjem intralipidů a hyperaktivitu vyvolanou kokainem u potkanů. Neuropsychofarmakologie 2006; 31 (9): 1938-1945.
37. Minet-Ringuet J, Even PC, Valet P, Carpene C, Visentin V, Prevot D, et al. Změny metabolismu lipidů a genové exprese u potkaních adipocytů během chronické léčby olanzapinem. Mol Psychiatrie 2007; 12 (6): 562-571.
38. Rettenbacher MA, Ebenbichler C, Hofer, Kemmlera G, Baumgartner S, Edlinger M, et al. Časné změny plazmatických lipidů během léčby atypickými antipsychotiky. Int Clin Psychopharmacol 2006; 21(6): 369-372.
39. Fell MJ, Anjum N, Dickinson K, Marshall KM, Peltola LM, Vickers S, et al. Zřetelné účinky subchronické antipsychotické léčby na výběr makronutrientů, tělesnou hmotnost, adipozitu a metabolismus u samic potkanů. Psychofarmakologie (Berl) 2007; 194(2): 221-231.
40. Fleischhaker C, Heiser P, Hennighausen K, Herpertz-Dahlmann B, Holtkamp K, Mehler-Wex C, et al. Klinické sledování léků v dětské a adolescentní psychiatrii: vedlejší účinky atypických neuroleptik. J Child Adolesc Psychopharmacol 2006; 16 (3): 308-316.
41. Fanous A, Lindenmayer JP. Schizofrenie a schizoafektivní porucha léčená vysokými dávkami olanzapinu. J Clin Psychopharmacol 1999; 19 (3): 275-276.
42. Farah a. Atypičnost atypických antipsychotik. Prim Péče Společník J Clin Psychiatrie 2005; 7 (6): 268-274.
43. Reich J. použití vysokých dávek olanzapinu při refrakterní psychóze. Am J Psychiatrie 1999; 156 (4): 661.
44. Mamo D, Kapur S, Shammi CM, Papatheodorou G, Mann S, Therrien F, et al. PET studie obsazenosti dopaminu D2 a serotoninového 5-HT2 receptoru u pacientů se schizofrenií léčených terapeutickými dávkami ziprasidonu. Am J Psychiatrie 2004; 161 (5): 818-825.
45. Hamelin BA, Allard S, Laplante L, Miceli J, Wilner KD, Tremblay J, et al. Vliv načasování standardního jídla na farmakokinetiku a farmakodynamiku nového atypického antipsychotika ziprasidonu. Farmakoterapie 1998; 18 (1): 9-15.