review Článek
Leukémie-pro praktického lékaře,
Leukémie pro praktického lékaře,
Rafael Hurtado Monroya, Braulio Solano Estradab, Pablo Vargas Viverosc
Vedoucí oddělení Hematologie. Nemocnice Ángeles del Pedregal. Mexiko, DF. E-mailová adresa: [email protected]
B Interní medicína. Nemocnice Ángeles del Pedregal. Mexiko. DF.
C Interní medicína. Nemocnice Ángeles del Pedregal. Mexiko. DF.
přijato: 17. října 2011
přijato: 07. ledna 2012,
ÚVOD
i Přes velkou molekulární a terapeutické pokroky ve studiu leukémie, základní aspekty tohoto stavu nejsou dosud jasně známé tím, non-hematolog, tak cílem této práce je poskytnout základní informace pro studenty lékařské fakulty a lékaři obecně, a to umožňuje především pro získání všeobecných znalostí z leukémie, jejich včasné diagnostice a usilovat o předčasné odkaz s hematolog.

definice
leukémie je termín používaný k definování skupiny maligních krevních onemocnění. Včasná diagnóza je nezbytná, protože umožní pacientovi jít brzy s hematologickým specialistou, který povede diagnostický proces a nabídne specifickou léčbu. Je charakterizován tím, že má klonální, autonomní a abnormální proliferaci buněk, které vedou ke vzniku zbytku normálních buněk krve(chování nádoru obecně).
to znamená, že časná buňka prochází genetickou změnou, která způsobí, že se nekontrolovatelně objeví abnormální klon (kolonie). Tento abnormální produkce je neuspořádané, protože abnormální buňky, množit se v obrazu a podobě sebe, takže se postupně zabírat prostor v normální kostní dřeně a způsobují progresivní anémie, abnormální krvácení a náchylnost k infekcím. Na druhou stranu, když abnormální buňky napadnout jiné tkáně, tam bude selhání fungování orgánu týká, například, infiltrace centrálního nervového systému, který se vyskytuje v akutní lymfoblastickou leukémií (LAL) se mohou projevit bolesti hlavy, záchvaty, se zaměřil motor změny, zvýšený nitrolební tlak, a selhání, aby se včasná diagnóza a poskytnout adekvátní léčbu, bude prezentovat ztráta funkce a nevratné následky.
KLINICKÉ PROJEVY
klinický obraz je rozmanitý a závisí na typu leukémie: akutní nebo chronické, nicméně pro 2 tam jsou non-specifické klinické projevy (které se vyskytují v každém onemocnění):
1. Únava.
2. Snadná únava.
3. Generalizovaná slabost.
4. Touží zůstat v klidu nebo v posteli.
5. To vyžaduje pomoc někoho, aby vyhovoval vašim osobním potřebám.
Chronické leukemie jsou indolentní a až 50% případů jsou zjištěny v běžné klinické nebo laboratorní hodnocení u dobrovolníků, kteří jsou považováni za zdravé a přijít darovat krev, nicméně, jak nemoc postupuje, nespecifické projevy jsou prezentovány, ale nyní jsou specifické (Tabulka 1).

V akutní formy, konkrétní projevy jsou odvozeny z nedostatku jednoho z buněčných linií:
1. Erytrocyt: anemický syndrom, jehož intenzita bude záviset na stupni hypoxémie bez ohledu na stupeň anémie. Dušnost střední námahy až do orthoprea.
2. Krevní destičky: petechie, ekchymóza v končetinách, a v závažnějších případech generalizované, suché a mokré krvácení a krvácení z nosu, gingivorrhagia, hematurie, hřívu nebo hematochesia. Velmi závažné v centrálním nervovém systému (CNS).
3. Leukocyty: horečka, diaforéza, lokalizované infekce až po upřímnou septikémii (bakterie nebo houby). Vyskytují se u neutropenie méně než 250 celkových neutrofilů / mm3.
Infiltrativní syndrom: vztahuje se k abnormální implantaci v jakékoli tkáně, i když je společné:
1. Hepatomegalie nebo splenomegalie (obrázek 5).
2. Adenomegalie (lokální nebo generalizovaná).
3. Leukemická pleť.
4. Bolest kostí z expanze kostní dřeně.
5. Měkké tkáně (granulocytární sarkom).
6. Varle.
7. SNC.
8. Dásně a jakékoliv místo (obrázek 1).

metabolické poruchy: jsou výsledkem abnormální hyperprodukce maligních buněk a zvýšené apoptózy.
1. Acidóza.
2. Zvýšená laktátdehydrogenáza (LLD).
3. Hyperkalemie.
4. Hyperurikémie.
5. Zvýšený β2 mikroglobulin.
klinické důkazy převládá jako základní kámen podezření diagnózy akutní leukémie a stavu, ale to, co následuje, je k doplnění diagnózy s podporou klinických laboratoří v cytometrie kompletní krevní obraz, nebo zvláštní, což znamená, důkladné pozorování v nátěru periferní krve technický personál, který má přípravu v identifikaci abnormálních buněk, zejména leukémie.

Laboratorní změny, vyžadující zvláštního přezkumu patří:
1. Anémie (jakýkoli stupeň).
2. Leukopenie nebo leukocytóza (Převaha buněčné linie).
3. Trombocytopenie.
4. Kombinace: bicitopenie nebo pancytopenie.
je třeba věnovat zvláštní pozornost, pokud laboratoř hlásí přítomnost leukocytů nebo atypických lymfocytů (mohou to být leukemické blasty). Je vhodné požádat o znalecký posudek (Obrázek 2).

aspirace kostní dřeně je nezbytná pro diagnózu (obrázek 3 ) a pro stanovení kritérií pro akutní leukémii v kterékoli z jejích odrůd je zapotřebí 20% výbuchů.

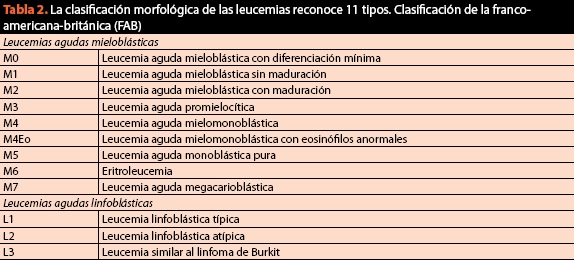
V stejným postupem, vzorky by měly být získány pro konečné klasifikaci stavu a žádost karyotypu a imunofenotypu, protože v současné době cytomorphology kritériem je životně důležité, ale není dostatečné. Současná a současná klasifikace maligních krevních onemocnění je uvedena v tabulce 2.
léčba je zaměřena na 2 důležité aspekty: prvním z nich je specifický antileukemic a je založena na použití léků chemického původu, které jsou známé jako chemoterapie, jehož hlavním cílem je vymýtit, že je, odstranit všechny leukemické buňky z těla. Druhým aspektem léčby je podpora komplikací, které se obvykle vyskytují u pacientů při přijetí.
léčba je zaměřena na 2 důležité aspekty: prvním z nich je specifický antileukemic a je založena na použití léků chemického původu, které jsou známé jako chemoterapie, jehož hlavním cílem je vymýtit, že je, odstranit všechny leukemické buňky z těla.
druhým aspektem léčby je podpora komplikací, které pacienti obvykle představují při přijetí, jako například:
1. Anémie.
2. Abnormální krvácení.
3. Plicní a generalizované infekce, mimo jiné (obrázek 4).
4. Jakékoli další sousední komplikace, které může mít pacient (komorbidita), jako jsou již existující stavy, např. diabetes, hypertenze, srdeční choroby a další nemoci běžné u pacientů trpících leukémií.


proto je velmi důležité vzít v úvahu, že léčba proti leukémii je multidisciplinární, zahrnující účast dalších odborníků, jako je například podpora pro hematolog.
Antileukemická léčba bude také odlišná pro různé typy leukémie a pro akutní formy. Je rozdělen do 3 fází:
1. Indukce remise. Normalizace krevních hodnot pacienta, absence jakýchkoli příznaků nebo příznaků, že leukémie přetrvává s infiltrací. Během procesu pacient by měl mít „leukémie-svobodný stát“ v kostní dřeni a budoucnost by měla být obnova normální krvetvorby, a bohužel v ostatních případech, oni obnovit s nemocí, která mluví o tom, odolné proti leukémii, jejichž prognóza je hrozné. Tento první proces může trvat 6 až 8 týdnů k dosažení CR.
2. Konsolidace. Zahrnuje použití stejných léků, které byly použity při indukci nebo kombinaci jiných chemoterapeutik, také za účelem eradikace zbytkových maligních buněk, které by mohly vyvinout rezistenci vůči prvnímu použití.
3. Údržba. Je výhodné udržovat pacienta pod účinkem chemoterapie před možností počínající leukemické aktivity a že při léčbě udržuje účinek, dokud nemoc nezmizí.

zatím pro akutní formy, nejpřísnější kritéria, aby zvážila ČR stále složitější, protože to je nejlepší se podívat na molekulární remise, což zahrnuje vyhledávání pro počáteční chromozomální změny jako je tomu v případě promyelocytární leukémie (M3-FAB) s t (15;17) zpočátku je třeba hledat specifické molekulární a cytogenetické studie, přestože jsou v CR, protože pokud translokace přetrvává, agresivní léčba by měla pokračovat až do úplné eliminace klonu. Tato odrůda leukémie by měla být považována za potenciálně léčitelnou a je jednou z nejčastějších v Latino populaci.
léčba onemocnění pak bude záviset na eliminaci všech existujících maligních buněk u pacienta. Obecně platí, že některé leukémie může být náchylné k vyléčení chemoterapií samotnou, ale dnes velký význam musí být věnována tzv. prognostických faktorů, které jsou založeny na matematických modelech, které umožňují pacientům, aby být umístěny v míře prognózu mají a patří:
1. Typ leukémie.
2. Počáteční molekulární změna a její perzistence navzdory léčbě nebo eradikaci.
3. věk. Pacienti starší 60 let mají špatnou prognózu ve srovnání s mladšími pacienty.
4. Chemoterapie. Měly by být použity uvedené léky a především doporučené dávky. Například, v dospělých LAL, použití HyperCyVAD režimu (eskaloval dávky cyklofosfamid, vinkristin, adriamycin, dexametazon v kombinaci s cytosinarabinosid a metotrexát) dosahuje 90% CR a léčí v 50% případů, dat, ne dříve neviděl s jinými systémy. Tato léčba je toxická a vyžaduje, aby byla používána pouze v institucích, které mají dostatečné podpůrné zdroje. Bohužel, v našem prostředí ne všechny centra mají doporučené léky a výsledky budou reprodukovatelné, protože nemají dostatečnou podporu pro pacienta během fáze maximálního myelosuprese.
5. Podpůrná léčba. Úspěchy chemoterapie a nové léky, nové kombinace a s větší přesností, než donutit, provádění multi-disciplinární týmy s adresou hematolog; instalace a použití centrální žilní katétry; podpora pro krevní banky pro podporu transfuze krevních destiček a erytrocytů (dokonce i výrobky hvězdicovité); zásah infectologist pro detekci infekce, a vhodné používání antibiotik či antimykotik, a to buď profylaktické nebo terapeutické, pokud je to nutné; poskytování izolace pokoje s údržbou a proviantní služby, které umožňují dosažení prostředí bez bakterií, včetně sterilních krmení; laboratoř s pacientem vzorku protokol řízení ve specifických léčebných protokolů a řízení speciálních vzorků (příprava leukocytárních koncentrátů v buffy coat hematický cytometrie a dosáhnout optimální čtení); oblast přípravy vysoce specializované léky, a na druhé straně, nejdůležitější je ošetřovatelství, pomocný a administrativní personál, který s celou skupinou jsou očekávané výsledky, které mají v jiných zemích.
6. Transplantace kostní dřeně (MO). Jedná se o komplexní a nákladný typ léčby, který vyžaduje kompatibilního dárce MO a neaktivní stav s vysokou pravděpodobností časného nebo pozdního relapsu nebo s faktory špatné prognózy. To je postup s další léčebné tendence, protože používá mega chemoterapie k eradikaci leukemických buněk, ale v pokusu, to také odstraňuje běžné prekurzorů a nahrazení novou kompatibilní normální dřeně je nutné. Typ alogenní (sourozenec kompatibilní totožné), je to nejlepší výběr, protože přijímač přijímá pouze částečné identity (pouze celkové přijetí jsou jednovaječná dvojčata), a proto výsledky v odmítnutí štěpu proti hostiteli, což vede k reakci štěpu proti leukémii a zvyšuje eradikaci leukemických klonů, nicméně, v závažných případech syndromu (stupně 3-4) nemocnost a úmrtnost se zvýšila a to i přes specifické zacházení.
chronické leukémie
1. Chronická lymfocytární leukémie. To se vyskytuje častěji u starších lidí a je kritérium perzistence lymfocytóza více než 10 x 109/l a MO s infiltrací více než 50% lymfocytů s CD5+fenotypu. Kritériem léčby je zdvojení účet lymfocytů v roce nebo progresi adenomegalia nebo splenomegalie, i když některé případy nad rámec tohoto standardu tím, že přítomnost hemolytická anémie nebo trombocytopenie, autoimunitní, a pak indikována léčba na základě kombinace fludarabin, cyklofosfamid a prednison, ve fázích i a II, pouze somenter a pozorovaný a očekávaný vývoj bez léčby.
2. Chronická myeloidní leukémie (CML). V této nemoci je velký pokrok v poznání přítomnost Filadelfského chromozomu, který byl popsán v roce 1950 ve městě Americké Unie, a to svého vzniku byla první marker chromozom v asociaci s malignity, nicméně v průběhu let výzkumu, se nám podařilo vím, t(9;22) s funkční exprese chromozomu s produkci onkoproteinu s velkou thyrokinokinase činnost, která zvyšuje proliferaci buněk a což vysvětluje velkou leukocytóza a trombocytóza, s níž tito pacienti představují, stejně jako velká splenomegalie (Obrázek 5).
V této době, 10 až 12 let, které uplynuly od objevu malé molekuly specificky namířených proti této fosfátové-dárce molekulární podklad pro interní nařízení leukemických buněk a jejích substrátů. Původně nazýván STI (signální transdukce inhibitor) vyrábí konkurenční inhibici fosforylace, vedlo k buněčné apoptózy a pacientů dosaženo klinické výsledky nikdy předtím neviděl s molekulární remise až na 80-90%, na 10 let, které výrazně změnily přirozené historie nemoci, s pre-léčba není více než 3 roky. Tyto informace mění přirozenou historii a prognózu onemocnění, která byla v krátkodobém horizontu fatální.

Tyto příklady jsou základní pokroku tak intenzivní, že došlo v posledních několika letech, a že je žádoucí, aby vyvolat zájem studentů, jejich učitelů, ale především na vzdělávání orgánů leukémie obecně, která zabírá prvních 5 místech frekvence maligních onemocnění dospělých a z prvních míst v děti, takže hematologie musí být zahrnuty do základních předmětů v učebním plánu kariéry Medicíny a dokonce i jako součást kurzů postgraduální specializace.
ačkoli je britská francouzsko-americká klasifikace (FAB) užitečná pro svou jednoduchost, může vést až k diagnostickým a tedy terapeutickým chybám až ve 20% případů. Z tohoto důvodu se klasifikace metodami imunohistochemie a molekulární biologie stala požadavkem sine qua non pro správnou klasifikaci a následnou léčbu pacientů (obrázek 6).

na rozdíl od FAB klasifikace WHO (tabulka 2) odráží změnu v paradigmatu, jehož prostřednictvím chápeme, onemocnění krve, protože poprvé v kombinaci genetické informace, morfologické, cytochemické a immunophenotypic s klinickými nálezy v rámci diagnostických algoritmů nádorů z krvetvorné tkáně; relativní význam každého kritéria se liší mezi novotvary a neexistuje žádný „zlatý standard“ pro klasifikaci všech hematologických malignit. Cílem bylo definovat entity, které by patologové mohli rozpoznat a které by měly klinický význam. Od svého vzniku v roce 2001 byly provedeny různé revize, aby se aktualizoval jeho obsah ve vztahu k nejaktuálnějším objevům. Poslední přehled byl z roku 2008 a klasifikuje hematologické malignity takto:
1. Myeloidní novotvary.
2. Lymfoidní novotvary.
3. Onemocnění žírných buněk nebo tukových buněk.
4. Histiocytární a dendritická buněčná onemocnění.

NEOPLASIS MYELOIDNÍ
myeloidní nádory jsou odvozeny z kmenových buněk v kostní dřeni, diferencovat do erytrocytů, granulocytů (neutrofilů, bazofilů a eozinofilů), monocytů a megakaryocytů. Klasifikace FAB rozpoznává 3 hlavní kategorie:
1. Akutní myeloidní leukémie.
2. Myelodysplastické syndromy.
3. Myeloproliferativní novotvary.
nejdůležitější determinanty kategorií rozpoznány pomocí morfologické, histochemické a immunophenotypic a procento výbuch buňky, buněčné linie a stupně diferenciace nádorových buněk (obrázek 7). V posledních letech, genetické charakteristiky (cytogenetické a molekulární), stejně jako pre-léčba a vývoje myelodysplazie, ukázala významný dopad na klinické chování těchto utrpení, které ne vždy korelují dobře s kategorií FAB, tak, že centrální debata o přeřazení byl k diskriminaci mezi subjekty a patologických prognostických faktorů, k dosažení klasifikace, klinické relevance a význam, za patolog. Zdá se, že některé genetické abnormality definují různá onemocnění, zatímco jiné představují prognostické faktory pro konkrétní onemocnění.

v Současné době, WHO klasifikace skupin myeloidní podmínky do 4 hlavních skupin:
1. Myeloproliferativní onemocnění
2. Myelodysplastické syndromy
3. Myelodysplastická / myeloproliferativní onemocnění
4. Akutní myeloidní leukemie

Myeloproliferativní onemocnění jsou skupinou klonální poruchy spojené s proliferací jedné či více myeloidních linií. Je stále jasnější, že tyto choroby jsou často spojeny s mutacemi, které způsobují abnormální zvýšení tyrosin kinázy a růstový faktor nezávislý na předek buněčné proliferace v kostní dřeni. Procento výbuchů v kostní dřeni je normální nebo mírně vysoké, ale vždy méně než 20%. Hematopoéza je obvykle účinná, což vede ke zvýšení počtu jedné nebo více zralých buněk v periferní krvi. Prototypem myeloproliferativních novotvarů je chronická myeloidní leukémie (BCR/ABL) pozitivní na chromozom Philadelphia (Ph1). Další zahrnuté entity jsou:
1. Polycythemia vera.
2. Idiopatická myelofibróza.
3. Primární esenciální trombocytémie.
4. Chronická eozinofilní leukémie.
5. Chronická neutrofilní leukémie.
6. Mastocytóza.
7. Nezařaditelné myeloproliferativní novotvary.

Myelodysplastické syndromy viz poruchy vyznačuje neefektivní výrobní buňky a dysplazie, s proměnnou riziko transformace do akutní leukémie. Celularita v dřeni je často zvýšená, ale vysoce variabilní. Existuje zrání, ale také dysplazie jedné nebo více myeloidních linií. Hematopoéza není účinná, a proto existují cytopenie. Tato položka obsahuje:
1. Refrakterní cytopenie s jednořádkovou dysplazií*.
* refrakterní anémie •
* refrakterní neutropenie.
* refrakterní trombocytopenie.
2. Refrakterní anémie s prstencovými sideroblasty.
3. Refrakterní cytopenie s dysplazií více linií.
4. Refrakterní anémie s nadbytkem výbuchů.
5. Myelodysplastický syndrom s d (5q).
6. Nezařaditelný myelodyspastický syndrom.
7. Juvenilní myelodysplastický syndrom zahrnuje prozatímní entitu známou jako juvenilní refrakterní cytopenie.
myelodysplastické / myeloproliferativní syndromy zahrnují poruchy, u kterých koexistují dysplastické a proliferativní charakteristiky. Tato skupina zahrnuje myelomonocytární juvenilní leukémii, která je reprezentativní pro oba syndromy (myelodysplastické a myeloproliferativní). Téměř polovina pacientů přítomné s normální nebo nízký počet neutrofilů a dysplazie více buněčných linií bez organomegaly a kostní dřeně s morfologií připomínající refrakterní anémie s nadbytkem blastů, ale s monocytóza. Jiní pacienti mají těžkou neutrofilii, monocytózu a splenomegalii. Dosud není známo, zda se jedná o 2 různá onemocnění, myelodysplastickou a myeloproliferativní; nicméně, zatím neexistují žádné rozdíly v cytogenetických abnormalit nebo v růstu in vitro koloniích nebo v jejich klinického vývoje, tak tam je spor mezi lékaři a patologové podle jejich místo v klasifikaci. Podle poslední revize jsou v této kategorii umístěny:
1. Chronická myelomonocytární leukémie.
2. Atypická chronická myeloidní leukémie (BCR/ABL negativní).
3. Juvenilní myelomonocytární leukémie.
4. Myelodysplastický / myeloproliferativní syndrom nelze klasifikovat.
V kategorii akutní leukémie mieloblásticas (LAM) (která je definována jako procentní podíl větší než 20% myeloblastů v kostní dřeni, nebo lék na ředění krve periferní, nebo přítomnost cytogenetických abnormalit zejména, a to navzdory účet blastů) rozeznává následující skupiny:
1. Lam s rekurentními cytogenetickými translokacemi.
2. Lam s myelodysplastickými vlastnostmi.
3. LAM a MDS související s antineoplastickou léčbou.
4. LAM není klasifikovatelný.
5. Myeloidní sarkom.
6. Myeloidní proliferace související s Downovým syndromem.
7. Plasmacitoidní blastický novotvar dendritických buněk.
LYMFOIDNÍ NOVOTVARY,
Jsou ty, které pocházejí z buněk, které se normálně vyvíjejí do T-lymfocyty (cytotoxické LT, spolupracovníků nebo regulátory) nebo B lymfocyty (lymfocytů nebo plazmatických buněk). Obecně jsou lymfoidní novotvary rozděleny na ty, které jsou odvozeny od lymfoidních prekurzorů, a ty ze zralých lymfocytů a plazmatických buněk a následně jsou seskupeny podle jejich linie (B nebo T).
historicky byly lymfoidní novotvary, které se vyskytují v kostní dřeni a zahrnují kostní dřeň, odděleny od těch, které se vyskytují jako nádor (lymfom). Nicméně, to je nyní známo, že jakékoliv lymfom se může projevovat klinické příznaky leukémie a že jakékoli leukémie může občas přítomen jako nádor (granulocytární sarkom). Ve WHO klasifikaci, diagnostiku několika lymfoidních novotvarů závisí nejen na anatomické umístění nádoru buněk, ale také na morfologicky definovanými původu nádorových buněk. Tyto úvahy vniveč význam z hlediska L1 a L2 FAB klasifikace, jelikož nekorelují s jejich imunofenotypu, genetické abnormality nebo s jejich klinický průběh (Obrázek 8). L3 je ekvivalentní burkittovu lymfomu v leukemické fázi a měl by být diagnostikován jako takový.

1. Prekurzorové novotvary. Panuje shoda, že předchůdce novotvary, které prezentují jako solidní nádory a ty, týkající se kostní dřeně a krve jsou biologicky stejné onemocnění s různou klinickou prezentací. Většina prekurzorové lymfoidní novotvary jsou prezentovány jako leukémie, takže bylo dohodnuto, že klasifikace by měla zachovat termín LAL pro leukemické fázi typu B a T předchůdce novotvary. Existují 2 hlavní kategorie:
* prekurzorové B leukémie / lymfomy •
* prekurzorové leukémie / lymfomy T.
2. Zralé novotvary B-buněk. Navrhovaná klasifikace považuje lymfomy a leukémie stejného typu buněk za stejné onemocnění s různými klinickými projevy nebo stadii. Specifická onemocnění odvozená od zralých B buněk jsou následující:
1. Chronická lymfocytární leukémie / lymfom malých lymfocytů.
2. Lymfoplazmacytární lymfom.
3. Lymfom z plášťových buněk.
4. Prolymfocytární leukémie B-buněk.
5. Folikulární lymfom.
6. Difúzní velkobuněčný lymfom B.
• Intravaskulární velkobuněčný lymfom z B.
• Primární mediastinální velkobuněčný lymfom B.
• velkobuněčný lymfom B (týkající se virus Epstein Barrové-EBV).
•• velký B-buněčný lymfom bohatý na histiocyty a T-buňky.
* difuzní centrální nervový systém velký B-buněčný lymfom.
* * difuzní primární kožní velkobuněčný lymfom.
* difuzní velkobuněčný lymfom starších pacientů pozitivní na EBV.
* Pasmablastický lymfom.
* primární pleurální lymfom.
* * alkoma-pozitivní (ALK) velkobuněčný lymfom.
* Burkittův lymfom.
7. Marginální zóna B-buněčný lymfom.
8. Extranodální okrajová zóna B-buněčný lymfom.
9. Lymfom B-buněk splenické marginální zóny
10. Trichocelulární leukémie.
11. Plazmocytom / myelom plazmatických buněk.

MYELOIDNÍ A LYMFOIDNÍ LINIE NOVOTVARY
Některé novotvary express markery obou myeloidní a lymfoidní linie.nediferencované) nebo současné charakteristiky obou linií (smíšený fenotyp nebo smíšená linie akutní leukémie).
Tabulka 3.Clasificación de la OMS de las neoplasias mieloides y leucemias agudas
BIBLIOGRAFÍA
Bassan R, Hoelzer, D. Moderní Terapie Akutní Lymfoblastické Leukémie. J Clin Oncol. 2011;29:523-43.
Burnett A, Wetzler M, Löwenberg B. terapeutický pokrok v akutní leukémii. J Clin Oncol. 2011;29:487-94.
Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. Klasifikace lymfoidních novotvarů who z roku 2008 a dále: vyvíjející se koncepty a praktické aplikace. Krev. 2011 Smět 12; 117 (19): 5019-32. Epub 2011 Února 7. Recenze.
Cortes J, Hochhaus A, Hugues T, Kantajian H. první linie a záchranné terapie s inhibitory tyrosinkinázy a další léčby chronické myeloidní leukémie. J Clin Oncol. 2011;29:524-31.
Chin-Hon Pui, Carroll WL, et al. Biologie, stratifikace rizik a terapie dětské akutní leukémie: aktualizace. J Clin Oncol. 2011;29:551-65.
Gambacorti PC, Antolin L, Hurtado PAN Multicentrické nezávislé posouzení ourcomes u chronické myeloidní leukémie léčených Imatinibem. Časopis National Cancer Institute. 2011;103:1-9.
Grever M, Lozanki G. Moderní strategie pro trichocelulární leukémii. J Clin Oncol. 2011:29;583-90.
Gribben JG, O ‚ Brien s. aktuální informace o léčbě chronické lymfocytární leukémie. J Clin Oncol. 2011;29:544-50.
Hurtado MR, Vargas VP, Cortes FJ. Chronická Myeloidní Leukémie. Současné pojmy ve Fyziopatologii a léčbě. Cancerología. 2007:2:137-47.
Hurtado MR, Vargas VP, et al. Imatinib ve srovnání s imatinibem / cytarabinem pro léčbu první linie časné Philadelphia chromozom pozitivní chronické myeloidní leukémie. Výsledky randomizované klinické studie Mexické kolaborativní leukemické skupiny. Klinická Leukémie. 2008: 2(2);1128-32.
Lichtman MA. Klasifikace a klinické projevy klonálních myeloidních poruch. Williamsová. Hematologie. Mc Graw-Hill; 2010.
Marcucci G, Haferlach T, Dohner h. molekulární genetika dospělé akutní myeloidní leukémie. Prognostické a terapeutické důsledky. J Clin Oncol. 2011;29:475-86.
Rafael Hurtado M Mellado Y, Floresw RG, Pablo Vargas. Semiología de la Citometría Hemática. Rev Fac Med UNAM. 2010; 53:36-43.
Sanz M, Lo-Coco F. moderní přístupy k léčbě akutní promyelocytární leukémie. J Clin Oncol. 2011;29:495-503.
Poznámka
* dysplazie. To se odkazuje na cytomorphology změna, která zahrnuje disociace jádro-cytoplazma zrání (pamatujte si, že chromatin zrání závisí na DNA a RNA v cytoplazmě, proto jádro zastaví na zrání, zatímco cytoplazma pokračuje ve své normální proces), který produkuje non-životaschopné buňky, a tam je intramedulární apoptózy.
