Najít zdroje: „Jeden bond“ – novinky · denní tisk · knihy · vědec · JSTOR (srpen 2012) (Učit se, jak a kdy odstranit tuto šablonu zprávy)
V chemii, jednoduchá vazba, je chemická vazba mezi dvěma atomy, zahrnující dva valenční elektrony. To znamená, že atomy sdílejí jeden pár elektronů, kde se tvoří vazba. Proto je jediná vazba typem kovalentní vazby. Když je sdílen, každý ze dvou zapojených elektronů již není ve výhradním vlastnictví orbitalu, ze kterého vznikl. Spíše, oba dva elektrony tráví čas v jednom z orbitálů, které se překrývají v procesu vazby. Jako Lewis struktura, jeden dluhopis je označován jako AːA nebo -, pro které představuje prvek (Moore, Stanitski, a Jurs 329). V prvním ztvárnění, každá tečka představuje sdílený elektron, a ve druhém ztvárnění, tyč představuje oba elektrony sdílené v jediné vazbě.

kovalentní vazba může být také dvojná vazba nebo trojná vazba. Jeden dluhopis je slabší než dvojná vazba nebo trojná vazba. Tento rozdíl v síle lze vysvětlit tím, že zkoumá komponenty dluhopisů, které každý z těchto typů kovalentních vazeb se skládá (Moore, Stanitski, a Jurs 393).
obvykle je jedna vazba sigma vazba. Výjimkou je vazba v diboronu, což je vazba pi. V kontrastu, dvojná vazba se skládá z jedné vazba sigma a jedna pi vazba, a trojnou vazbou se skládá z jedné vazba sigma a dvě pí dluhopisů (Moore, Stanitski, a Jurs 396). Počet vazeb komponent je to, co určuje rozdíly v síle. Je logické, že jeden dluhopis je nejslabší ze tří, protože se skládá pouze sigma vazba, dvojné nebo trojné vazby se skládají nejen z tohoto typu součásti pouto, ale také nejméně jeden další pouto.
jednoduchá vazba má schopnost rotace, vlastnost, kterou nemá dvojná vazba nebo trojná vazba. Struktura vazeb pi neumožňuje rotaci (alespoň ne při 298 K), takže dvojná vazba a trojná vazba, které obsahují vazby pi, jsou drženy díky této vlastnosti. Sigma vazba není tak omezující a jednoduchá vazba je schopna otáčet pomocí sigma vazby jako osy rotace (Moore, Stanitski, and Jurs 396-397).
Další porovnání vlastností lze provést v délce vazby. Jednoduché vazby jsou nejdelší ze tří typů kovalentních vazeb, protože interatomická přitažlivost je větší u dvou dalších typů, dvojitý a trojitý. Zvýšení vazeb komponent je důvodem tohoto zvýšení přitažlivosti, protože mezi vázanými atomy je sdíleno více elektronů (Moore, Stanitski a Jurs 343).
jednotlivé vazby jsou často pozorovány v diatomických molekulách. Příklady tohoto použití jednoduchých vazeb zahrnují H2, F2 a HCl.
jednotlivé vazby jsou také pozorovány v molekulách složených z více než dvou atomů. Příklady použití jednoduché vazby patří:
- Obě vazby v H2O
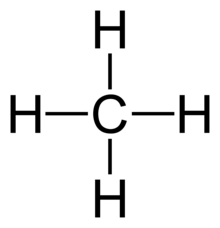
- Všechny 4 vazby v CH4
Single lepení dokonce se objeví v molekuly tak složité, jak uhlovodíků větší než metan. Typ kovalentní vazby v uhlovodících je v nomenklatuře těchto molekul nesmírně důležitý. Uhlovodíky obsahující pouze jednotlivé vazby se označují jako alkany (Moore, Stanitski, and Jurs 334). Názvy specifických molekul, které patří do této skupiny, končí příponou-ane. Příklady zahrnují Ethan, 2-methylbutan a cyklopentan (Moore, Stanitski a Jurs 335).