Kromě vodíku na uhlík-uhlík dvojné vazby se nazývá hydrogenace. Celkovým účinkem takového přidání je redukční odstranění funkční skupiny dvojných vazeb. Regioselektivita není problém, protože stejná skupina (atom vodíku) je vázána na každý z dvojných vazebných uhlíků. Nejjednodušším zdrojem dvou atomů vodíku je molekulární vodík (H2), ale smíchání alkenů s vodíkem nevede k žádné rozpoznatelné reakci. I když celkový hydrogenační reakce je exotermní, vysoká aktivační energie brání probíhá za normálních podmínek. Toto omezení může být obcházeno použitím katalyzátoru, jak je znázorněno na následujícím diagramu.
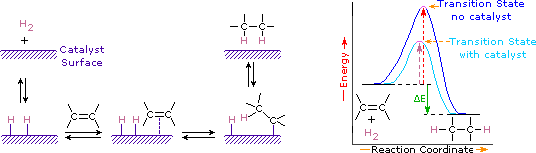
Katalyzátory jsou látky, které mění rychlost (rychlosti) chemické reakce, aniž by byl spotřebován, nebo se objevuje jako součást produktu. Katalyzátory působí snížením aktivační energie reakcí, ale nemění relativní potenciální energii reaktantů a produktů. Jemně rozdělené kovy, jako je platina, palladium a nikl, patří mezi nejpoužívanější hydrogenační katalyzátory. Katalytická hydrogenace probíhá nejméně ve dvou fázích, jak je znázorněno na obrázku. Nejprve musí být Alken adsorbován na povrchu katalyzátoru spolu s částí vodíku. Dále se dva vodíky přesouvají z povrchu kovu na uhlíky dvojné vazby a výsledný nasycený uhlovodík, který je slabě adsorbován, opouští povrch katalyzátoru. Přesná povaha a načasování posledních událostí není dobře pochopeno.
jak je znázorněno na energetickém diagramu, hydrogenace alkenů je exotermní a teplo se uvolňuje odpovídající ΔE (zelené barvě) v diagramu. Toto reakční teplo lze použít k posouzení termodynamické stability alkenů s různým počtem alkylových substituentů na dvojné vazby. Například následující tabulka uvádí zahřívání hydrogenace pro tři alkeny C5H10, které poskytují stejný alkanový produkt (2-methylbutan). Vzhledem k tomu, že velké reakční teplo naznačuje vysokoenergetický reaktant, jsou tato tepla nepřímo úměrná stabilitám alkenových izomerů. Na hrubou aproximací, vidíme, že každý alkyl substituent na dvojnou vazbu stabilizuje tato funkční skupina o trochu více než 1 kcal/mol.
| z alken Izomer | (CH3)2CHCH=CH2 3-methyl-1-buten |
CH2=C(CH3)CH2CH3 2-methyl-1-buten |
(CH3)2C=CHCH3 2-methyl-2-buten |
|---|---|---|---|
| Reakční Teplo ( ΔHº ) |
-30.3 kcal/mol | -28.5 kcal/mol | -26.9 kcal/mol |
Z mechanismu je znázorněno zde bychom očekávali, že přidáním vodíku se vyskytují s syn-stereoselectivity. To je často pravda, ale hydrogenační katalyzátory mohou také způsobit izomeraci dvojné vazby před přidáním vodíku, v takovém případě může být stereoselektivita nejistá.
tvorba komplexů přechodných kovů s alkeny byla přesvědčivě prokázána izolací stabilních komplexů platiny, jako je zeisova sůl, k. H2O a ethylenebis (trifenylfosfin)platina, 2Pt (H2C=CH2). V posledně jmenovaném je platina třísložková a nulová, zatímco zeiseova sůl je derivátem platiny (II). Model zeiseovy soli a diskusi o neobvyklém spojení v takových komplexech si můžete prohlédnout kliknutím zde. Podobné komplexy byly hlášeny pro nikl a palladium, kovy, které také fungují jako katalyzátory pro alkenovou hydrogenaci.
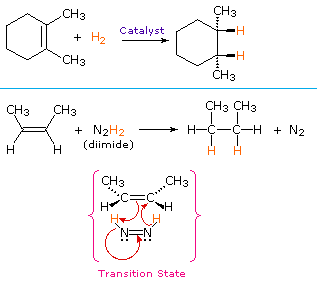
non-katalytické postup pro syn-kromě vodíku využívá nestabilní sloučenina diimide, N2H2. Toto činidlo musí být čerstvě vytvořené v reakci systému, obvykle oxidace hydrazinu, a silně exotermická reakce je zvýhodněný odstranění dusíku (velmi stabilní sloučenina). Diimid může existovat jako cis-trans izomery; pouze CIS-izomer slouží jako redukční činidlo. Příklady alkenových redukcí oběma postupy jsou uvedeny níže.
Přispěvatelé
- William Reusch, Emeritní Profesor (Michigan, Usa), Virtuální Učebnice Organické Chemie