Cíle Vzdělávání
na konci této části, budete moci:
- Zkoumat přenos tepla.
- Vypočítejte konečnou teplotu z přenosu tepla.
dosud jsme diskutovali o změně teploty v důsledku přenosu tepla. Při přenosu tepla nedochází ke změně teploty, pokud se led roztaví a stane se kapalnou vodou (tj. Zvažte například kapání vody z rampouchů, které se tají na střeše zahřáté sluncem. Naopak voda zamrzne v ledové misce chlazené okolím s nižší teplotou.

Obrázek 1. Teplo ze vzduchu se přenáší na led, což způsobuje jeho roztavení. (credit: Mike Značky)
Energie je nutné k roztavení pevné, protože soudržné vazby mezi molekulami v tuhých musí být rozdělena tak, aby v kapalině, molekuly se mohou pohybovat na srovnatelné kinetické energie; nedochází tedy ke zvýšení teploty. Podobně je zapotřebí energie k odpařování kapaliny, protože molekuly v kapalině spolu interagují prostřednictvím atraktivních sil. Nedochází ke změně teploty, dokud není dokončena změna fáze. Teplota šálku sody zpočátku při 0 ° C zůstává na 0 ° C, dokud se veškerý led neroztaví. Naopak energie se uvolňuje během zmrazování a kondenzace, obvykle ve formě tepelné energie. Práce se provádí soudržnými silami, když jsou molekuly spojeny. Odpovídající energie musí být vydávána (rozptýlena), aby mohla zůstat pohromadě Obrázek 2.
energie ve fázi změny závisí na dvou hlavních faktorech: počet a sílu dluhopisů nebo nutit páry. Počet vazeb je úměrný počtu molekul a tím i hmotnosti vzorku. Síla sil závisí na typu molekul. Teplo Q potřebné ke změně fáze ze vzorku o hmotnosti m, je dána tím,
Q = mLf (tání/tuhnutí,
Q = mLv (odpařování/kondenzace),
kde latentní teplo tání, Lf a latentní teplo odpařování, Lv, jsou materiálové konstanty, které jsou stanoveny experimentálně. Viz (Tabulka 1).

Obrázek 2. (a) energie je nutná k částečnému překonání přitažlivých sil mezi molekulami v pevné látce, aby se vytvořila kapalina. Stejná energie musí být odstraněna, aby došlo k zmrazení. (b) molekuly jsou odděleny velkými vzdálenostmi při přechodu z kapaliny na páru, což vyžaduje značnou energii k překonání molekulární přitažlivosti. Stejná energie musí být odstraněna, aby došlo ke kondenzaci. Nedochází ke změně teploty, dokud není dokončena změna fáze.
latentní teplo se měří v jednotkách J / kg. Jak Lf, tak Lv závisí na látce, zejména na síle jejích molekulárních sil, jak bylo uvedeno výše. LF a Lv se souhrnně nazývají latentní tepelné koeficienty. Jsou latentní nebo skryté, protože ve fázových změnách energie vstupuje nebo opouští systém, aniž by způsobila změnu teploty v systému; takže ve skutečnosti je energie skrytá. Tabulka 1 uvádí reprezentativní hodnoty Lf a Lv spolu s body tání a varu.
tabulka ukazuje, že významné množství energie se podílí na fázových změnách. Pojďme se podívat například na to, kolik energie je potřeba k roztavení kilogram ledu na 0 ° C k výrobě kilogramu vody o teplotě 0°C. Pomocí rovnice pro změnu teploty a hodnoty pro vodu z Tabulky 1, zjistíme, že Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ je energie k roztavení kilogramu ledu. To je hodně energie, neboť představuje stejné množství energie potřebné ke zvýšení teploty 1 kg vody z 0 ° C 79,8 ° C. Ještě víc energie je zapotřebí k odpaření vody; to bude trvat 2256 kJ změnit 1 kg tekuté vody při normálním bodu varu (100 ° C při atmosférickém tlaku) pára (vodní pára). Tento příklad ukazuje, že energie pro změnu fáze je obrovská ve srovnání s energií spojenou se změnami teploty bez změny fáze.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Vezměte si, například, skutečnost, že teplota vzduchu ve vlhkém podnebí zřídka jít nad 35.0 ° C, což je proto, že většina tepla jde do odpaření vody do vzduchu. Podobně teploty ve vlhkém počasí zřídka klesají pod rosný bod, protože při kondenzaci vodní páry se uvolňuje obrovské teplo.
zkoumáme účinky fázové změny přesněji zvážením přidání tepla do vzorku ledu při −20ºC (obrázek 3). Teplota ledu stoupá lineárně a absorbuje teplo konstantní rychlostí 0,50 cal / g⋅ºC, dokud nedosáhne 0ºC. Jednou při této teplotě se led začne tát, dokud se veškerý led neroztaví a absorbuje 79,8 cal / g tepla. Teplota zůstává konstantní při 0 ° C během této změny fáze. Jakmile se veškerý led roztaví, teplota kapalné vody stoupá a absorbuje teplo novou konstantní rychlostí 1,00 cal / g⋅ºC. Při 100 ° C se voda začne vařit a teplota opět zůstává konstantní, zatímco voda během této změny fáze absorbuje 539 cal/g tepla. Když se veškerá kapalina stala parní párou, teplota opět stoupá a absorbuje teplo rychlostí 0,482 cal / g⋅ºC.
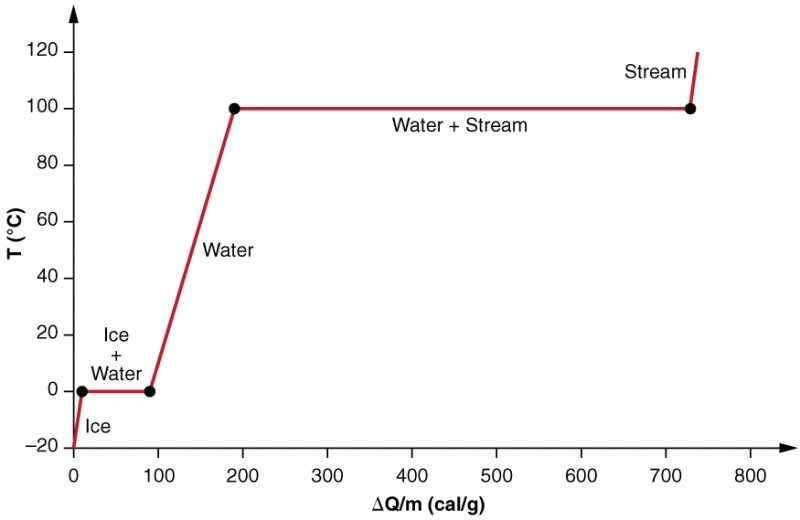
Obrázek 3. Přidán graf teploty versus energie. Systém je konstruován tak, aby se žádná pára neodpařovala, zatímco se led zahřívá, aby se stal kapalnou vodou, a tak, když dojde k odpařování, pára zůstává v systému. Dlouhé úseky konstantních hodnot teploty při 0 ° C a 100 ° C odrážejí velké latentní teplo tavení a odpařování.
voda se může odpařit při teplotách pod bodem varu. Je potřeba více energie než na bod varu, protože kinetická energie molekul vody při teplotách pod 100 ° C je menší než při 100 ° C, tedy méně energie je dostupné z náhodných tepelných pohybů. Vezměte si, například, skutečnost, že na tělesnou teplotu, pot z kůže vyžaduje tepelném příkonu 2428 kJ/kg, což je o 10 procent vyšší, než latentní teplo odpařování na 100 ° C. Toto teplo pochází z pokožky a poskytuje tak účinný chladicí mechanismus v horkém počasí. Vysoká vlhkost zabraňuje odpařování, takže by mohla vzrůst tělesná teplota, takže na obočí zůstane nevypařený pot.
Příklad 1. Vypočítejte konečnou teplotu z fázové změny: chladící Soda s kostkami ledu
tři kostky ledu se používají k chlazení sody při 20 ° C s hmotností msoda = 0,25 kg. LED je při 0 ° C a každá kostka ledu má hmotnost 6,0 g. Předpokládejme, že soda je uchovávána v pěnové nádobě, aby bylo možné ignorovat tepelné ztráty. Předpokládejme, že soda má stejnou tepelnou kapacitu jako voda. Najděte konečnou teplotu, když se veškerý led roztaví.
strategie
kostky ledu mají teplotu tání 0ºC. Teplo se přenáší ze sody na led pro tání. Tání ledu probíhá ve dvou krocích: nejprve dojde ke změně fáze a pevná látka (LED) se při teplotě tání přemění na kapalnou vodu, poté teplota této vody stoupá. Tání výnosy vody při 0 ° C, takže více tepla se přenese ze sody do této vody, dokud voda a soda systém dosáhne tepelné rovnováhy, Qice = − Qsoda.
teplo převedeno do ledu,
Qice = myši Lf + micecW(Tf−0 ° C).
teplo vydávané sodou je Qsoda = msodacW (Tf-20ºC). Protože není ztraceno žádné teplo, Qice = −Qsoda, takže
myši Lf + micecW(Tf−0ºC) = –msodacW (Tf-20ºC).
Přineste všechny výrazy zahrnující Tf na levé straně a všechny ostatní výrazy na pravé straně. Řešení pro neznámé množství Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Řešení
- Identifikovat známé množství. Hmotnost ledu je myši = 3 × 6,0 g = 0,018 kg a hmotnost sody je msoda = 0,25 kg.
- Výpočet výrazy v čitateli: m sodacW(-20 ° C)=(0,25 kg)(4186 J/kg ⋅ ° C)(-20 ° C) = 20,930 J a miceLf = (0.018 kg)(334,000 J/kg) = 6012 J.
- Výpočet jmenovatele: (msoda + myši)cW = (0,25 kg + 0.018 kg) (4186 K/(kg ⋅cc) = 1122 J /CC.
- Výpočet konečné teploty: \displaystyle{T}_{\text{f}}=\frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Diskuse
Tento příklad ilustruje obrovské energie, zapojen, během fáze změnit. Hmotnost ledu je asi 7 procent hmotnosti vody, ale vede ke znatelné změně teploty sody. I když jsme předpokládali, že led byl při teplotě mrazu, je to nesprávné: typická teplota je-6ºC. Tato korekce však dává konečnou teplotu, která je v podstatě totožná s výsledkem, který jsme našli. Můžete mi vysvětlit proč?

obrázek 4. Kondenzace na sklenici ledového čaje. (kredit: Jenny Downing)
viděli jsme, že odpařování vyžaduje přenos tepla do kapaliny z okolí, takže energie je uvolňována okolím. Kondenzace je reverzní proces, který zvyšuje teplotu okolí. Toto zvýšení se může zdát překvapivé, protože spojujeme kondenzaci se studenými předměty-například sklo na obrázku. Energie však musí být odstraněna z kondenzačních molekul, aby se kondenzovala pára. Energie je přesně stejná jako energie potřebná k provedení změny fáze v opačném směru, z kapaliny na páru, a tak ji lze vypočítat z Q = mLv.
Na obrázku 4 vzniká kondenzace, protože teplota okolního vzduchu je snížena pod rosný bod. Vzduch nemůže zadržet tolik vody jako při pokojové teplotě, a tak voda kondenzuje. Energie se uvolňuje, když voda kondenzuje, což urychluje tání ledu ve skle.
aplikace v reálném světě
energie se také uvolňuje, když kapalina zamrzne. Tento jev používají pěstitelé ovoce na Floridě k ochraně pomerančů, když je teplota blízká bodu mrazu (0ºC). Pěstitelé stříkají vodu na rostliny v sadech, aby voda zamrzla a teplo se uvolnilo do rostoucích pomerančů na stromech. Tím se zabrání tomu, aby teplota uvnitř pomeranče klesla pod bod mrazu, což by poškodilo ovoce.

obrázek 14.11. Led na tyto stromy uvolní velké množství energie, když je zmrazil, pomáhá, aby se zabránilo teplota stromy z klesá pod 0 ° C. Voda je záměrně stříkána na sady, aby se zabránilo tvrdým mrazům. (kredit: Hermann Hammer)
sublimace je přechod z pevné fáze do parní fáze. Možná jste si všimli, že sníh může zmizet v tenkém vzduchu bez stopy tekuté vody nebo zmizení kostek ledu v mrazáku. Opak je také pravdou: mráz se může tvořit na velmi chladných oknech, aniž by prošel kapalným stupněm. Oblíbeným účinkem je výroba „kouře“ ze suchého ledu, což je pevný oxid uhličitý. K sublimaci dochází, protože rovnovážný tlak par pevných látek není nulový. Některé osvěžovače vzduchu používají sublimaci pevné látky k vstříknutí parfému do místnosti. Můra kuličky jsou mírně toxické příklad fenol (organické sloučeniny), které sublimoval, zatímco některé tuhé látky, např. oxidem osmičelým, jsou tak toxické, že musí být uchovávány v uzavřených nádobách, aby se zabránilo expozici, aby jejich sublimace-vyrobené páry.

obrázek 5. Přímé přechody mezi pevnou látkou a párou jsou běžné, někdy užitečné a dokonce krásné. a) suchý led sublimuje přímo na plynný oxid uhličitý. Viditelná pára je vyrobena z kapiček vody. (kredit: Windell Oskay) (b) mráz vytváří vzory na velmi chladném okně, příklad pevné látky vytvořené přímo z páry. (kredit: Liz West)
všechny fázové přechody zahrnují teplo. V případě přímých přechodů pevných par je požadovaná energie dána rovnicí Q = mLs, kde Ls je teplo sublimace, což je energie potřebná ke změně 1.00 kg látky z pevné fáze do fáze páry. Ls je analogický s Lf a Lv a jeho hodnota závisí na látce. Sublimace vyžaduje vstup energie, takže suchý led je účinným chladivem, zatímco reverzní proces (tj. Množství energie potřebné pro sublimaci je stejného řádu jako u jiných fázových přechodů.
materiál uvedený v této části a předchozí části nám umožňuje vypočítat libovolný počet účinků souvisejících se změnou teploty a fáze. V každém případě je nutné určit, které změny teploty a fáze probíhají, a poté použít příslušnou rovnici. Mějte na paměti, že přenos tepla a práce mohou způsobit změny teploty i fáze.
strategie řešení problémů pro účinky přenosu tepla
- Prozkoumejte situaci a zjistěte, že došlo ke změně teploty nebo fáze. Dochází k přenosu tepla do nebo ze systému? Pokud není přítomnost nebo nepřítomnost fázové změny zřejmá, možná budete chtít problém nejprve vyřešit, jako by nedošlo k žádným fázovým změnám, a prozkoumat získanou změnu teploty. Pokud stačí, abyste se dostali za bod varu nebo tání, měli byste se vrátit a problém provést v krocích-změna teploty—změna fáze, následná změna teploty atd.
- Identifikujte a vypište všechny objekty, které mění teplotu a fázi.
- přesně určete, co je třeba v problému určit (Identifikujte neznámé). Písemný seznam je užitečný.
- Vytvořte seznam toho, co je dáno nebo co lze z problému odvodit, jak je uvedeno (identifikujte knowns).
- vyřešte příslušnou rovnici pro množství, které má být určeno (neznámé). Pokud je změna teploty, převedeného tepla závisí na konkrétních tepla (viz Tabulka 1 v Změny Teploty a Tepelné Kapacity) vzhledem k tomu, že pro změnu fáze, převedeného tepla závisí na latentní teplo. Viz Tabulka 1.
- nahraďte knowns spolu s jejich jednotkami do příslušné rovnice a získejte numerická řešení kompletní s jednotkami. Budete to muset provést v krocích, pokud je v procesu více než jedna fáze (například změna teploty následovaná změnou fáze).
- zkontrolujte odpověď a zjistěte, zda je to rozumné: má to smysl? Jako příklad si buďte jisti, že změna teploty nezpůsobí také fázovou změnu, kterou jste nezohlednili.
Zkontrolujte své pochopení
proč zůstává sníh na horských svazích, i když jsou denní teploty vyšší než teplota mrazu?
roztok
sníh je tvořen z ledových krystalů a je tedy pevnou fází vody. Protože pro fázové změny je nezbytné obrovské teplo, trvá určité množství času, než se toto teplo nahromadí ze vzduchu,i když je vzduch nad 0 ° C. Čím je vzduch teplejší, tím rychleji dochází k výměně tepla a tím rychleji se sníh roztaví.
Oddíl Shrnutí
- Většina látek může existovat buď v pevné, kapalné a plynu formy, které jsou označovány jako „fáze.“
- fázové změny se vyskytují při pevných teplotách pro danou látku při daném tlaku a tyto teploty se nazývají body varu a zmrazení (nebo tání).
- během fázových změn je absorbované nebo uvolněné teplo dáno: Q = mL, kde L je koeficient latentního tepla.
koncepční otázky
- přenos tepla může způsobit změny teploty a fáze. Co jiného může způsobit tyto změny?
- Jak se latentní teplo tání vody pomoci zpomalit pokles teploty vzduchu, možná brání teploty klesají výrazně pod ºC, v blízkosti velkých vodních ploch?
- jaká je teplota ledu hned poté, co se vytvoří zmrzlou vodou?
- pokud vložíte led do vody v izolované nádobě, co se stane? Roztaje se nějaký led, zamrzne více vody, nebo k tomu nedojde?
- jaký vliv má kondenzace na sklenici ledové vody na rychlost tání ledu? Urychlí kondenzace proces tavení nebo zpomalí?
- ve velmi vlhkém podnebí, kde je mnoho vodních ploch, například na Floridě, je neobvyklé, že teploty stoupají nad 35 ° C (95 ° F). V pouštích však mohou teploty stoupat daleko nad toto. Vysvětlete, jak odpařování vody pomáhá omezit vysoké teploty ve vlhkém podnebí.
- v zimě je v San Franciscu často teplejší než v nedalekém Sacramentu, 150 km ve vnitrozemí. V létě, v Sacramentu je téměř vždy teplejší. Vysvětlete, jak vodní útvary obklopující San Francisco zmírňují extrémní teploty.
- položení víka na varnou nádobu výrazně snižuje přenos tepla nutný k udržení varu. Vysvětlete proč.lyofilizované potraviny byly dehydratovány ve vakuu. Během procesu jídlo zmrzne a musí být zahříváno, aby se usnadnila dehydratace. Vysvětlete, jak vakuum urychluje dehydrataci a proč jídlo v důsledku toho zmrzne.
- když ještě vzduch ochlazuje vyzařováním v noci, je neobvyklé, že teploty klesnou pod rosný bod. Vysvětlete proč.
- při ukázce ve třídě fyziky instruktor nafoukne balón ústy a poté ho ochladí v kapalném dusíku. Když je zima, zmenšený balón má v sobě malé množství světle modré tekutiny, stejně jako některé sněhové krystaly. Jak se zahřívá, kapalina se vaří, a část krystalů sublimuje, s některými krystaly přetrvávající na chvíli a pak produkovat kapalinu. Identifikujte modrou kapalinu a dvě pevné látky ve studeném balónu. Zdůvodněte své identifikace pomocí údajů z tabulky 1.
Problémy & Cvičení
- kolik tepla (v kcal), je nutné, aby rozmrazit 0.450 kg balíček mražené zeleniny původně na 0 ° C, pokud se jejich teplo tání je stejná jako z vody?
- vak obsahující 0ºC LED je mnohem účinnější při absorpci energie než vak obsahující stejné množství vody 0ºC. (a) kolik tepla je nutné zvýšení teploty 0,800 kg vody z 0 ° C na 30.0 ° C? (b) kolik přenosu tepla je zapotřebí k prvnímu roztavení 0.800 kg 0ºC ledu a pak zvýšit jeho teplotu? (c) vysvětlete, jak vaše odpověď podporuje tvrzení, že ice je účinnější.
- (a) kolik tepla je potřeba k ohřátí na teplotu 0.750 kg hliníkové hrnce obsahující 2.50 kg vody z 30.0 ° C do bodu varu a pak se vaří pryč 0.750 kg vody? (b) jak dlouho to trvá, pokud je rychlost přenosu tepla 500 W 1 watt = 1 joule / s (1 W = 1 J/s)?
- tvorba kondenzace na sklenici ledové vody způsobuje, že se led roztaví rychleji, než by jinak. Pokud 8.00 g kondenzace se tvoří na sklenici obsahující jak vodu, tak 200 g ledu, kolik gramů ledu se v důsledku toho roztaví? Předpokládejme, že k žádnému jinému přenosu tepla nedochází.
- na výletě si všimnete, že 3,50 kg pytel ledu vydrží v průměru jeden den ve vašem chladiči. Jaký je průměrný výkon ve wattech vstupujících do ledu, pokud začíná na 0ºC a úplně se roztaví na 0ºC vody přesně za jeden den 1 watt = 1 joule / s (1 W = 1 J/s)?
- za určitého suchého slunečného dne by teplota bazénu vzrostla o 1,50 ºC, pokud by nedošlo k odpařování. Jaká část vody se musí odpařit, aby odnesla přesně tolik energie, aby udržovala konstantní teplotu?
- (a) kolik tepla je nutné zvýšení teploty 0,200 kg kus ledu od -20.0 ° C do 130ºC, včetně energie potřebné pro fáze změny? (b) kolik času je zapotřebí pro každý stupeň, za předpokladu konstantní rychlosti přenosu tepla 20,0 kJ/s? (c) vytvořte graf teploty versus čas pro tento proces.
- v roce 1986 se z Rossova ledového šelfu v Antarktidě odtrhl obří ledovec. Byl přibližně obdélník 160 km dlouhý, 40.0 km široký a 250 m tlustý. a) jaká je hmotnost tohoto ledovce vzhledem k tomu, že hustota ledu je 917 kg / m3? (b) kolik přenosu tepla (v joulech) je zapotřebí k jeho roztavení? (c) Kolik let by trvalo, sluneční světlo sám k roztavení ledu to tlusté, jestli ledu absorbuje v průměru 100 W/m2, 12.00 h za den?
- Kolik gramů kávy se musí odpařit z 350 g kávy na 100 g skleněná šálek chladné kávy z 95.0 ° C do 45.0 ° C? Můžete předpokládat, že káva má stejné tepelné vlastnosti jako voda a že průměrné teplo odpařování je 2340 kJ / kg (560 cal / g). (Můžete zanedbat změnu hmotnosti kávy, jak se ochladí, což vám dá odpověď, která je o něco větší než správná.)
- (a) je obtížné uhasit požár na ropném tankeru, protože každý litr ropy uvolňuje při spalování 2,80 × 107 J energie. Pro ilustraci obtížnosti, spočítat počet litrů vody, které musí být vynaloženy, aby absorbovat energii uvolněnou spálením 1.00 L ropy, pokud vody má její teplota zvýšila z 20.0 ° C na 100 ° c, to se vaří a vzniklá pára je zvýšen na 300 ºC. b) diskutovat o dalších komplikacích způsobených skutečností, že ropa má menší hustotu než voda.
- energie uvolněná z kondenzace v bouřkách může být velmi velká. Vypočítejte energii uvolněnou do atmosféry pro malou bouři o poloměru 1 km za předpokladu, že se v této oblasti rovnoměrně vysráží 1, 0 cm deště.
- aby se zabránilo poškození mrazem, nastříká se 4,00 kg vody 0ºC na ovocný strom. (a) kolik přenosu tepla nastane, když voda zamrzne? b) o kolik by se snížila teplota stromu o hmotnosti 200 kg, kdyby se toto množství tepla přeneslo ze stromu? Vezměte měrné teplo na 3,35 kJ / kg · ºC a předpokládejte, že nedojde ke změně fáze.
- hliníková mísa o hmotnosti 0,250 kg s obsahem 0,800 kg polévky při 25,0 ° C se umístí do mrazničky. Jaká je konečná teplota, pokud se z misky a polévky přenese 377 kJ energie, za předpokladu, že tepelné vlastnosti polévky jsou stejné jako u vody?
- kostka ledu o hmotnosti 0,0500 kg při teplotě -30,0 ° C se umístí do 0,400 kg vody 35,0 ° C ve velmi dobře izolované nádobě. Jaká je konečná teplota?
- Pokud si nalít 0.0100 kg 20,0 ° C voda na 1.20 kg ledu (která je zpočátku na -15.0 ° C), jaká je konečná teplota? Můžete předpokládat, že voda ochlazuje tak rychle, že účinky okolí jsou zanedbatelné.
- domorodí lidé někdy vaří ve vodotěsných koších umístěním horkých kamenů do vody, aby je přivedli k varu. Jaká je hmotnost 500ºC rock musí být umístěny ve 4.00 kg 15.0 ° C vody, aby její teplota na 100 ° c, pokud 0.0250 kg vody uniká jako pára z počáteční prskání? Můžete zanedbávat účinky okolí a brát průměrné specifické teplo hornin jako žulu.
- Jaká by byla konečná teplota pánve a vody ve Výpočtu Konečné Teplotě, Když je Teplo Se přenáší Mezi Dvěma Subjekty: Nalití Studené Vody na rozpálené Pánvi, když 0.260 kg vody byl umístěn v pánvi a 0.0100 kg vody se odpaří okamžitě, ponechávaje zbytek, aby přišel společný teploty s pan?
- v některých zemích se tekutý dusík používá na mléčných vozících místo mechanických chladniček. A 3.00hodinová dodací cesta vyžaduje 200 L kapalného dusíku, který má hustotu 808 kg / m3. a) vypočítejte přenos tepla potřebný k odpaření tohoto množství kapalného dusíku a zvýšení jeho teploty na 3,00 ºC. (Použijte cp a předpokládejme, že je konstantní v teplotním rozsahu.) Tato hodnota je množství chlazení kapalného dusíku. b) jaká je tato rychlost přenosu tepla v kilowatthodinách? c) Porovnejte množství chlazení získané roztavením stejné hmotnosti 0ºc ledu s množstvím z odpařování kapalného dusíku.
- někteří milovníci zbraní vyrábějí vlastní kulky, což zahrnuje tavení a odlévání olověných slimáků. Kolik přenosu tepla je zapotřebí ke zvýšení teploty a roztavení 0,500 kg olova, počínaje 25,0 ° C?
Slovníček pojmů
teplo sublimace: energie potřebné ke změně látky z pevné fáze do plynné fáze,
latentní teplo koeficient: fyzikální konstanta rovná množství tepla převedeno na každý 1 kg látky při změně fáze látky
sublimace: přechod z pevné fáze do plynné fáze,
Vybrané Řešení Problémů & Cvičení
1. 35,9 kcal
3. a) 591 kcal; b) 4,94 × 103 S
5. 13,5 W
7. (a) 148 kcal; (b) 0.418 s, 3.34 s, 4.19 s, 22.6 s, 0.456 s
9. 33,0 g
10. a) 9,67 L; B) ropa je méně hustá než voda, takže se vznáší nad vodou, čímž ji vystavuje kyslíku ve vzduchu, který používá ke spalování. Také, pokud je voda pod olejem, je méně účinná při absorpci tepla generovaného olejem.
12. a) 319 kcal; b) 2.00 ºC
14. 20.6 ºC
16. 4,38 kg
18. (a) 1.57 × 104 kcal; (b) 18.3 kW ⋅ h; (c) 1.29 × 104 kcal
- Hodnoty uvedené v normální tání a teploty varu na standardní atmosférický tlak (1 atm). ↵
- Na 37.0 ° C (tělesná teplota), teplo vypařování Lv pro vodu je 2430 kJ/kg nebo 580 kcal/kg ↵
- Na 37.0 ° C (tělesná teplota), teplo vypařování Lv pro vodu je 2430 kJ/kg nebo 580 kcal/kg ↵