A Microbial Biorealm page on the genus Enterococcus faecalis
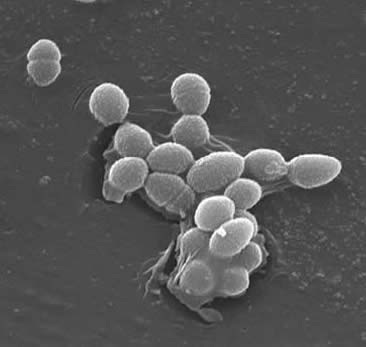
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Druhy
Enterococcus faecalis
Popis a význam
Enterokoky jsou Gram-pozitivní koky, které mohou přežít drsné podmínky v přírodě. Mohou se nalézt v půdě, vodě a rostlinách. Některé kmeny se používají při výrobě potravin, zatímco jiné jsou příčinou závažných lidských a zvířecích infekcí (např. jsou známé pro kolonizaci trávicího a genitálního traktu člověka). Jsou spojeny s komunitními i nemocničními infekcemi. Enterokoky mohou růst při teplotním rozmezí 10 až 42°C a v prostředích s širokými hodnotami pH. O některých je známo, že jsou pohyblivé. Zatímco existuje více než 15 druhů rodu Enterococcus, 80-90% klinických izolátů je E. faecalis (8). Enterokoky obvykle tvoří krátké řetězce nebo jsou uspořádány ve dvojicích. Za určitých růstových podmínek se však prodlužují a vypadají kokobacilárně. Obecně jsou enterokoky alfa-hemolytické. Některé mají lancefieldův antigen skupiny D a mohou být detekovány pomocí aglutinačních testů na bázi monoklonálních protilátek.Enterokoky jsou typicky katalázově negativní a jsou anaerobní. Jsou schopny růst v 6,5% NaCl, mohou hydrolyzovat esculin v přítomnosti 40% žlučových solí a jsou pozitivní na pyrrolidonyl arylamidázu a leucin arylamidázu (8). Enterokoky prokázaly, že představují terapeutickou výzvu kvůli své rezistenci na mnoho antimikrobiálních léčiv, „včetně účinných látek buněčné stěny; aminoglykosidy, penicilin a ampicilin a vankomycin“ (1). Na Enterokoky mají schopnost získat širokou škálu antimikrobiální rezistence faktory, které představují vážné problémy v léčbě pacientů s enterokokových infekcí (8). Obecně lze enterokokové izoláty se sníženou citlivostí na vankomycin kategorizovat jako vanA, vanB a vanC. vanA a vanB představují největší hrozbu, protože jsou nejodolnější a geny rezistence jsou neseny na plazmidu. Protože geny rezistence jsou neseny na plazmidu, jsou snadno přenositelné, e. faecalis může tyto plazmidy přenášet konjugací (2). E. faecalis jsou také rezistentní na teikoplanin. Enterokokových kmenů, které jsou vankomycin-závislá byly nalezeny, ale jsou vzácné a méně časté než vankomycin-rezistentních kmenů (dále jen „vankomycin-rezistentní Enterokoky“ nebo „VRE“) (1).
struktura Genomu

Vzhledem k mnoha veřejných zdravotních nebezpečí, sekvence genomu, data z kmene Enterococcus bylo nutné. Kmen zvolený pro sekvenování genomové DNA byl E. faecalis V583, první izolát rezistentní na vankomycin ve Spojených státech. Genom kmene V583 byl sekvenován Institutem pro výzkum genomu (TIGR). Enterokokový genom ukazuje, že e. faecalis je metabolicky různorodý a obsahuje širokou škálu regulačních systémů. Kmen V583 obsahuje čtyři molekuly DNA: Hlavní 3 218 030 bází bakteriální chromozom a tři kruhové plazmidy. Chromozom obsahuje asi 3500 otevřený čtecí rámce (Orf), asi 1/3 z těchto Orf nemají přiřaditelné funkce (8). Tři plazmidy jsou kruhové molekuly DNA identifikované jako Plasmid-1, Plasmid-2 a Plasmid-3. Plasmid-1 obsahuje 66,320 bp, Plazmid-2 obsahuje 17,963 bp, a Plazmid-3 obsahuje 57,660 bp. Plazmidy kódují řadu genů, včetně, transposases, multi-drug resistence proteins, a ppGpp-regulovaný inhibitor růstu (8). Průměrné složení G + C chromozomu e. faecalis je 37,38%. Protože molekula DNA je tak velká, dochází k regionálním odchylkám od průměru. Jedním z těchto míst je velká část spojena s „gen rezistence na vankomycin clusteru umístěna poblíž 2.22 Mb,“ ukazuje velký nárůst v % G+C obsah (8). Tyto rozdíly spojené s antibiotickou rezistencí nebo virulence navrhl získání genetického materiálu z cizích druhů prostřednictvím horizontálního přenosu. Stále není známo, zda jsou převody zodpovědné za změny v DNA make-upu. Informace obsažené v genomu e. faecalis V583 výrazně pomůže pochopit, jak se organismus přizpůsobil všestrannému lidskému patogenu. Pomocí komparativní genomika, roli různé regulační prvky budou lépe zřejmé, v tom, jak reagují na různé stresy a ve vyjádření potenciálních faktorů virulence (8). Další studie, jako jsou tyto, navrhnou nové léky na bakteriální infekce způsobené enterokoky.Genom také obsahuje 3 EBP (kódování pro endokarditidu spojené s biofilmem pili) operony, které jsou důležité pro produkci biofilmu e. faecalis kmen OG1RF. Tento kmen používá tyto operony k výrobě povrchové pili. . Povrchové pili se používají pro „připojení k hostitelským povrchům a jsou antigenní u lidí během endokarditidy“ (9).
TIGR obsahuje kompletní seznam genů pro chromozomy e.faecalis.
buněčná struktura a metabolismus
buněčný metabolismus
enterokoky obývají drsné prostředí, jako jsou střevní trakt lidí a zvířat. Růst za těchto nepřátelských podmínek vyžaduje, aby e. faecalis měl metabolismus, který je flexibilní. E. faecalis jsou schopny nejen kvašení produkují kyselinu mléčnou, ale také může „catabolize spektrum zdroje energie ze sacharidů, glycerol, laktát, malát, citrát, diamino kyselin a manya-keto kyseliny“ (3).Bylo prokázáno, že za vybrané podmínky pro růst E. faecalis může zvýšit růst prostřednictvím oxidativní fosforylace pomocí proton motive force zřízený elektronový transport. Důsledkem „rodícího se dýchání je produkce silných oxidantů“ (např. superoxid a peroxid vodíku), oxidačního stresu, který E. faecalis snáší (3). Toleranci stresu, v kombinaci s jinými závažnými podmínky růstu, umožňuje E. faecalis růst na 10 až 45°C, v žlučových solí, a při extrémně nízké a vysoké pHs. Kromě toho může E. faecalis odolávat azidu, detergentům, těžkým kovům a ethanolu. Protože E. faecalis může využívat různé zdroje cukru, může žít v různých prostředích, zejména ve střevě, kde jsou živiny omezené (2). Ve střevě e. faecalis odvozuje většinu své energie z fermentace neabsorbovaných cukrů. E. faecalis může také získat energii tím, ponižující muciny, sacharid, který je silně glykosylovaný a produkován střevní pohárkových buněk (2).E. faecalis používá „phosphoenolypyruvate fosfotransferázu systém (PTS) smysl cukry vně buňky a páry příjmu cukrů s fosforylace“ (2). Přitom se plýtvá méně energie (ATP)ve srovnání s tím, jak se cukr akumuluje systémy bez PTS. Cukry metabolizované e. faecalis zahrnují: D-glukózu, D-fruktózu, laktózu, maltózu(všechny substráty PTS). U enterokoků PTS také reguluje metabolismus glycerolu, vylučování induktorů a represi katabolitů (8). E. faecalis je jedna z mála low-G+C obsah Gram-pozitivní bakterie, které vyhnat cukr během růstu na glukóze, což je jev známý jako induktor vyhoštění (8). E. faecalis může dokonce fermentovat glycerol za aerobních a mikroaerofilních podmínek. E. faecalis může také růst na glycerolu za anaerobních podmínek, protože „exprimuje gen pro anaerobní aktivitu glycerol dehydrogenázy spojenou s NAD+“ (8). Glycerol může procházet buněčnou membránou pomocí proteinu nazývaného facilitátor difúze glycerolu (GlpF). GlpF činí koncentraci glycerolu uvnitř a vně buňky stejnou, protein je inhibován glykolýzou. E. faecalis jsou schopni žít v extrémně alkalickém pH a vysoké koncentraci soli. Tyto vlastnosti vyžadují kationtový transport, aby se udrželo konstantní složení cytosolických iontů nezbytné pro homeostázu. Všechny buňky musí vylučovat přebytek sodíku, aby udržely cytosolické koncentrace v rozmezí, které podporuje homeostázu. E. faecalis exprimuje jak na+/H+ antiporter, tak ATPázu vakuolárního typu (2). Draslík je hlavní intracelulární kationt. Koncentrace draslíku v. E. faecalis 0,4 až 0,6 M je nezbytný pro normální buněčný metabolismus, „neutralizuje intracelulární anionty, aktivuje různé enzymy, a reguluje pH cytosolu“ (8). E. faecalis exprimuje nejméně dva transportéry draslíku k provedení regulace, KtrI a KtrII spolu se systémem Kep pro extruzi k+ (8). I když je známo,že ktri a KtrII jsou systémy příjmu k+ (Jsou to K+/H+ symportéry), o něco více je známo proteiny.
buněčná struktura
enterokoky jsou grampozitivní koky, které obvykle tvoří krátké řetězce nebo jsou uspořádány ve dvojicích (3). Za určitých růstových podmínek se mohou prodloužit a objevit kokobacilární. Buněčná stěna E. faecalis je 20 až 38% hmotnosti suchých buněk (v exponenciálních a stacionárních fázových buňkách). Vzhledem k tomu, že e. faecalis je grampozitivní bakterie, existují tři hlavní složky, které tvoří její buněčnou stěnu: peptidoglykan, kyselina teichoová a polysacharid. 40% buněčné stěny je tvořeno peptidoglykanem, zatímco zbytek buněčné stěny je tvořen „polysacharidem obsahujícím rhamnosu a kyselinou teichoovou obsahující ribitol“ (3). Peptidioglykan funguje (jako ve většině grampozitivních buněk), aby odolával prasknutí vyvolanému vysokým cytoplazmatickým osmotickým tlakem. E. faecalis je obecně považován za non-encapsulated organismu, ukazuje „nedostatek zjistitelné mukoidní fenotyp“ (3). Podmnožiny izolátů e. faecalis však mají kapsulární polysacharid. E. faecalis může vyměňovat genetický materiál (plazmidy) konjugačními procesy indukovanými malými peptidovými feromony (2). Povrchové bílkoviny „agregační látky, které rozpoznávají specifický ligand na přijímacích buňkách“ zajišťují úspěšné spojení pro konjugaci (2).E. faecalis mají také schopnost vytvářet povrchové pili, což může vést k tvorbě biofilmu. Kmeny E. faecalis, které způsobují endokarditidu, obsahují velké množství těchto pili. Pili umožňují připojení k hostitelským povrchům (např. Kmeny E. faecalis, které způsobují endokarditidu, produkují „biofilm významně častěji a také ve větší míře než izoláty neendokarditidy“ (9).
ekologie
e. faecalis je velmi různorodý druh enterokoků. Interaguje s mnoha dalšími organismy a má účinky na životní prostředí. Enterokoky jsou členy bakteriální komunity obývající tlusté střevo u lidí. Jsou také přirozenou součástí střevní flóry u většiny ostatních savců a ptáků (8). Enterokoky se také nacházejí v půdě, rostlinách a vodě. Když jsou ve vodě, je to obvykle proto, že voda byla kontaminována fekáliemi. Ačkoli se e. faecalis v rostlinách neobjevuje příliš často, mezi rostlinami byly nalezeny jiné kmeny enterokoků a je s největší pravděpodobností kontaminovaným zdrojem vody (8).Ekologie rezistence vůči antibiotikům a přenosu genů virulence v životním prostředí stále není dobře pochopena. Hmyz, jako jsou mouchy (HF), které se vyvíjejí se v rozkládajícím se organickém materiálu může přenášet bakterie odolné vůči antibiotikům z hnoje zvířat a jiných rozkládajících se organických substrátech obytných nastavení (7). HF jsou perfektní vysílače díky živým mikrobiálním společenstvům přítomným v stanovištích, kde se vyvíjejí (např. K dobrým přenosovým vlastnostem se přidává způsob, jakým HF krmí své mladé (regurgitace) a jejich přitažlivost k lidské potravě. Protože HF může létat na velké vzdálenosti, je tento hmyz velmi dobrý pro šíření fekálních bakterií, včetně lidských a zvířecích patogenů, a případně kmenů enterokoků rezistentních na antibiotika (7). Nedávná studie zkoumala rezistenci na antibiotika a geny virulence u enterokoků z HF v restauracích rychlého občerstvení v Kanasasu. Tato studie ukázala, že „mouchy v potravinách-manipulační a servírovací potřeby může nést antibiotikum rezistentní a potenciálně nakažlivé, Enterokoky, které mají kapacitu pro horizontální přenos geny antibiotické rezistence na jiné bakterie“ (7).Účinky, které e. faecalis má na životní prostředí tendenci být více negativní. Obvykle kontaminují zásoby vody, které mohou vést k infikovaným rostlinám i infekcím u lidí (8). Antibiotické faktory mohou být také transportovány různým hmyzem (např. domácí mouchy) a zvířaty, což vede ke zvýšení počtu virulentních e. faecalis.
patologie
enterokoky se objevily jako hlavní příčina nozokomiálních infekcí a v této skupině způsobuje Enterococcus faecalis většinu lidských enterokokových infekcí. Tyto infekce mohou být lokální nebo systematické a zahrnují infekce močových cest a břicha, infekce ran, bakterémii a endokarditidu (2). Od E. faecalis jsou schopny přežít i četné problémy životního prostředí (např. extrémní teploty a přítomnosti žlučových solí) a protože oni mohou získat rezistenci vůči více antibiotikům, tyto bakterie se staly hlavní zdravotní problém. Národní systém dozoru nad nozokomiální infekcí (NNIS) hlásil zvýšení výskytu infekcí způsobených enterokoky rezistentními na vankomycin (VRE) od roku 1989 (1). To může znamenat vážné zdravotní problémy, které zahrnují nedostatek dostupné antibiotické terapie pro infekce VRE, protože většina kmenů VRE má kromě vankomycinu rezistenci na více antibiotik(např. Přenos genů rezistentních na vanocmycin z VRE na jiné grampozitivní patogeny je vážným problémem veřejného zdraví. Nejběžnější způsob, že E. faecalis, protože infekce se vyskytuje v nemocnici/dlouhodobé péče zařízení, je přenos E. faecalis mezi pacienty (8). Enterokoky mohou být přenášeny na rukou zdravotnických pracovníků a přenášeny (přenášeny) z jednoho pacienta na druhého. Ukázalo se, že VRE na rukou může přetrvávat až 60 minut (8). Přenos z rukou zdravotnického pracovníka na pacienta by mohl probíhat po kontaktu s intravenózními nebo močovými katétry pacienta. Rektální teploměry, které nejsou po použití řádně vyčištěny, mohou přenášet VRE také z pacienta na pacienta. Někdy může přenos vést k kolonizaci GI traktu pacienta se získaným kmenem. Nový kmen se pak stává součástí endogenní flóry pacienta (8). Získaný kmen, nesoucí geny rezistence na antibiotika, je schopen žít v GI traktu. Infekce pak vznikají z těchto nově získaných kmenů E. faecalis.E. faecalis může způsobit mnoho infekcí v lidském těle. Nejčastější infekcí způsobenou enterokoky je infekce močových cest. E. faecalis může způsobit infekce dolních močových cest (UTI), jako je cystitida, prostatitida a epididymitida (8). E. faecalis se také vyskytují u infekcí uvnitř břicha, pánve a měkkých tkání. E. faecalis může způsobit nozokomiální bakterémii. Zdrojem bakterémie je nejčastěji močový trakt, který se vyskytuje z infikovaného intravenózního katétru. Endokarditida je nejzávažnější enterokokovou infekcí, protože způsobuje zánět srdečních chlopní. V mnoha případech endokarditidy selhává antibiotická léčba a je nutná operace k odstranění infikované chlopně (8). Méně časté infekce způsobené E. faecalis zahrnují meningitidu, hematogenní, osteomyelitidu, septickou artritidu a (velmi vzácně) pneumonii. Vzhledem k rezistenci enterokoků na mnoho antibiotik je léčba těchto infekcí obtížná.
Aplikace Biotechnologie
Enterokoky byly studovány pro možné použití jako probiotikum (doplněk stravy, který obsahuje živé non-virulentní mikrobiální buňky, které při požití se, že příznivě ovlivňují složení střevní mikroflóry). Bylo prokázáno, že podávání kmene E. faecalis snižuje průjem. Probiotika e. faecalis se používají v krmivech kuřat/prasat/skotu ke snížení průjmu u zvířat (8).
vzhledem k vysokým vlastnostem e. faecalis způsobujícím onemocnění bylo provedeno mnohem více výzkumů, jak zastavit virulenci e. faecalis, než prospěšné použití e. faecalis.
současný výzkum
1.) Doufám, že za infekcí způsobených Enterococcus faecalis (4)
je známo, že vankomycin-rezistentních bakterií (např. E. faecalis) představovat mnoho problémů pro společnost, což způsobuje bakteriální infekce u lidí, které je obtížné léčit. Enterokokové infekce jsou náročné, protože organismy mají schopnost rychle získávat a šířit geny rezistence. Ceftobiprol (BPR) byl použit jako hodnocený cefalosporin proti grampozitivním kokům. BPR je širokospektrální parenterální cefalosporin s vysokou afinitou z grampozitivních a gramnegativních proteinů vázajících penicilin. Vykazuje také stabilitu proti hydrolýze β-laktamázami.Tato studie zkoumala aktivitu BRP proti velké sbírce e. faecalis, při pohledu na baktericidní aktivitu BPR proti izolátům rezistentním na vankomycin. Studie zjistila, že citlivost na BPR u přípravku E. faecalis není ovlivněna přítomností rezistence na vankomycin ani produkcí β-laktamázy. U kmenů E. faecalis vykazujících buď rezistenci na vankomycin (fenotypy VanA a VanB) nebo rezistenci na ampiciliin byl BPR baktericidní. Vědci ukázaly, že BPR vykazoval baktericidní aktivitu proti E. faecalis v dávce 750 mg, inhibice 100% E. faecalis činnosti. Ačkoli je přítomnost enzymu β-laktamázy u E. faecalis vzácná, její přítomnost ohrožuje použití nejúčinnějších antienterokokových β-laktamů (např. ampicilinu). BPR je špatný substrát pro enzym β-laktamázu, což vysvětluje jeho vynikající aktivitu proti β-laktamáze produkující e. faecalis.Tento výzkum prokázal, že BPR má silnou aktivitu proti velmi velké sbírce e. faecalis. Aktivita BPR nebyla ovlivněna rezistencí na vankomycin ani produkcí β-laktamázy. Proto je BPR nadějným činidlem pro použití k léčbě infekcí E. faecalis produkujících β-laktamázu a rezistentních na vankomycin u lidí.
2.) Zkoumá, jak Enterococcus faecalis rezistentní na léčivo linezolid (5)
Při použití antibiotik v léčbě bakteriální infekce, které mohou mít vliv na střevní flóru. Během léčby mohou být vybrány rezistentní bakterie, jako jsou enterokoky, a jsou potenciálně patogenní. Vznik rezistence je problémem pro nová antibiotika, protože by to mohlo ohrozit užitečnost antibiotik.Tato studie zkoumala vznik rezistence na antibiotika e. faecalis. Konkrétněji se vědci zabývali rezistencí na linezolid(první z nové třídy antibiotik známých jako „oxazolidinony“). Linezolid lze použít proti grampozitivním kokům rezistentním na více léčiv, včetně VRE. Inhibuje syntézu bakteriálních proteinů vazbou specificky na doménu v ribozomální podjednotce 50. let a není ovlivněna mechanismy rezistence, které ovlivňují jiná antibiotika. Tato studie zkoumala rychlost výskytu linezolid-rezistentních mutantů e. faecalis v zažívacím traktu gnotobiotických myší. Dělá z linezolid byl fed ve vodě s dávkami v rozmezí od 0.5, 0.005 0, 005 g/L mutanty byly všechny závislé na linezolid podáván, hladina rezistence se zvyšuje s dobou trvání expozice. V nepřítomnosti linezolidu nebyly izolovány žádné mutanty, což naznačuje, že de novo rezistence na linezolid byla u enterokoků méně častá.Výzkum zjistil, že mutace v jediném genu rRNA 23S byla kritickým krokem při vzniku linezolidové rezistence. Primární kolonizace s jednomutačními mutanty byla pozorována již 5 dní po zahájení léčby u myší.Tyto experimenty zahrnující myši pomáhají vysvětlit vzorec vzniku rezistence na linezolid pozorovaný v klinických izolátech. Výzkumný tým ukázal, že dávka je rozhodující pro dynamiku rezistence. Tato zjištění by měla pomoci definovat nejlepší léčebné strategie pro minimalizaci vzniku rezistence v klinické praxi, zřejmě zachránil mnoho životů.
3.) Ser/Thr-kinázy u Enterococcus faecalis je zjištěno, zprostředkovat antimikrobiální rezistence (6)
Enterococcus faecalis způsobuje mnoho infekcí odolných vůči antibiotikům v nemocnicích, v důsledku jeho přirozená rezistence na určitá antibiotika a jeho schopnost přežít a množit ve střevním traktu.Genetický základ rezistence pozorovaný u E. faecalis není dobře znám, tento výzkum se pokouší identifikovat příčinu rezistence. Vědci ukázali, že PrkC, jednosložkový signalizační protein obsahující doménu ser / Thr kinázy eukaryotického typu, umožnil inherentní antimikrobiální rezistenci a střevní perzistenci e. faecalis. Zjistili, že E. faecalis mutant chybí PrkC rostla wild-type sazba v nepřítomnosti antimikrobiální stres, ale ukázal, zvýšená citlivost buněk-obálka-aktivních látek, včetně antibiotik, že cílené buněčné stěny biogeneze a žlučových detergenty.PrkC reguluje fyziologické procesy v E. faecalis, které jsou klíčem k jeho úspěchu jako nozokomiální patogen. Výzkumných pracovníků předpokládaná struktura PrkC byl cytoplazmatickou kinázovou doménu oddělené transmembránový segment, že váže uvolnila vázané na peptidoglykan. To naznačuje, že PrkC byl transmembránový receptor, který monitoruje integritu buněčné stěny e.faecalis a zprostředkovává adaptivní reakce, aby se udržela tato intergrita. PrKC je důležitá pro e. faecalis způsobuje nozokomiální infekce, což naznačuje, že signální protein je cílem pro vývoj terapií k prevenci infekcí enterokoky rezistentními na antibiotika.
1.). I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Přečtěte Si, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelbergu, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Frasere. „Role mobilní DNA ve vývoji Enterococcus faecalis rezistentního na vankomycin.“ Věda. Března 2003. Svazek. 299, č. 5615. s. 2071-2074
2.) Murray BE. Května 1998. „Rozmanitost mezi multirezistentními enterokoky.“Vznikající Infekční Nemoci. Svazek. 4, č. 1. s. 46-65.
3.)De la Maza, Luis M., Marie T. Pezzlo a Janet T. Shigei. Barevný Atlas lékařské Bakteriologie. Washington, DC: americká společnost pro mikrobiologický tisk, 2004.
4.) Arias C., Singh k., Panesso D., Murray BE. „Studie Time-Kill a synergismu ceftobiprolu proti Enterococcus faecalis, včetně izolátů produkujících ß-laktamázu a vankomycinu rezistentních.“Antimikrobiální látky a chemoterapie. Června 2007. Svazek. 51, č. 6. s. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont a., Doucet-Populaire F. “ závislost na dávce vzniku rezistence na Linezolid u Enterococcus faecalis In vivo.“Journal of Infectious Diseases. 2007. Svazek. 195. s. 1480-1488.
6.) Kristich C., Wells C., Dunny G. „Ser / Thr kináza eukaryotického typu U Enterococcus faecalis zprostředkovává antimikrobiální rezistenci a perzistenci střev.“Sborník Národní akademie věd Spojených států amerických. Února 2007. Svazek. 104, č. 9. s. 3508-3513.
7.) Macovei, L., Zurek, L. „ekologie genů rezistence na antibiotika: charakterizace enterokoků z domácích mušek shromážděných v prostředí potravin.“Aplikovaná a environmentální mikrobiologie. Června 2006. Svazek. 72, č. 6. s. 4028-4035.
8.) Gilmore, Michael. Enterokoky: patogeneze, molekulární biologie a rezistence na antibiotika. Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. „Endokarditida a pili Enterococcus faecalis spojená s biofilmem.“Journal of Clinical Investigation. Října 2006. Č. 116. s. 2799-2807.
Editoval Richard a. Martinez z UC San Diego, studentka Rachel Larsen.