Chemguide: Core Chemie 14 – 16,
Double a triple kovalentní vazby
Tato stránka zavádí možnost více (dvojité nebo trojité) kovalentní vazby mezi atomy pomocí kyslíku, dusíku, oxidu uhličitého a ethene jako příklady. Ty jsou vybrány, protože jsou všechny běžně specifikovány v učebních osnovách ve Velké Británii pro děti ve věku 14-16 let.
předpokládám, že jste si přečetli stránku zavádějící kovalentní lepení a máte přístup k periodické tabulce, jako je ta, kterou si můžete stáhnout z tohoto webu.
Dvojité lepení v kyslíku
podíváte-Li se kyslík v Periodické Tabulce, zjistíte, že to má atomové číslo 8 – a tak neutrální atom má 8 protonů a 8 elektronů. Ty budou uspořádány 2,6.
Takže máte dva atomy, jako je tento:
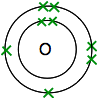
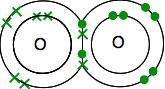
Každý má dva nepárové elektrony. Chcete-li získat maximální energetickou stabilitu, všechny z nich budou muset být spárovány.
takže kyslíky sdílejí dva páry elektronů:
Tohle je mnohem jednodušší vidět pomocí čar představují dvojici sdílených elektronů:
![]()
Trojitý lepení v dusík.
Pokud zjistíte dusíku v Periodické Tabulce, budete moci zjistit, že jeho elektronová struktura je 2,5. Ve srovnání s kyslíkem má tedy ve své vnější úrovni jeden pár elektronů a tři nepárové elektrony.
aby byla co nejvíce energeticky stabilní, bude muset všechny tyto spárovat v kovalentních vazbách. Dva atomy dusíku se proto kombinovat tímto způsobem:
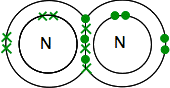
ještě jednou, toto je mnohem lépe vidět pomocí čar představují dvojici sdílené elektrony:
![]()
Dvojité lepení v oxid uhličitý,
Uhlík je elektronické struktury je 2,4 s 4 nepárové elektrony v té vnější úrovni.
kyslík je 2,6 s 2 páry elektronů a 2 nepárové elektrony ve vnější úrovni.
musíte skončit se všemi elektrony spárovanými-a existuje jen jeden způsob, jak to udělat.
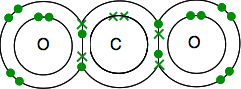
stejně Jako předtím, lepení je snadnější vidět pomocí čar pro lepení párů elektronů.
![]()
pokud existují dva vazebné páry elektronů mezi dvěma atomy, nazývá se to, nepřekvapivě, dvojná vazba. Takže každý kyslík je spojen s atomem uhlíku uprostřed dvojnou vazbou.
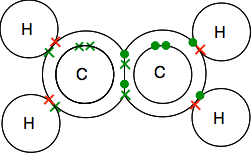
Dvojité lepení v ethene, C2H4
Ethene a jiné podobné sloučeniny s dvojnými vazbami mezi atomy uhlíku jsou důležité látky v chemii. Podrobněji se s nimi setkáte později v kurzu.
podívejte se pozorně na diagram teček a křížů a ujistěte se, že chápete, jak to všechno do sebe zapadá. Musí to být tak, aby všechny jednotlivé elektrony v uhlících i vodících byly spárovány ve vazebných párech.
Pokud narazíte na diagramy zobrazující páry lepení jako čáry, můžete najít jednu ze dvou verzí.
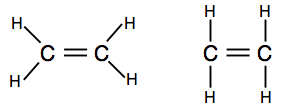
první ukazuje skutečný tvar molekuly lépe, ale druhá je také dokonale přijatelná na této úrovni.
kam byste chtěli jít teď?
na další stránku v této sekci o kovalentní vazbě . . .
do nabídky atomová struktura a lepení . . .
do menu chemie 14-16 . . .
do hlavního Menu Chemguide . . .